CMV 启动子克隆及其在植物体内的表达
于秀敏,岳文冉,王瑞刚
(内蒙古农业大学 生命科学学院,内蒙古 呼和浩特 010018)
植物基因工程已取得较大进展,但能用于植物基因工程的启动元件还非常有限.CaMV 35S启动子是目前植物基因工程中使用最为广泛的启动子[1-4].然而,近年来有关启动子特别是35S启动子引发的转基因沉默的报道越来越多[1,5].不仅如此,35S启动子的可调控性也不高,不利于外源基因表达的有效调控[6].而且,它在单子叶植物中的表达强度也比较低[7-8].因此,寻找新的启动子或改良现有启动子以便植物基因工程有更多的基因调控系统已成为当前植物基因工程研究的热点.
细胞肥大病毒(cytomegalo virus)CMV 启动子和35S启动子均为病毒来源的启动元件,基因结构较小,并具有较高的表达强度[9-10].由此推测CMV 启动子具有与35S启动子相似的表达特性,即可能具有在植物表达的特性.本文通过CMV 启动子指导的GUS intron基因在烟草叶组织内的瞬时表达,试图探讨该启动子在植物体内的表达特性和应用于植物基因工程的可能性.
1 材料与方法
1.1 材料
1.1.1 植物材料
野生型烟草(Nicotiana tabacum)品种:革新一号.本实验使用6~12周龄烟草的完全展开叶片.
1.1.2 用于PCR 克隆的引物与模板
用于CMV 启动子PCR 克隆的引物为
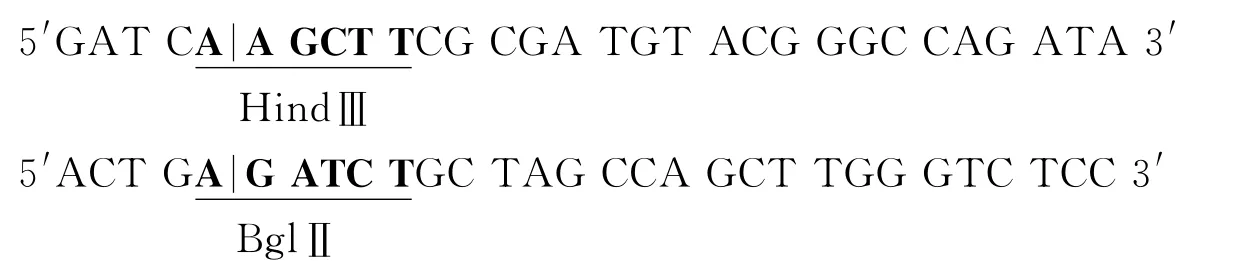
由INTEGRATED DNA TECHNOLOGIES,INC公司合成.模板为pcDNA3.1-Myc-His-A(5523bp).
1.1.3 菌株、质粒及试剂
大肠杆菌DH5α,农杆菌LBA4404(Rifr,Strr),中间载体PUC19/2×35S-GUS,pGPTV-Kan由本实验室提供.实验所用PCR Product Cleaning Up Kit,DNA Gel Extraction Kit以及Plasmid Miniprep Kit购自Qiaen Inc.USA.Taq DNA Polymerase 购自TaKaRa 公司,限制性内切酶BglⅡ,HindⅢ,EcoRⅠ和T4DNA Polymerase购自Fermentas公司,其他化学试剂均为国产或进口分析纯.
1.2 方法
1.2.1 CMV 启动子的克隆
分别以1.1.2所述PCR 引物及模板进行PCR 扩增.PCR 反应体系参见Taq DNA Polymerase说明书.PCR 反应程序为94℃预变性1min,94℃变性1min,55℃退火1min,68 ℃延伸3min,30个循环;68℃延伸7min.PCR 产物经质量浓度为10g/L的琼脂糖凝胶电泳分离后,并经DNA Gel Extraction Kit纯化收集,4 ℃临时保存备用(或-20 ℃冻存).
1.2.2 CMV 启动子与PUC19/2×35S-GUS重组载体的构建
分别用BglⅡ和HindⅢ双酶切CMV 启动子的PCR 克隆产物和植物表达载体PUC19/2×35S-GUS,质量浓度为10g/L的琼脂糖凝胶电泳分离CMV 启动子的PCR 酶切产物的700(714)bp左右的片段以及载体PUC19/2×35S-GUS酶切产物中的大片段.用DNA Gel Extraction Kit回收目的基因片段和载体大片段,将2片段用T4DNA Polymerase进行连接,然后转化大肠杆菌DH5α感受态细胞,将菌液涂于抗性筛选(Amp,100mg/L)的LB平板上,筛选重组表达载体PUC19/CMV-GUS intron.菌落PCR 初步鉴定后,小量提取质粒进行BglⅡ和HindⅢ双酶切鉴定,得到正确的重组表达载体PUC19/CMV-GUS intron,标记为PCG.
1.2.3 重组质粒PUC19/CMV-GUS intron与载体pGPTV-Kan的重组
用HindⅢ和EcoRⅠ对PUC19/CMV-GUS intron质粒DNA 和中间载体pGPTV-Kan质粒DNA 进行双酶切,经10g/L 的琼脂糖凝胶电泳分离PUC19/CMV-GUS intron的2.9kb和pGPTV-Kan的酶切大片段,并用DNA Gel Extraction Kit回收片段.将2片段用T4DNA Polymerase进行连接,然后转化大肠杆菌DH5α感受态细胞,双抗性(40mg/L Rif+100mg/L Kan)LB 平板筛选重组表达载体pGPTV-Kan/CMV-GUS intron,标记为LpPCG,挑取阳性克隆进行菌落PCR 初步鉴定,小量提取质粒进行HindⅢ和EcoRⅠ双酶切鉴定.同时将pGPTV-Kan质粒DNA 转入大肠杆菌DH5α,获得pGPTV-Kan中间载体,标记为LpGPTV.
1.2.4 农杆菌植物组织渗入与瞬时性表达
用电转化法将以上2种重组质粒转化农杆菌LBA4404,挑取阳性克隆,进行PCR 鉴定.获得植物表达载体LpPCG 和LpGPTV.选择完整的位于植株中部偏上的完全展开叶片,用1mL 塑料注射器将农杆菌悬浮液从叶背注入细胞间隙,渗入组织位于叶主脉及2排次脉之间,面积约4cm2左右,渗入农杆菌悬浮液量为100μL.每个叶片以叶脉分隔,渗入8~16点,于室内22~25 ℃,16/8h光暗条件下培养48h.
1.3 荧光法GUS活性检测
将含有渗透位点的叶组织片收集到1.5mL的Eppendorf管中,加入500μL的GUS提取液,液氮冷冻后冰浴下研磨.4 ℃离心10min,取出50μL上清液加入250μL 的GUS检测溶液和200μL GUS提取液.立刻从混合液中移出另一个50μL 的等分试样,加入2mL 的终止液用做对照.其余的混合物37 ℃保温60min.用50mmol/L,pH7.0的磷酸钠缓冲液冲洗3次,按荧光检测法检测GUS表达活性.
1.4 数据处理
采用EXCEL2003系统进行作图及统计分析.
2 结果分析
根据CMV 启动子设计了其PCR 克隆引物,高保真PCR 克隆CMV 启动子,利用其与中间载体PUC19/2×35S-GUS和pGPTV-Kan的重组中分别获得其与GUS intron和NPTⅡ基因的融合,从而得到具有Kan抗性的表达载体.
2.1 CMV启动子的克隆
PCR 扩增CMV 启动子,得到大小在0.7kb左右的PCR 产物(图1),其长度与实验设计的CMV 启动子的714bp的序列长度接近.推测该PCR 产物是CMV 启动子.
2.2 重组质粒PUC19/M15K-GUS intron的构建及其鉴定
利用CMV 启动子PCR 产物酶切片段,与中间载体PUC19/2×35S-GUS的重组,得到了PCG 重组子,其PCR 检测结果(图2)与上述结果一致.BamHⅠ+HindⅢ双酶切和HindⅢ+EcoRⅠ双酶切的检测结果(表1,图3)表明,重组表达载体PUC19/CMV-GUS intron构建正确.
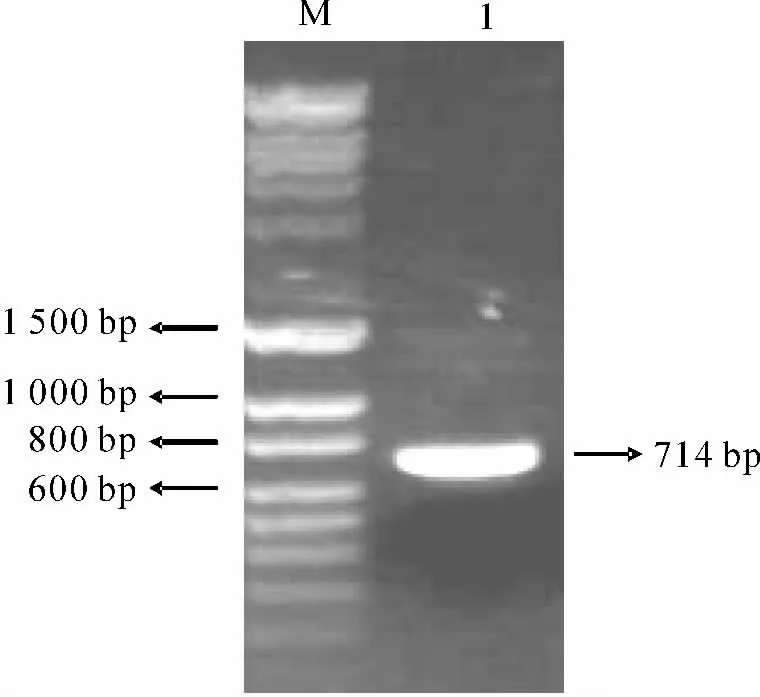
图1 CMV启动子的PCR 克隆结果Fig.1 PCR amplification of CMV promoter gene
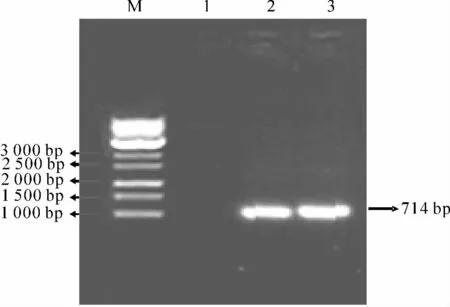
图2 PCG 重组子PCR 检测结果Fig.2 PCR amplification of the PCG recombinant plasmids
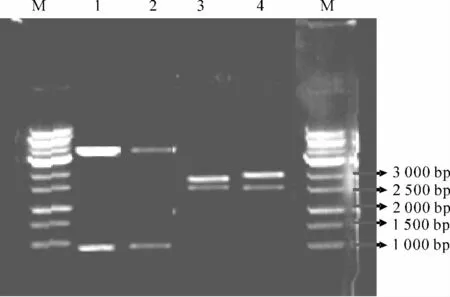
图3 PCG 重组子酶切检测结果Fig.3 Electrophoretic analysis of PCG recombinant plasmids after digestion with restriction enzymes

表1 PCG 重组子BamHⅠ+HindⅢ和HindⅢ+EcoRⅠ双酶切理论大小Tab.1 Theoretical size of PCG recombinant plasmids after digestion with double restriction enzymes.
PCG 的HindⅢ、EcoRⅠ双酶切片段CMV-GUS与pGPTV-Kan重组子pPCG 检测结果也得到与图3相似的CMV 启动子扩增条带.其BamHⅠ+EcoRⅠ双酶切和HindⅢ+EcoRⅠ双酶切的检测结果(表2,图4)证实该重组子是正确的.
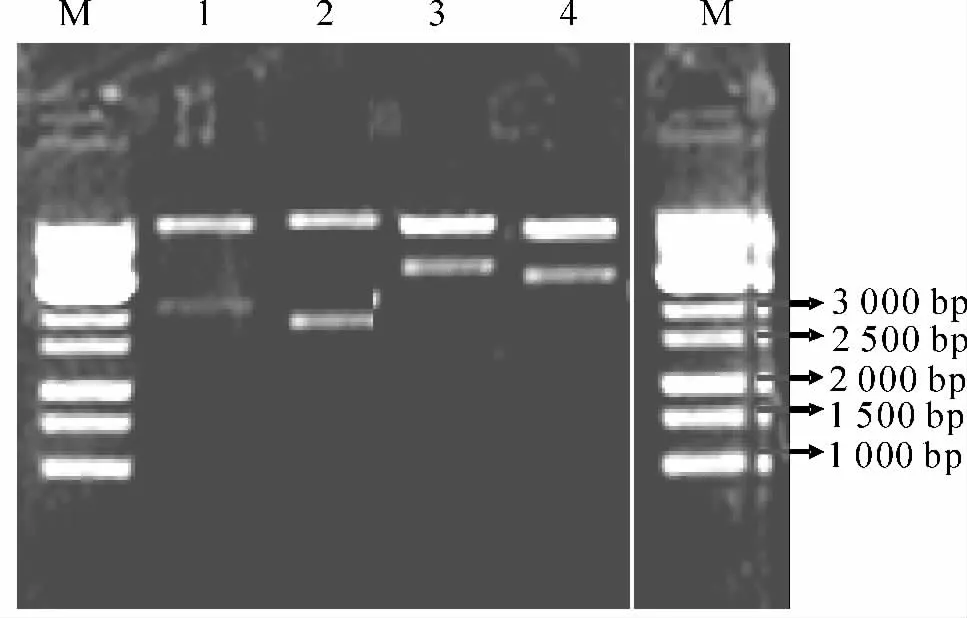
图4 pPCG 质粒DNA酶切检测结果Fig.4 Electrophoretic analysis of pPCG recombinant plasmids after digestion with restriction enzymes
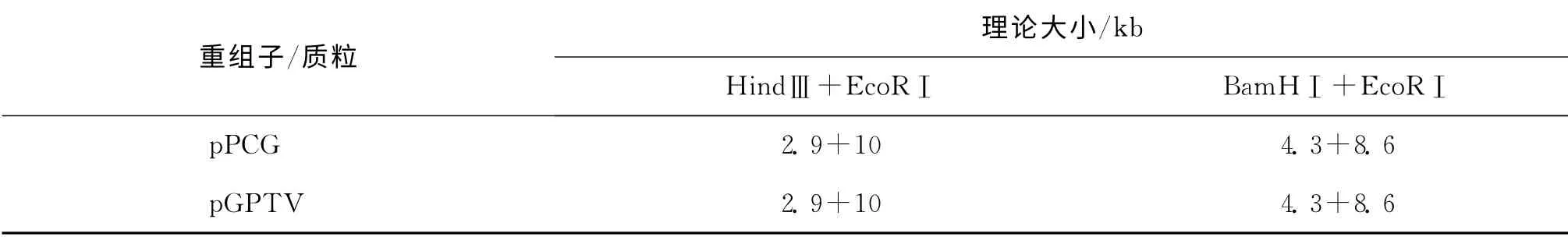
表2 pPCG 重组子BamHⅠ+EcoRⅠ和HindⅢ+EcoRⅠ双酶切理论大小Tab.2 Theoretical size of pPCG recombinant plasmids after digestion with double restriction enzymes
2.3 CMV启动子在植物体内的瞬时性表达
利用荧光法检测了CMV 和2×35S启动子指导的GUS基因在烟草叶组织中的瞬时表达活性.结果表明(图5),CMV 和2×35S启动子均可指导GUS基因的瞬时性表达.同时发现,CMV 启动子的表达活性达到2×35S启动子的(80.4±26.6)%(n=6).
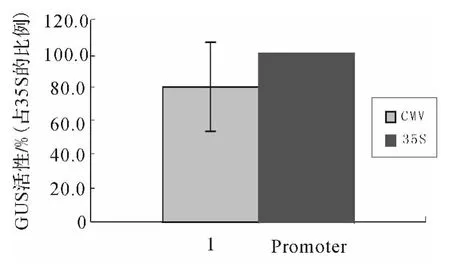
图5 CMV启动子指导的GUS瞬时表达活性Fig.5 Transient expression activity of GUS driven by CMV promoter
3 结论
3.1 CMV启动子在植物体内的瞬时性表达
瞬时表达系统是研究启动子功能及活性的重要手段之一.由于瞬时性表达的外源基因在受体植物细胞内是游离于染色体之外的,因此,其表达受受体植物基因组的影响相对较小,其启动子活性基本反映了启动子本身的表达特性[11-12].同时,利用瞬时性表达系统可以定性和定量地研究启动子的表达活性.通过荧光检测法,CMV 启动子可指导GUS基因的瞬时性表达.
3.2 CMV启动子在植物基因工程中的潜在应用价值
前人对35S启动子的研究结果表明,35S启动子存在2个重要区域,即从-90至+8的A 区和-343至-90的B区.其A 区主要负责在胚根、胚乳及根组织中表达;而B区则主要控制胚、子叶及成熟植株的叶组织及维管组织内的表达[2].Benfey等利用UidA 基因证实了35S的-90至-46区域和-343至-90区域分别是在根部和叶部表达所必需的[13].有人将35S的-343至-90区域作顺向重复排列构成了增强型35S双启动子(2×35S),并证明其表达活性显著增强.另外,郝林等的研究证明2×35S启动子在拟南芥中的表达水平比35S启动子高出11倍[1].笔者的上述实验结果表明,CMV 启动子均具有相当于2×35S启动子80%左右的活性,这说明,CMV 启动子在植物体内具有较高的表达活性.这一结果表明,CMV 启动子可能为植物基因工程中表达外源基因提供新的启动子选择,也就是说CMV启动子在植物基因工程中具有潜在的应用价值.
由于CMV 启动子是动物基因工程中的启动元件,因此,这一实验结果表明,某些动物来源的启动子也同时具有植物表达活性.也就是说动植物启动子在基因表达调控机制上存在着共同之处.早先把果蝇HSP70启动子具有植物表达活性作为例外[14],从笔者的上述研究结果看,HSP70启动子的植物表达活性可能并非例外.实际上,已有结果表明,CaMV 35S启动子在非洲爪蟾(Xenopus oocytes)和HeLa细胞内的作用与CMV 启动子一致,表现出较高的表达活性[15-16].这些结果同时说明,过去认为动物启动子不被植物所识别的观点应当改变[2].
植物与动物同属于高等真核生物,在基因结构、组成及表达调控方面存在诸多相似之处,如基因的不连续性、高度重复性以及相似的加工、修饰机制.上述结果说明了动植物基因启动子的调控机制有其同源性,因此,在基因调控水平上研究和寻找动、植物基因的通用性,无论在基础理论上还是在应用上都具有重要意义.
[1] 郝林,曹军.CaMV 35S双启动子显著提高转基因在拟南芥中表达水平的研究[J].植物生理学通讯,2000,36(6):517-519.HAO Lin,CAO Jun.A double CaMV 35Spromoter efficiently enhances the level of transgenic expression in Arabidopsis[J].Plant Physiology Communications,2000,36(6):517-519.
[2] 王关林,方宏筠.植物基因工程原理与技术[M].北京:科学出版社,1998.WANG Guanlin,FANG Hongjun.The principle and technology of plant gene engineering[M].Beijing:Science Press,1998.
[3] 李杰,张福城,王文泉,等.高等植物启动子的研究进展[J].生物技术通讯,2006,17(4):658-661.LI Jie,ZHANG Fucheng,WANG Wenquan,et al.Advance in the study of higher plant promoter[J].Letters in Biotechnology,2006,17(4):658-661.
[4] ALKAFF N S,KREIKE M M,COVERY S N.Plants rendered herbicide-susceptible by cauliflower mosaic virus-elicited suppression of a 35Spromoter-regulated transgene[J].Nat Biotechnol,2000,18(9):995-999.
[5] HOLTORF S,APEL K,BOHLMANN H.Comparison of different constitutive and inducible promoters for the transgenes in Arabidopsis thaliana[J].Plant Mol Bio,1995,29(4):637-646.
[6] 徐子勤.重要禾谷类植物转基因研究[J].生物工程进展,2001,21(1):59-74.XU Ziqin.Transgenic researches of important cereal species[J].Progress in Biotechnology,2001,21(1):59-74.
[7] BRUCE W B,CHERISTENSEN A H,KLEIN T.Photoregulation of a phytochrome gene promoter from oat transferred into rice by particle bombardment[J].Proc Natl Acad Sci USA,1989,86(24):9692-9696.
[8] MCELROY D,BRETTELL R.Foreign gene expression in transgenic cereals[J].Trends Biotechnol,1994,12(2):62-68.
[9] DAI Jianwei,ZHANG Qianqian,LIU Songcai,et al.The combination of a synthetic promoter and a CMV promoter improves foreign gene expression efficiency in myocytes[J].Journal of Biotechnology,2011,158(3):91-96.
[10] LAI Guangrui,LIU Xiaoliang,WU Jingjing,et al.Evaluation of CMV and KAP promoters for driving the expression of human CYP4F2in transgenic mice[J].Int J Mol Med,2012,29(1):107-112.
[11] 战淑欣,王道文.利用瞬时表达系统研究马铃薯Y 类病毒基因对豌豆HSP70基因启动子激活能力的差异[J].植物学报,2000,42(4):433-437.ZHAN Shuxin,WANG Daowen.Development of a transient assay for investigating the activation of Pea HSP70gene promoter by potyviral cistrons[J].Journal of Integrative Plant Biology,2000,42(4):433-437
[12] SUNIKUMAR G,MOHR L.Developmental and tissue-specific expression of CaMV 35Spromoter in cotton as revealed by GFP[J].Plant Mol Biol,2002,50(3):463-74.
[13] BENFEY P N,REN L,CHUA N H.Tissue-specific expression from CaMV35Senhancer subdomains in early stages of plant development[J].EMBO J,1990,9(6):1677-1684.
[14] ZHANG X P,GLASER E.Interaction of plant mitochondrial and chloroplast signal peptides with the HSP70molecular chaperone[J].Trends in Plant Science,2002,17(1):14-21.
[15] BURKE C,YU X B,MARCHITELLI L,et al.Transcription factorⅡA of wheat and human function similarly with plant and animal viral promoters[J].Nucl Acids Res,1990,18(12):3611-3620.
[16] MYHRE M,FENTON K,EGGERT J,et al.The 35SCaMV plant virus promoter is active in human enterocyte-like cells[J].Eur Food Res Technol,2006,222(1-2):185-193.

