血红素加氧酶-1在糖尿病视网膜病变患者外周血单个核细胞中的表达△
蔡晶晶 孟倩丽 郭海科 张良 李东风 崔颖
血红素加氧酶-1在糖尿病视网膜病变患者外周血单个核细胞中的表达△
蔡晶晶 孟倩丽 郭海科 张良 李东风 崔颖
糖尿病视网膜病变;血红素加氧酶-1;氧化应激;基因表达
目的观察血红素加氧酶-1(heme oxygenase-1,HO-1)在糖尿病视网膜病变(diabetic retinopathy,DR)患者外周血单个核细胞(peripheral blood mono-nuclear cell,PBMC)中的表达。方法选择糖尿病病程大于6个月的2型糖尿病患者共64例,根据临床表现和诊断将其分为无糖尿病视网膜病变(non-diabetic retinopathy,NDR)组18例及DR组46例,其中DR组中包括非增生型DR(non-proliferative diabetic retinopathy,NPDR)患者24例及增生型DR(proliferative retinopathy,PDR)患者22例。选择同期行体检的健康志愿者20人作为对照。采用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测各组PBMC中HO-1 mRNA的表达水平,比较各组之间HO-1 mRNA表达水平的差异,并分析HO-1 mRNA表达水平与各项理化指标之间的相关性。结果qRT-PCR检测发现,DR组、NDR组以及对照组PBMC中HO-1 mRNA相对表达量分别是0.015±0.007、0.021±0.010、0.027±0.013,差异有统计学意义(F=10.888,P<0.001)。其中,DR组HO-1 mRNA的相对表达量明显低于NDR组(P=0.014);NDR组与对照组比较差异无统计学意义(P=0.125);PDR组患者PBMC中HO-1 mRNA相对表达量为 0.012±0.007,显著低于NPDR组(0.018±0.007)(t=-3.052,P=0.004)。ln(HO-1) mRNA 表达水平与收缩压(β=-0.011,P=0.001)及糖化血红蛋白(β=0.088,P=0.008)之间存在显著相关性。结论HO-1 mRNA在DR患者及PDR患者PBMC中的表达显著降低,提示HO-1可能作为一个保护性因素参与DR的发生及病情进展。
[眼科新进展,2014,34(1):37-40]
氧化应激机制与糖尿病视网膜病变(diabetic retinopathy,DR)发生的关系逐渐成为近年来研究的热点。血红素加氧酶-1(heme oxygenase-1,HO-1)一直被认为具有良好的抗氧化应激、抗炎、抗细胞凋亡以及抗细胞增殖的功能。有研究发现HO-1在高糖培养的视网膜细胞以及糖尿病动物模型的视网膜上存在异常表达[1-2]。Da等[3]分离供体眼球的视网膜色素上皮(retinal pigment epithelium,RPE)细胞,发现糖尿病患者HO-1 mRNA表达低于正常组及高血压组,但是其在DR患者中的表达情况尚不清楚。因此,为了探讨HO-1在DR发病机制中的作用,本研究观察了HO-1在2型糖尿病患者外周血单个核细胞(peripheral blood mono-nuclear cell,PBMC)中的表达,以期为阐明DR的发病机制、寻求新的治疗靶点提供一定的理论依据和实验基础。
1 资料与方法
1.1一般资料将2011年11月至2012年12月在广东省人民医院眼科和内分泌科住院治疗的64例2型糖尿病患者纳入本研究,其糖尿病病程均大于6个月。所有受试者通过实验室检查排除严重心血管疾病、外周动脉粥样硬化、肝肾及肿瘤疾病,以及近期无急性感染病史。所有患者签署知情同意书后均进行了视力、眼压、裂隙灯显微镜眼前节、前置镜眼底检查,糖尿病患者中眼底分期难以区分的患者还进行了眼底荧光血管造影(fluorescein fundus angiography,FFA)检查。综合前置镜眼底检查、眼底彩色照相以及FFA检查结果,根据国际DR严重程度分级标准[4],将64例2型糖尿病患者分为糖尿病无视网膜病变(non-diabetic retinopathy,NDR)组(18例)、DR组(46例)。其中DR组中包括非增生型DR(non-proliferative diabetic retinopathy,NPDR)患者24例,眼底主要表现为微血管瘤、出血、渗出、视网膜水肿等体征;增生型DR(proliferative retinopathy,PDR)患者22例,眼底主要表现为视盘新生血管、玻璃体积血或合并纤维增殖膜、视网膜脱离等。对照组为年龄大于40岁,且血压、血糖和血脂均正常的20名同期参加体检的健康志愿者。
1.2方法
1.2.1体检和生化检查空腹30 min,静息15 min后,采用电子血压仪测量受试者坐位时上臂血压。禁食10 h后第2天清晨采空腹静脉血,测定血常规、丙氨酸转移酶(alanine aminotransferase,ALT)、门冬氨酸转移酶(aspartate aminotransferase,AST)、血肌酐。对于糖尿病患者,采用离子交换高效液相色谱分析法测量糖化血红蛋白(HbA1c)含量。
1.2.2PBMC总RNA提取按照常规方法,取新鲜外周血2 mL入EDTA试管,应用淋巴细胞分离液(TBD公司,中国)分离PBMC,用Trizol抽提液(TAKARA公司,日本)提取总RNA,测定其260 nm和280 nm的吸收率,计算纯度和含量。比值在1.8~2.0者作为合格标本进行逆转录试验。
1.2.3逆转录-实时荧光定量聚合酶链式反应使用逆转录试剂盒(TAKARA公司,日本)。采用Primer5.0软件设计引物,引物序列由上海英骏生物技术有限公司合成。HO-1上游引物为:5’-CTTCTTCACCTTCCCCAACA-3’,下游引物为:5’-GCTCTGGTCCTTGGTGTCAT-3’;产物长度为193 bp。β-肌动蛋白(β-actin)为内参;β-actin上游引物:5’-CATGTACGTTGCTATCCAGGC-3’,下游引物为:5’-CTCCTTAATGTCACGCACGAT-3’,产物长度为250 bp。总反应体系为10 μL,其中逆转录反应缓冲液2 μL,总RNA浓度为500 μg·L-1,另加无RNA酶水定容至10 μL。逆转录条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃下将cDNA按总反应体系10 μL配制,使用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒进行反应。其中cDNA 1 μL,灭菌蒸馏水3.2 μL,qRT-PCR上游引物0.4 μL,下游引物0.4 μL,2倍Taq聚合酶染料反应缓冲液5.0 μL。混匀放入荧光定量PCR仪器里。反应条件:95 ℃预变性2 min,95 ℃ 5 s,60 ℃ 30 s,进行40个循环。所有样本均采用三复孔进行试验。反应结束后电脑自动绘出各自的标准曲线,以熔解曲线为单一峰形、出峰位置为退火温度代表产物特异性好。由软件自动计算出待测样品中目的基因和管家基因的准确含量。使用相对表达量作为评价目的基因表达水平的指标,相对表达量为2-ΔCt,△Ct=Ct目的基因-Ct管家基因,Ct为热循环仪检测到反应体系中荧光信号的临界循环数值。
2 结果
2.1一般结果NDR组、NPDR组、PDR组、对照组性别、收缩压、舒张压、高血压病史、现阶段胰岛素使用史、AST和ALT比较,差异均无统计学意义。各组中的年龄、糖尿病病程、HbA1c、血肌酐比较,差异均有统计学意义。NDR组、NPDR组及PDR组进行两两比较发现,PDR组年龄为(51.5±8.0)岁,显著小于NDR组的(61.3±12.0)岁及NPDR组的(66.9±9.0)岁(P=0.021、0.001);NDR组及PDR组糖尿病病程明显低于NPDR组;PDR组的HbA1c值为(7.6±1.7)%,明显低于NDR组的(9.3±2.2)%及NPDR组的(9.5±2.6)%(P=0.005、0.002),而该组的血肌酐水平为(191±179)μmol·L-1,明显高于NDR组的(69±18)μmol·L-1及NPDR组的(68±18)μmol·L-1(P=0.004、0.005)。
2.2HO-1mRNA的表达qRT-PCR检测发现,HO-1获得理想的单一峰形熔解曲线,其扩增产物的特异性好(图1)。DR组、NDR组以及对照组PBMC中HO-1 mRNA相对表达量分别为0.015±0.007、0.021±0.010、0.027±0.013,差异有统计学意义(F=10.888,P<0.001)。其中,DR组HO-1 mRNA的相对表达量明显低于NDR组(P=0.014),NDR组与对照组比较,差异无统计学意义(P=0.125)。进一步对DR组中NPDR患者和PDR患者分析显示,PDR组患者PBMC中HO-1 mRNA相对表达量为0.012±0.007,显著低于NPDR组(0.018±0.007),差异有显著统计学意义(t=-3.052,P=0.004)。
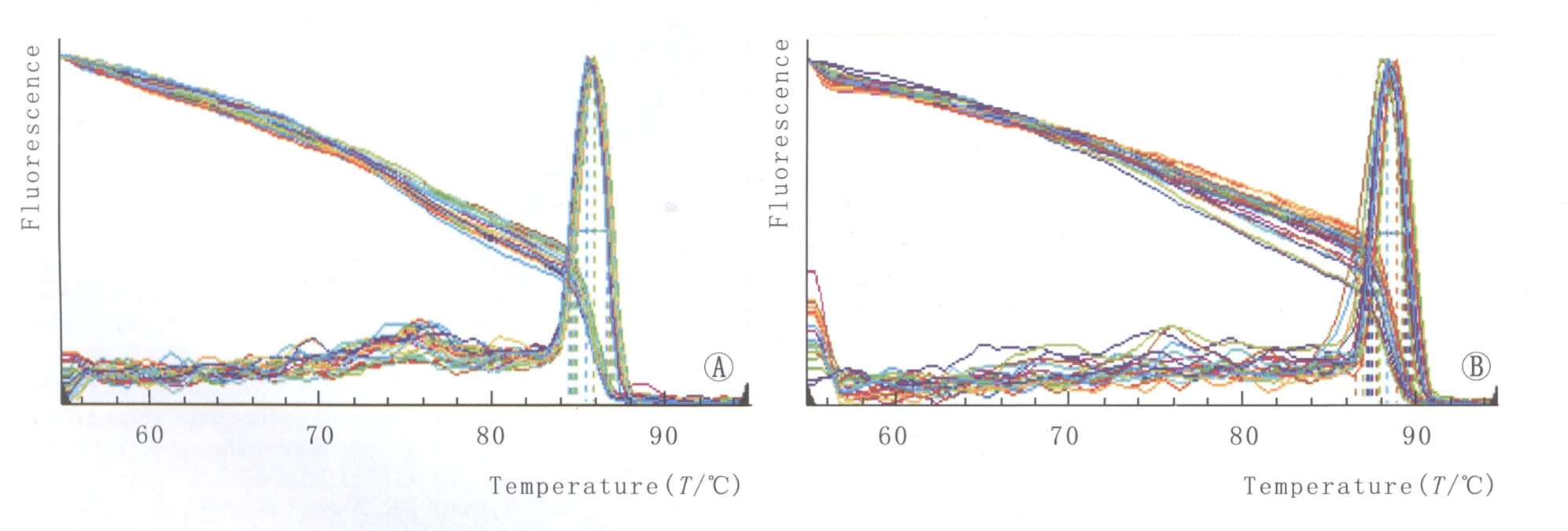
Figure 1 Dissociation curve of HO-1 and β-actin.A:HO-1;B:β-actin HO-1、β-actin熔解曲线图。A:HO-1熔解曲线;B:β-actin熔解曲线
2.3DR患者HO-1mRNA表达的相关因素分析将HO-1 mRNA表达量进行ln(HO-1)正态转换,相关分析结果显示,ln(HO-1)与收缩压(r=-0.357,P=0.009)、HbA1c (r=0.263,P=0.046)存在显著相关(图2)。多重线性回归分析发现,ln(HO-1)(Y)与收缩压(X1)(β=-0.011,P=0.001)及HbA1c(X2)(β=0.088,P=0.008)独立相关,回归方程为Y=-3.416-0.011X1+0.088X2。

Figure 2 Correlation between expression of ln(HO-1) mRNA and systolic pressure,clucosylated hemoglobin ln(HO-1)mRNA表达与收缩压及HbA1c的相关分析
3 讨论
DR属于糖尿病微血管并发症之一,严重者可以致盲。大量的研究表明,氧化应激反应对DR的发展,尤其是对视网膜内皮细胞功能的失调及死亡具有重要作用[5]。既往研究证实,在体外细胞培养及动物模型中,HO-1在RPE细胞、内皮细胞、光感受器细胞、神经节细胞、Müller细胞中均有表达,在应激状态下其表达增高[2,6-8]。有研究发现,HO-1能够通过抗氧化应激、抗炎、抗凋亡、抗增殖效应来保护视网膜神经节细胞的功能。HO-1表达的升高与Nrf2/ERK信号通路激活有关,还可能与调控诱导超氧化物歧化酶-1的表达,以及抑制缺氧诱导因子-1α、P53、血管内皮生长因子(vascular endothelial growth factor,VEGF)水平相关[9]。对糖尿病小鼠的研究发现,在病程早期,HO-1在视网膜组织中的表达升高,但是随着病情的进展,HO-1的表达降低,进而导致抗氧化应激作用降低[1]。
本研究证实,DR患者的HO-1 mRNA的相对表达量明显低于未发生视网膜病变的糖尿病患者,提示HO-1表达水平的降低可能是导致DR发生的原因之一。本研究对DR患者的进一步分析发现,PDR患者PBMC中HO-1 mRNA表达含量明显低于NPDR患者,提示HO-1可能参与了DR的病情进展,其表达水平的降低可能加剧了DR的严重程度。由此我们推测,外周血PBMC中HO-1的高表达可能对DR的发生发展是一个保护因素。
然而Zhang等[10]研究发现,采用转染HO-1 siRNA、原锌卟啉抑制HO-1活性、缺氧情况下敲除HO-1等方法,均能显著降低人RPE细胞中VEGF的表达,提示HO-1具有促进新生血管化的作用。因此,为进一步明确HO-1在DR进展中的作用,尚需探讨HO-1在DR患者眼局部的表达情况,同时借助糖尿病动物模型以及体外视网膜细胞培养等进一步阐明其作用机制。
本研究对DR患者的基本情况及理化检查指标进行分析发现,PDR患者的年龄、糖尿病病程及HbA1c水平均明显低于NPDR患者。我们推测这可能与高血糖的“代谢记忆”有关。所谓“代谢记忆”,是指糖尿病患者的高血糖水平如果在发病早期不能得到及时控制,即使后期持续稳定在正常水平,DR等慢性并发症仍然会继续发展,难以逆转。炎症因子瀑布、氧化应激增强以及表观遗传修饰的变化等在高血糖“代谢记忆”现象发生发展中发挥重要作用[11]。此外,糖尿病患者年龄较小[12]、空腹血糖波动[13]等均可导致PDR的发生发展。
糖尿病肾病与DR均是糖尿病重要的微血管并发症,二者之间存在着共同的发病机制,如遗传因素、糖基化终末产物、多元醇通路、蛋白激酶C激活、细胞因子、免疫炎症因素等[14]。因此,有研究证实二者在临床中可以相互评估[15-16]。本研究发现,PDR患者血肌酐含量显著高于NPDR患者及未出现视网膜病变的糖尿病患者,提示PDR的发生与肾脏的损害可能存在更加密切的关系。此外,我们发现DR患者外周血HO-1 mRNA的表达与收缩压具有相关性,这可能与HO-1通过调节血管功能和肾脏功能进而参与血管减压调节的作用有关[17]。
综上所述,本研究发现,在糖尿病病程大于6个月的2型糖尿病患者中,其PBMC中HO-1 mRNA的表达显著低于未出现视网膜病变的糖尿病患者,其在PDR患者中的表达明显低于NPDR患者,提示了HO-1表达水平的降低可能是导致DR发生发展的原因之一,而增加HO-1的含量可能是治疗DR的新途径。
1 He M,Pan H,Xiao C,Pu M.Roles for redox signaling by NADPH oxidase in hyperglycemia-induced heme oxygenase-1 expression in the diabetic retina[J].InvestOphthalmolVisSci,2013,54(6):4092-4101.
2 Cukiernik M,Mukherjee S,Downey D,Chakabarti S.Heme oxygenase in the retina in diabetes[J].CurrEyeRes,2003,27(5):301-308.
3 Da SJ,Stoltz RA,Dunn MW,Abraham NG,Shibahara S.Diminished heme oxygenase-1 mRNA expression in RPE cells from diabetic donors as quantitated by competitive RT/PCR[J].CurrEyeRes,1997,16(4):380-386.
4 Wilkinson CP,Ferris FR,Klein RE,Lee PP,Agardh CD,Davis M,etal.Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales[J].Ophthalmology,2003,110(9):1677-1682.
5 Du Y,Sarthy VP,Kern TS.Interaction between NO and COX pathways in retinal cells exposed to elevated glucose and retina of diabetic rats[J].AmJPhysiolRegulIntegrCompPhysiol,2004,287(4):735-741.
6 Bailey TA,Kanuga N,Romero IA,Greenwood J,Luthert PJ,Cheetham ME.Oxidative stress affects the junctional integrity of retinal pigment epithelial cells[J].InvestOphthalmolVisSci,2004,45(2):675-684.
7 Arai-Gaun S,Katai N,Kikuchi T,Kurokawa T,Ohta K,Yoshimura N.Heme oxygenase-1 induced in müller cells plays a protective role in retinal ischemia-reperfusion injury in rats[J].InvestOphthalmolVisSci,2004,45(11):4226-4232.
8 Ulyanova T,Szel A,Kutty RK,Wiggert B,Caffe AR,Chader GJ,etal.Oxidative stress induces heme oxygenase-1 immunoreactivity in müller cells of mouse retina in organ culture[J].InvestOphthalmolVisSci,2001,42(6):1370-1374.
9 Fan J,Xu G,Jiang T,Qin Y.Pharmacologic induction of heme oxygenase-1 plays a protective role in diabetic retinopathy in rats[J].InvestOphthalmolVisSci,2012,53(10):6541-6556.
10 Zhang W,Zhang X,Lu H,Matsukura M,Zhao J,Shinohara M.Silencing heme oxygenase-1 gene expression in retinal pigment epithelial cells inhibits proliferation,migration and tube formation of cocultured endothelial cells[J].BiochemBiophysResCommun,2013,434(3):492-497.
11 Zhang L,Chen B,Tang L.Metabolic memory:mechanisms and implications for diabetic retinopathy[J].DiabetesResClinPract,2012,96(3):286-293.
12 胡安娣娜,李涛,罗燕,丁小燕,朱晓波,李士清,等.增殖性糖尿病视网膜病变的危险因素分析[J].中国实用眼科杂志,2011,29(9):925-928.
13 Takao T,Ide T,Yanagisawa H,Kikuchi M,Kawazu S,Matsuyama Y.The effect of fasting plasma glucose variability on the risk of retinopathy in type 2 diabetic patients:retrospective long-term follow-up[J].DiabetesResClinPract,2010,89(3):296-302.
14 李艳,李东豪.糖尿病视网膜病变和糖尿病肾病相关关系的研究进展[J].国际眼科杂志,2012,12(7):1285-1288.
15 Parving HH,Mogensen CE,Thomas MC,Brenner BM,Cooper ME.Poor prognosis in proteinuric type 2 diabetic patients with retinopathy:insights from the RENAAL study[J].QJM,2005,98(2):119-126.
16 李凌云.糖尿病视网膜病变与糖尿病肾病早期关系的分析[J].实用中西医结合临床,2009,24(1):46-47.
17 韩玉祯,陈明.血红素加氧酶-1在肾脏功能及血压调节中的作用[J].山东医药,2012,38(19):97-99.
date:Oct 18,2013
National Natural Science Foundation of China(No:81371031);Medical Scientific Research Foundation of Guangdong Province(No:B2011013);Science and Technology Star of Zhujiang of Guangzhou City(No:2011J2200050)From theSouthernMedicalUniversity(CAI Jing-Jing),Guangzhou510080,GuangdongProvince,China;DepartmentofOphthalmology,GuangdongGeneralHospital,GuangdongEyeInstitute,GuangdongAcademyofMedicalSciences(CAI Jing-Jing,MENG Qian-Li,GUO Hai-Ke,ZHANG Liang,CUI Ying),Guangzhou510080,GuangdongProvince,China;GuangdongGeneralHospital,GuangdongAcademyofMedicalSciences(LI Dong-Feng),Guangzhou510080,GuangdongProvince,China
Expression of heme oxygenase-1 in peripheral blood mono-nuclear cells of diabetic retino pathy patients
CAI Jing-Jing,MENG Qian-Li,GUO Hai-Ke,ZHANG Liang,LI Dong-Feng,CUI Ying
diabetic retinopathy;heme oxygenase-1;oxidative stress;gene expression
Objective To observe the expression of heme oxygenase-1(HO-1) in peripheral blood mono-nuclear cells (PBMC) of patients with diabetic retinopathy (DR).Methods All of the durations of the diabetes courses were greater than 6 months.Eighteen patients with non-diabetic retinopathy (NDR group),46 patients with DR (DR group) and 20 healthy controls (control group) were included in this study.There were 24 patients with non-proliferative diabetic retinopathy (NPDR) and 22 patients with proliferative diabetic retinopathy (PDR).Peripheral blood samples were obtained from all recruitments.HO-1 mRNA was analyzed by quantitative real-time polymerase chain reaction (qRT-PCR).The correlation between the expression of HO-1 and some physical parameters was also analyzed.Results The results of qRT-PCR showed that the relative expressions of HO-1 mRNA in DR group,NDR group and control group were 0.015±0.007,0.021±0.010 and 0.027±0.013,there was statistical difference(F=10.888,P<0.001).The expression of HO-1 mRNA in DR group was significantly lower than those in the NDR group(P=0.014).There was no significant difference in HO-1 mRNA between NDR group and control group(P=0.125).Compared with NPDR group (0.018±0.007),the relative expression of HO-1 mRNA was significantly lower in PDR group (0.012±0.007)(t=-3.052,P=0.004).There was a correlation between expression of ln(HO-1) mRNA and systolic pressure(β=-0.011,P=0.001),as well as clucosylated hemoglobin (β=0.088,P=0.008).Conclusion HO-1 mRNA expression is decreased in DR and PDR patients compared with the controls,indicating that HO-1 may play a protective role in DR development.
蔡晶晶,女,1989年1月出生,硕士。联系电话:15521116233;E-mail:baobao3489@sina.com
AboutCAIJing-Jing:Female,born in January,1989.Master degree.Tel:15521116233;E-mail:baobao 3489@sina.com
2013-10-18
国家自然科学基金资助(编号:81371031);广东省医学科研基金资助(编号:B2011013);广州市珠江科技新星专项基金资助(编号:2011J2200050)
510080 广东省广州市,南方医科大学(蔡晶晶);510080 广东省广州市,广东省眼病防治研究所,广东省人民医院眼科,广东省医学科学院(蔡晶晶,孟倩丽,郭海科,张良,崔颖);510080 广东省广州市,广东省人民医院医学研究部(李东风)
郭海科,E-mail:guohaike@medmail.com.cn
蔡晶晶,孟倩丽,郭海科,张良,李东风,崔颖.血红素加氧酶-1在糖尿病视网膜病变患者外周血单个核细胞中的表达[J].眼科新进展,2014,34(1):37-40.
��
10.13389/j.cnki.rao.2014.0010
修回日期:2013-11-04
本文编辑:方红玲
Accepteddate:Nov 4,2013
Responsibleauthor:GUO Hai-Ke,E-mail:guohaike@medmail.com.cn
[RecAdvOphthalmol,2014,34(1):37-40]