卵巢癌患者CA125水平对细胞免疫功能的影响
刘中娟,宋桂瑜,赵召霞,张 麟,秦绪珍,张瑞丽,韩慧娟,郭子建
1中国医学科学院 北京协和医学院 北京协和医院检验科, 北京 1007302石家庄市第五医院检验科, 石家庄 050021
·论 著·
卵巢癌患者CA125水平对细胞免疫功能的影响
刘中娟1,宋桂瑜1,赵召霞2,张 麟1,秦绪珍1,张瑞丽1,韩慧娟1,郭子建1
1中国医学科学院 北京协和医学院 北京协和医院检验科, 北京 1007302石家庄市第五医院检验科, 石家庄 050021
目的 体外检测卵巢癌患者血中CA125对细胞免疫功能的影响。方法 收集2012年5月至2013年6月北京协和医院符合诊断标准的卵巢癌患者58例,按CA125浓度分为3组;同时收集良性妇科疾病患者20例及体检正常的健康者20名作为对照。应用细胞培养、酶联免疫吸附法、酶联免疫斑点(enzyme-linked immunospot,ELISPOT)等实验,观察体外刺激健康人淋巴细胞产生γ-干扰素(interferon-γ,IFN-γ)的能力,判断CA125对机体细胞免疫状态的影响。结果在卵巢癌患者中,随CA125水平升高,淋巴细胞绝对值及百分比值呈逐渐下降趋势。高浓度CA125卵巢癌患者的血清与植物血凝素共同刺激健康者混合淋巴细胞后,培养上清液中IFN-γ的含量[(36.16±16.89)ng/ml]较阳性对照组和低浓度CA125组[分别为(45.68±18.01)和(46.22±19.30)ng/ml]显著降低(P<0.05);ELISPOT结果显示高浓度和中浓度CA125(斑点数均值分别为108.2和371.6)对细胞免疫抑制功能与健康对照组和良性疾病组(斑点数均值分别为573.0和523.0)比较,差异均有统计学意义(P<0.01,P<0.05);而去除血清中CA125后,对细胞免疫抑制作用明显减弱。结论 卵巢癌患者体内的CA125水平与淋巴细胞的数量、活性及其产生细胞因子的活性呈负相关关系。CA125除作为与卵巢癌相关的标志物外,还可能是一种细胞免疫抑制因子。
CA125;卵巢癌;淋巴细胞;细胞因子;γ-干扰素
MedJPUMCH,2014,5(3):273-277
全球范围内,卵巢癌是女性死亡率最高的生殖系统恶性肿瘤之一。由于其发病比较隐匿且无明显的临床症状,75%以上的卵巢癌患者被诊断时已是晚期,错过了治疗的最佳时期,使得晚期卵巢癌患者5 年生存率仅15 %~20 %,且手术和化疗后复发率高[1- 2]。许多临床研究表明卵巢癌患者体内均有CA125不同程度的升高,同时多数卵巢癌患者体内可能存在免疫功能低下的现象[3]。近年有文献报道,I型-凝集素Siglec- 9已经被确定为CA125的受体之一[4],它主要表达在约30%~40%的具有CD16+/CD56dim标志的NK细胞、20%~30%的B细胞、95%以上的单核细胞和部分淋巴细胞上。外周血免疫细胞和卵巢癌患者的腹腔液中均发现了I型-凝集素Siglec- 9[5]。它们是否与卵巢癌患者的免疫功能低下有关尚未见研究报道。本研究目的是通过比较卵巢癌患者不同水平的CA125对免疫抑制功能的影响,研究CA125在卵巢癌患者细胞免疫功能中的作用。
对象和方法
对象及分组
2012年5月至2013年6月北京协和医院收治的门诊及住院卵巢癌患者58例,所有患者均经组织病理学明确诊断,且未接受任何治疗。患者年龄范围38~83岁。组织病理学结果显示组织学类型、分级及临床分期如下:(1)组织学类型:浆液性囊腺癌29例,黏液性囊腺癌16例,子宫内膜样癌13例;(2)临床分期:采用国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)2000的标准,Ⅰ和Ⅱ期共17例,Ⅲ和Ⅳ期共41例;(3)组织学分级:G1级15例,G2、G3级43例。
58例卵巢癌患者按血清CA125浓度分为3组:高浓度组血清CA125水平均大于3000 U/ml,共26例,平均年龄59岁,平均CA125含量为5032 U/ml;中浓度组血清CA125水平为1000~3000 U/ml,共19例,平均年龄52岁,平均CA125含量为1559 U/ml;低浓度组血清CA125水平为300~1000 U/ml,共13例,平均年龄54岁,平均CA125含量为551 U/ml。
健康对照组 20名,来自北京协和医院体检中心体检合格的正常健康妇女,平均年龄45岁,平均血清CA125含量11 U/ml,心、肺、肝、肾等器官正常,无妇产科疾病。良性疾病组20例,来自北京协和医院收治的妇科门诊和住院患者,临床诊断为宫颈炎、子宫肌瘤等非卵巢癌的妇科疾病患者,平均年龄41岁,平均血清CA125含量为26 U/ml。
主要试剂和仪器
主要试剂:淋巴细胞分离液由北京博迈斯生物科技有限公司提供;植物血凝素(phytohemagglutinin, PHA)由北京达科为科技有限公司提供;1640细胞培养液(含10%胎牛血清)由美国SIGMA公司提供;γ-干扰素(interferon-γ,IFN-γ)的酶联免疫斑点实验(enzyme-linked immunospot, ELISPOT)、IFN-γ的酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒由北京达科为科技有限公司提供。CA125检测试剂由罗氏公司提供。
主要仪器:德国艾迪公司ELISPOT图像分析仪 (AID iSpot Reader);罗氏Cobas E601全自动免疫分析仪;美国Precision Scientific 5410型CO2培养箱;西门子ADVIA2120全自动血液分析仪;瑞士TECAN sunrise酶标仪。
实验方法
实验中所用淋巴细胞均为健康人新鲜EDTA抗凝全血,通过体外淋巴细胞分离方法分离得到;血清CA125检测方法为电化学发光(罗氏Cobas E601检测仪及配套试剂检测);淋巴细胞的数量和百分比采用过氧化物酶法。对混合淋巴细胞产生INF-γ的能力通过ELISPOT和ELISA技术检测。
ELISPOT实验
在超净台内无菌操作,采用淋巴细胞分离液分离出健康人的新鲜混合淋巴细胞,按说明书要求用1640细胞培养液(加10%胎牛血清)调整淋巴细胞的浓度为1.0×106个/ml,每孔取100 μl细胞悬液加入预包被有INF-γ抗体的PVDF板条孔中,进行体外培养约20 h。实验设有空白对照孔(阴性对照)、单纯PHA刺激淋巴细胞孔(阳性对照)、PHA和含有稀释到不同水平CA125的血清共同刺激淋巴细胞孔(实验孔)。培养结束后按照说明书操作完成裂解细胞、洗板、检测抗体孵育、洗板、酶联亲和素孵育、洗板、显色、终止显色、ELISPOT 板斑点计数等操作步骤。
ELISA实验
细胞制备同前述ELISPOT实验,每孔取200 μl细胞悬液加入96孔细胞培养板内,进行体外培养约48 h。实验设有空白对照孔(阴性对照)、单纯PHA刺激淋巴细胞孔(阳性对照)、PHA和含有不同水平CA125的血清共同刺激淋巴细胞孔(实验孔)。培养结束后小心吸取培养上清100 μl/ml,按照人IFN-γ预包被ELISA 试剂盒说明书操作,检测培养上清液中IFN-γ浓度。
血清CA125去除方法
应用罗氏公司提供的CA125检测试剂盒,依据1个单位CA125加入0.9 μl生物素化单克隆抗体和0.65 μl包被链霉亲和素的磁珠微粒计算相应的试剂量,按照抗原抗体反应形成磁珠微粒-链酶亲和素-生物素-anti-CA125-CA125抗原复合物,高速瞬时离心后吸取上层血清,即得到去除CA125抗原的血清,再次进行CA125检测。
统计学处理
利用SPSS 15.0统计软件统计数据并进行统计分析,组间比较采用t检验,以P<0.05为差异具有统计学意义。
结 果
不同浓度CA125卵巢癌患者的外周血淋巴细胞数量和比率
高浓度CA125组卵巢癌患者的免疫状态明显低于正常水平,即其淋巴细胞绝对值及百分比均较对照组降低。在卵巢癌患者中,随着CA125水平的升高,淋巴细胞绝对值及百分比值呈现逐渐下降趋势(表1)。
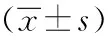
表 1 不同浓度CA125卵巢癌患者外周血淋巴细胞数量和比率
与健康对照组和良性疾病组比较,*P<0.05
不同浓度CA125卵巢癌患者血清对淋巴细胞培养上清中IFN-γ的影响
单独用PHA刺激(阳性对照)后混合淋巴细胞培养上清液中IFN-γ的含量为(45.68±18.01)ng/ml,分别采用高浓度(3000 U/ml)、中浓度(1000 U/ml)和低浓度(300 U/ml)CA125与PHA共同作用于淋巴细胞,混合培养后上清液中IFN-γ的含量分别为(36.16±16.89)、(39.15±8.18)和(46.22±19.30)ng/ml。高浓度组与阳性对照组和低浓度组比较,IFN-γ含量的差异均有统计学意义(P<0.05)。
不同浓度CA125对细胞免疫抑制功能的影响
为排除血清中可能存在的其他因素对实验的影响,本研究收集确诊的CA125<35 U/ml卵巢癌患者血清, 应用ELISPOT进行实验,每组检测5次取平均值作为斑点数。结果显示单纯PHA刺激组、健康对照组、良性疾病组以及CA125<35 U/ml卵巢癌患者组间差异无统计学意义,其斑点数分别为530.5、573.0、523.0和554.4。提示健康人和患者的血清中可能存在的其他成分对细胞免疫抑制功能无显著影响。
为观察不同浓度CA125对细胞免疫是否有抑制作用,本研究将不同浓度CA125的卵巢癌患者血清和PHA共同刺激健康人混合淋巴细胞,进行ELISPOT实验,每组平行操作5次取斑点数平均值。在排除其他因素影响的情况下,通过斑点计数和计算出的抑制率可以看出血清中的CA125对细胞免疫功能有抑制作用,且高浓度和中浓度CA125对免疫抑制功能与健康对照组和良性疾病组间比较差异有统计学意义(表2,图1)。
卵巢癌患者血清去除相应CA125后的各种免疫相关指标检测
对不同浓度CA125卵巢癌患者血清经相应的处理后,去除CA125的血清进行免疫抑制实验,结果显示去除CA125后免疫抑制作用明显减弱(表3)。
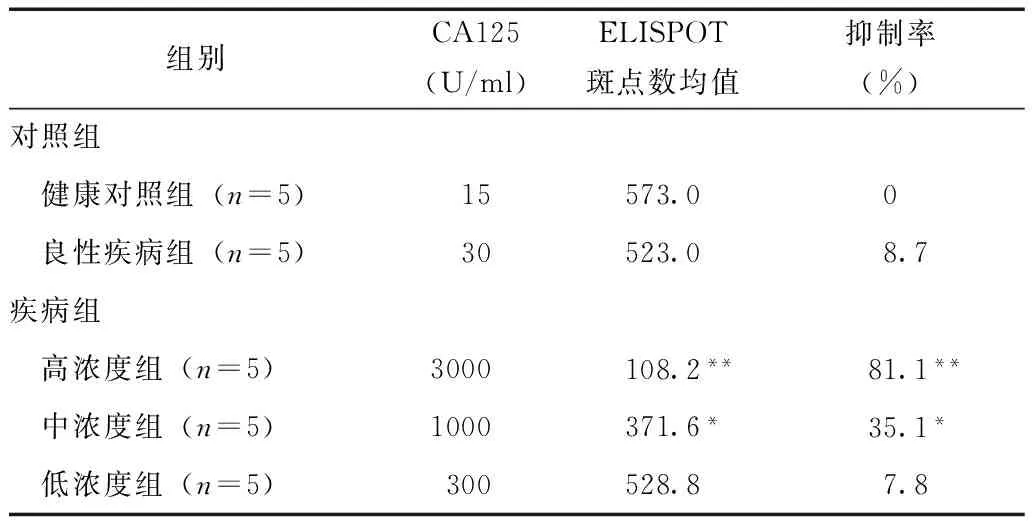
表 2 不同浓度CA125对培养T淋巴细胞免疫抑制作用比较
ELISPOT:酶联免疫斑点实验;与健康对照组和良性疾病组比较,*P<0.05,**P<0.01
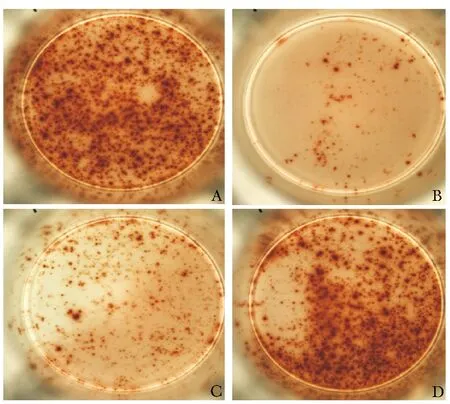
图 1 不同浓度CA125卵巢癌患者血清对T细胞激活的抑制作用(ELISPOT结果)A.对照组;B.高浓度CA125组;C.中浓度CA125组;D.低浓度CA125组
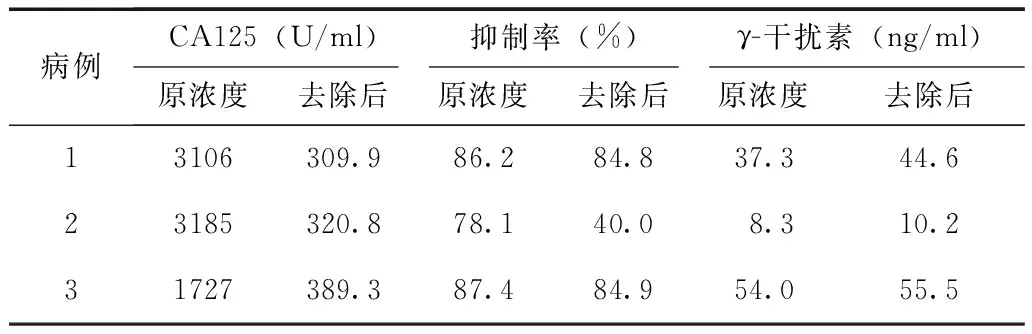
病例CA125(U/ml)抑制率(%)γ-干扰素(ng/ml)原浓度去除后原浓度去除后原浓度去除后13106309.986.284.837.344.623185320.878.140.08.310.231727389.387.484.954.055.5
讨 论
大量的临床实践显示,绝大多数卵巢癌患者体内有CA125的表达,尤其是中晚期患者CA125有极高水平表达。因此,CA125是目前比较理想的用于卵巢癌辅助诊断的血清标志物,也是卵巢癌治疗疗效和治疗后肿瘤是否复发的重要监测手段。但CA125的临床价值可能不仅仅如此,最近有文献报道,Ⅰ型- 凝集素Siglec- 9已经被确定为CA125的受体之一[4],其主要表达在NK细胞、B细胞和单核细胞上。研究发现肿瘤细胞可利用多种机制逃逸免疫系统的监视和攻击。有效的免疫监视很大程度上依赖于免疫细胞对肿瘤细胞的识别,研究发现卵巢癌细胞表面的MUC16与CA125结合阻止了NK细胞对卵巢癌细胞的有效识别,使卵巢癌细胞得以逃逸机体免疫系统的监视[6- 7]。在早期妊娠妇女,其体内CA125可以和相应受体结合,机体继而产生对早期受精卵的免疫抑制,促进受精卵的着床和正常妊娠的进行[8- 9]。由此推测,在卵巢癌患者体内,高浓度CA125结合相应的受体可抑制肿瘤免疫细胞活性,使肿瘤发生免疫逃逸。因此,CA125在相关肿瘤中的作用值得深入研究和探讨。
与其他恶性肿瘤一样,绝大多数卵巢癌患者存在免疫功能低下的现象[10- 11]。本研究显示,高浓度CA125卵巢癌患者的淋巴细胞数量及淋巴细胞比率均降低,免疫功能偏离正常状态。为探讨卵巢癌患者免疫功能低下与CA125是否相关,本研究采用了两种不同的方法进行实验,一种方法采用不同CA125浓度的卵巢癌患者血清与健康人混合淋巴细胞共同培养,检测培养上清中IFN-γ的含量;另一种方法采用ELISPOT技术检测不同CA125浓度的卵巢癌患者血清对混合淋巴细胞的免疫抑制程度。结果显示,高浓度CA125卵巢癌患者的血清与PHA共同刺激混合淋巴细胞,培养上清中IFN-γ含量较对照组显著降低,尤其是高浓度和中浓度CA125卵巢癌患者血清对混合淋巴细胞免疫抑制作用显著增加,且卵巢癌患者CA125的浓度越高,对细胞免疫抑制作用越强。
为排除血清中可能存在的其他因素对实验的影响,本研究收集确诊的CA125<35 U/ml卵巢癌患者血清,应用ELISPOT技术进行细胞免疫功能实验,结果显示斑点数在单纯PHA刺激组(阳性对照)、对照组(健康组和良性疾病组)以及CA125<35 U/ml卵巢癌患者组间差异无统计学意义,提示卵巢癌患者血清中可能存在的其他成分对细胞免疫抑制状态无显著影响,CA125可能是导致卵巢癌患者免疫功能低下的原因之一。为进一步了解CA125对细胞免疫功能状态的影响,本研究对高浓度CA125血清用免疫学方法去除,处理后血清CA125浓度均在700 U/ml以下,再对细胞免疫功能进行检测,结果显示培养上清中IFN-γ的含量有所上升。ELISPOT实验结果显示,低水平的CA125对细胞免疫抑制影响明显降低,与对照组比较差异无统计学意义,提示CA125参与了卵巢癌患者的部分细胞免疫抑制功能。
Pfisterer等[12]报道了CA125单抗药物用于晚期卵巢癌巩固治疗的随机对照研究,发现该药物能有效引起CA125的特异性免疫反应,有很好的治疗前景。尽管目前有限的临床试验尚未显示出针对CA125靶向治疗的明确疗效,但可以相信CA125靶向治疗将为陷于困境的卵巢癌治疗现状开启一线新的希望。因此通过对CA125的分子自身结构及其与淋巴细胞间的作用机制等多方面研究,期望能够更多地发现CA125在卵巢癌各阶段治疗中的潜在价值,可为CA125更好地在临床上应用提供更多依据。针对CA125对机体的免疫抑制作用,可以从以下几个方面进一步探索,最直接的办法是过滤去除体内的CA125,同时结合常规肿瘤治疗措施;也可利用去糖基化的物质对CA125进行处理,或人工制备CA125抗体,中和过量的CA125,抑制其功能的发挥等。鉴于两者的密切关联,从免疫方面来寻求对卵巢癌的治疗将会是一个很有希望取得突破性进展的途径,但其具体作用机制尚不明确,有待进一步研究。
综上,本实验结果表明卵巢癌患者体内的CA125水平与淋巴细胞的数量、活性及其产生细胞因子的活性呈现出负相关关系,这将对卵巢癌患者免疫状态的实时监测、治疗、预后、复发评价等起到很好的指导作用,也可能使CA125成为卵巢癌患者治疗的靶向因子。
致谢:北京协和医院感染科实验室张丽帆医生在酶免疫斑点检测中给予了帮助,特此致谢
[1]Kobayashi E, Ueda Y, Matsuzaki S, et al. Biomarkers for screening, diagnosis, and monitoring of ovarian cancer[J]. Cancer Epidemiol Biomarkers Prev,2012, 21:1902- 1912.
[2]Rooth C. Ovarian cancer: risk factors, treatment and management[J]. Br J Nurs, 2013,22: S23- S30.
[3]Yin BW, Lloyd KO. Molecular cloning of the CA125 ovarian cancer antigen:identification as a new mucin, MUC16 [J]. J Biol Chem, 2001,276:27371- 27375.
[4]Gubbels JA, Felder M, Horibata S, et al. MUC16 provides immune protection by inhibiting synapse formation between NK and ovarian tumor cells [J]. Mol Cancer, 2010, 9:11.
[5]Belisle JA, Gubbels JA, Raphael CA, et al. Peritoneal natural killer cells from epithelial ovarian cancer patients show an altered phenotype and bind to the tumour marker MUC16 (CA125) [J]. Immunology, 2007, 122:418- 429.
[6]Patankar MS, Jing Y, Morrison JC, et al. Potent suppression of natural killer cell response mediated by the ovarian tumor marker CA125[J]. Gynecol Oncol, 2005, 99:704- 713.
[7]Lanier LL. Natural killer cell receptor signaling[J]. Curr Opin Immunol, 2003,15:308- 314.
[8]Tyler C, Kapur A, Felder M, et al. The mucin MUC16 (CA125) binds to NK cells and monocytes from peripheral blood of women with healthy pregnancy and preeclampsia[J]. Am J Reprod Immunol, 2012, 68:28- 37.
[9]Radka S, Weston BS, Kieran W, et al. Exploring the glycosylation of serum CA125[J]. Int J Mol Sci, 2013, 14: 15636- 15654.
[10]朱兰,郎景和. 肿瘤标记物在妇科领域中的应用[J].中国实验诊断学,2012,6:301- 302.
[11]Gipson IK, Blalock T, Tisdale A, et al. MUC16 is lost from the uterodome (pinopode) surface of the receptive human endometrium:invitroevidence that MUC16 is a barrier to trophoblast adherence[J]. Biol Reprod, 2007, 78:134- 142.
[12]Pfisterer J, Mahner S. Towards individualised treatment in ovarian cancer [J]. Lancet Oncol, 2013, 14:101- 102.
Effect of CA125 on the Cellular Immune Function in Patients with Ovarian Cancer
LIU Zhong-juan1, SONG Gui-yu1, ZHAO Zhao-xia2, ZHANG Lin1, QIN Xu-zhen1, ZHANG Rui-li1,HAN Hui-juan1, GUO Zi-jian1
1Department of Clinical Laboratory, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100730, China2Department of Clinical Laboratory, the Fifth Hospital of Shijiazhuang, Shijiazhuang 050021, China
GUO Zi-jian Tel: 010-69159743, E-mail:guozj@pumch.cn
Objective To detect the effects of CA125 on cellular immune function of the ovarian cancer (OC) patientsinvitro. Methods Totally 58 patients with confirmed OC in our hospital from May 2012 to June 2013 were divided into three groups based on the CA125 levels. Meanwhile, 20 healthy subjects(control group) and 20 patients with benign gynecological diseases (benign diseases group) were also included. Theinvitroability of healthy human lymphocytes in secreting interferon-γ (IFN-γ) under the stimulation of phytohemagglutinin(PHA) was observed by cell culture, enzyme-linked immunosorbent assay (ELISA) and enzyme-linked immunospot (ELISPOT). Results In OC patients, the count and percentage of lymphocytes decreased gradually with elevated levels of CA125. The concentration of IFN-γ in the supernatant of cultured lymphocytes from healthy individuals decreased significantly under the stimulation of PHA and high concentration of CA125[(36.16±16.89)ng/ml]compared with that of PHA alone [(45.68±18.01)ng/ml] or PHA and low concentration of CA125 [(46.22±19.30)ng/ml](bothP<0.05). Compared with the control group(spots number 573.0) and the benign diseases group(spots number 523.0), the high(spots number 108.2) and intermediate(spots number 371.6) concentration of CA125 had significant inhibitory effect on the cellular immune system, as detected by ELISPOT (P<0.01,P<0.05, respectively). After removal of CA125 from the serum by antibody, the inhibitory effect was weakened significantly. Conclusions The concentration of CA125 in OC patient is negatively correlated with the number and activity of lymphocytes, in particular their abilities in releasing cytokines. CA125 is not only a biomarker of OC but also may serve as an immunosuppressive factor.
CA125;ovarian cancer;lymphocyte;cytokine; interferon-γ
郭子建 电话:010-69159743,E-mail:guozj@pumch.cn
R3- 3
A
1674-9081(2014)03-0273-05
10.3969/j.issn.1674-9081.2014.03.006
2014- 04- 04)

