全国27所医院多重耐药鲍曼不动杆菌及铜绿假单胞菌对12种抗菌药物的敏感性
范 欣,肖 盟,杨启文,窦红涛,郭莉娜,王 贺,原 英,王 澎,赵 颖,张 琪,肖永红,徐英春
1中国医学科学院 北京协和医学院 北京协和医院检验科, 北京 1007302中国医学科学院 北京协和医学院研究生院, 北京 1007303浙江大学医学院附属第一医院传染病诊治国家重点实验室, 杭州 310003
·论 著·
全国27所医院多重耐药鲍曼不动杆菌及铜绿假单胞菌对12种抗菌药物的敏感性
范 欣1,2,肖 盟1,2,杨启文1,窦红涛1,郭莉娜1,王 贺1,原 英1,王 澎1,赵 颖1,张 琪1,肖永红3,徐英春1
1中国医学科学院 北京协和医学院 北京协和医院检验科, 北京 1007302中国医学科学院 北京协和医学院研究生院, 北京 1007303浙江大学医学院附属第一医院传染病诊治国家重点实验室, 杭州 310003
目的 研究医院感染相关多重耐药鲍曼不动杆菌(multi-drug resistantAcinetobacterbaumannii,MDR-AB)及多重耐药铜绿假单胞菌(multi-drug resistantPseudomonasaeruginosa, MDR-PA)对12种抗菌药物的敏感性。方法 收集2011年8月至2012年7月全国27所教学医院分离的医院感染相关MDR-AB及MDR-PA菌株。所有菌株均分离自有明确感染意义的临床标本,严格排除痰及筛查性拭子。菌株收集后统一在微生物实验室采用微量肉汤稀释法,测定其对12种抗菌药物的最小抑菌浓度(minimum inhibitory concentration,MIC),并同时用CLSI M100-S24及M100-S23/S21鲍曼不动杆菌和铜绿假单胞菌的碳青霉烯类新旧折点进行对比分析。结果 本研究共收集到MDR-AB 664株,未发现全耐药鲍曼不动杆菌;收集到MDR-PA 268株,其中有4株全耐药铜绿假单胞菌。外科病房及ICU病房是多重耐药菌株的主要来源。MDR-AB对黏菌素的敏感率最高,为96.8%;替加环素的敏感率为72.6%,其余药物的敏感率均低于55%。MDR-PA对黏菌素的敏感率仅为72.4%,但对阿米卡星的敏感率(64.2%)明显高于MDR-AB(16.7%)。在CLSI折点改变后,MDR-AB对亚胺培南及美罗培南的敏感率仅分别下降了1.3%和0.6%,但MDR-PA对亚胺培南及美罗培南的敏感率分别下降了5.5%和8.6%。ICU病房来源的MDR-AB及MDR-PA对碳青霉烯酶类药物敏感率都明显低于外科及其他病房。不同地域来源多重耐药菌株的耐药谱有所差异。结论 黏菌素和替加环素对MDR-AB有良好的抗菌活性,黏菌素及阿米卡星对MDR-PA抗菌活性较好。
多重耐药;鲍曼不动杆菌;铜绿假单胞菌;药物敏感性;医院感染
MedJPUMCH,2014,5(3):253-258
鲍曼不动杆菌(Acinetobacterbaumannii,AB)和铜绿假单胞菌(Pseudomonasaeruginosa,PA)已经成为目前医院感染的重要病原菌,尤其在ICU病房的分离率常居榜首[1]。多重耐药菌引起的医院感染不仅导致患者住院时间延长、医疗费用上升,甚至危及患者生命[2- 3],同时也给医疗机构院感控制带来极大的挑战[4- 5]。因此,多重耐药菌的判定对临床治疗及院感控制措施的施行都有非常重要的意义。基于临床数据、药效学与药代动力学及菌株最小抑菌浓度(minimum inhibitory concentration,MIC)值分布等特征,美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)分别在2012年[6]及2014年[7]对PA及AB的碳青霉烯类折点进行了调整。为此,本研究针对医院感染多重耐药的AB及PA进行了抗菌药物敏感性调查研究,并比较CLSI折点改变对多重耐药菌株敏感性的影响。
材料和方法
菌株来源
连续收集来自全国27所教学医院的664株多重耐药鲍曼不动杆菌(multi-drug resistantAcinetobacterbaumannii, MDR-AB)菌株和268株多重耐药铜绿假单胞菌(multi-drug resistantPseudomonasaeruginosa, MDR-PA)菌株。菌株入选标准:(1) 入组时间:2011年8月1日至2012年7月30日;(2) 分离自住院患者(入院时间超过48 h)或在近30 d内有住院史的门诊患者(住院时间超过48 h)的菌株;(3) 分离自有明确感染意义的标本,收集的标本类型主要包括:血液、无菌体液(脑脊液、胸腹水、关节腔积液等)、组织、导管、脓肿、清洁中段尿、支气管肺泡灌洗液等。菌株排除标准:(1) 分离自痰或各类筛查性拭子的菌株;(2) 同一患者同一部位分离到的重复菌株。菌株收集完成后统一运送至北京协和医院检验科微生物实验室进行复核鉴定、体外药物敏感性测定及多重耐药的判定。
体外药物敏感性测定
根据美国CLSI M100-S24文件[8],采用微量肉汤稀释法测定入选菌株对抗菌药物的敏感性。药物种类及梯度范围如下:头孢哌酮/舒巴坦,0.25/0.12~32/16 μg/ml;哌拉西林/他唑巴坦,1/4~128/4 μg/ml;头孢他啶,0.5~64 μg/ml;头孢吡肟,0.5~32 μg/ml;氨曲南,0.06~8 μg/ml;亚胺培南,0.06~8 μg/ml;美罗培南,0.06~8 μg/ml;阿米卡星,1~128 μg/ml;环丙沙星,0.12~16 μg/ml;米诺环素,0.12~16 μg/ml;替加环素,0.06~8 μg/ml;黏菌素,0.12~16 μg/ml。
多重耐药的判定
多重耐药菌定义为对β-内酰胺/β-内酰胺酶抑制剂(哌拉西林/他唑巴坦或头孢哌酮/舒巴坦)、头孢菌素(头孢他啶或头孢吡肟)、单酰胺类(氨曲南)、碳青霉烯类(亚胺培南或美罗培南)、氨基糖苷类(阿米卡星)、氟喹诺酮类(环丙沙星)、四环素类(米诺环素)、甘氨酰类(替加环素)中三类或以上对该菌种均有潜在抗菌活性的药物耐药的菌株[9]。泛耐药菌定义为仅对1~2种对该菌种有潜在抗菌活性的药物敏感的菌株[10]。全耐药菌定义为对目前所能获得的有潜在抗菌活性的抗菌药物均耐药的菌株[9]。
统计学处理
实验结果采用WHONET 5.6软件进行统计学分析。各抗菌药物敏感性参照CLSI M100-S24进行判定[6];替加环素对AB的敏感性根据美国FDA推荐折点进行判定,对其他尚无折点的药物仅对MIC50及MIC90进行分析。
结 果
标本来源及科室分布
本研究共收集到MDR-AB 664株,其中泛耐药AB 174株,未发现全耐药AB;收集到MDR-PA 268株,其中泛耐药PA 143株,全耐药PA 4株。MDR-AB主要分离自脓液(20.9%)、血液(18.1%)、导管(12.7%)、尿液(11.9%)、引流液(8.1%)、支气管肺泡灌洗液(7.7%)及脑脊液(7.7%)等;MDR-PA主要分离自脓液(18.7%)、血液(16.8%)、尿液(16.8%)、支气管肺泡灌洗液(12.3%)及导管(7.8%)等。从科室分析,外科病房及ICU均是多重耐药菌株的主要来源,其中有39.9%的MDR-AB分离自外科病房,39.8%分离自ICU病房;有38.8%的MDR-PA分离自外科病房,27.2%分离自ICU病房。泛耐药菌株分布未发现明显的科室差异。4株全耐药PA分离自三家医院,未发现明显的流行病学联系。
药物敏感性分析结果
MDR-AB对黏菌素的敏感率最高,达96.8%;对替加环素敏感率也达到了72.6%,其余药物的敏感率均低于55%。两种碳青霉烯类抗菌药物(亚胺培南及美罗培南)的敏感率仅为12.0%及12.2%。此外,米诺环素的敏感率为52.6%,高于其他种类抗菌药物。相比MDR-AB,MDR-PA对黏菌素的敏感率仅为72.4%,但对阿米卡星的敏感率(64.2%)明显高于MDR-AB(16.7%)。亚胺培南及美罗培南的敏感率也仅为14.6%和16.4%(表1)。
临床判定折点改变前后药物敏感性分析结果
比较CLSI M100-S23/21和M100-S24对碳青霉烯类折点改变前后敏感率发现,MDR-AB对亚胺培南及美罗培南的敏感率仅分别下降了1.3%及0.6%;但折点更新后,MDR-PA对亚胺培南的敏感率由20.1%下降至14.6%,对美罗培南的敏感率由25.0%下降至16.4%,分别下降了5.5%及8.6%(表2)。
不同科室来源菌株药敏结果比较
大部分抗菌药物对MDR-AB和MDR-PA的抗菌活性在ICU病房、外科病房及其他病区(内科病房、急诊病房及有住院史的门诊)之间无明显差异。但是,ICU病房来源的MDR-AB对哌拉西林/他唑巴坦及碳青霉烯酶类抗菌药物敏感率明显低于外科及其他病房(P<0.05),其他病房来源的MDR-AB对阿米卡星的敏感率明显高于ICU及外科病房(P<0.05)。对于MDR-PA,ICU来源的菌株对碳青霉烯类抗菌药物的敏感率低于外科来源菌株,外科来源菌株敏感率又低于其他来源菌株(P<0.05)(表3)。
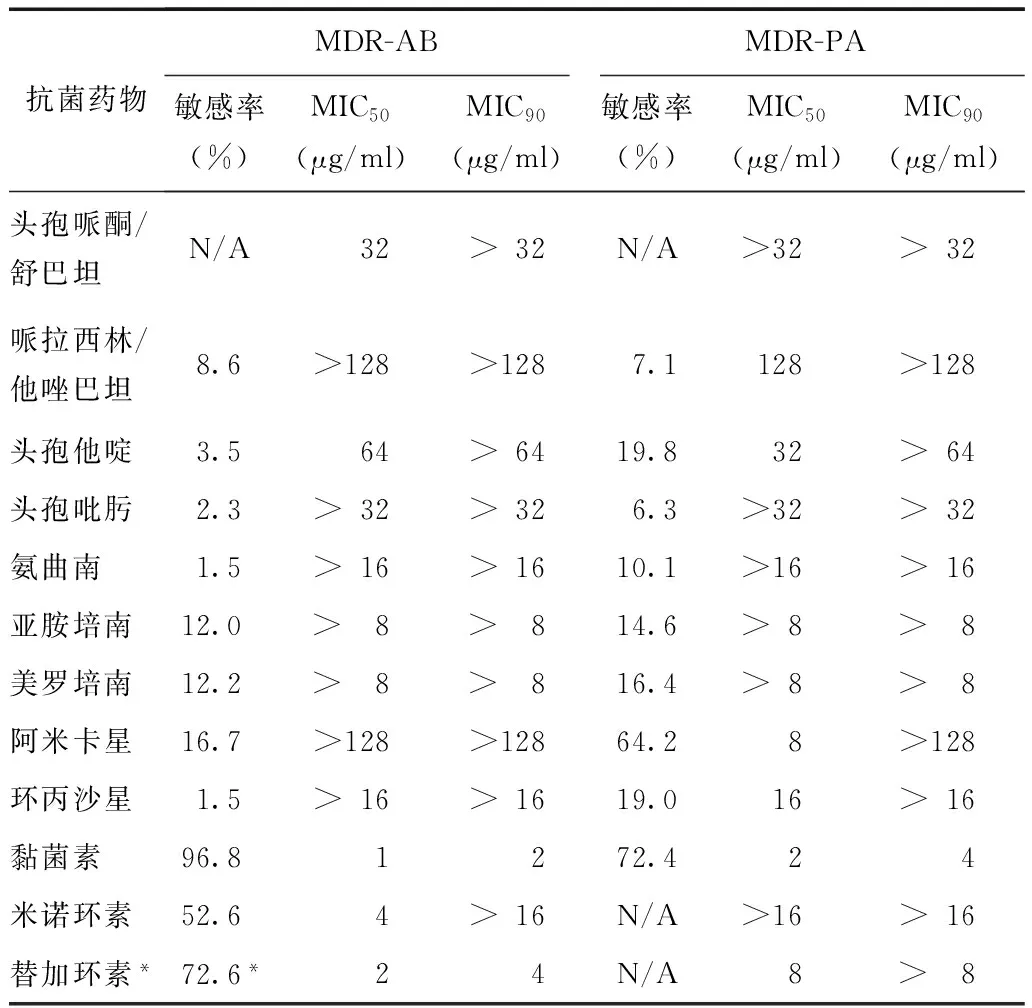
表 1 多重耐药鲍曼不动杆菌及铜绿假单胞菌体外药敏结果
N/A:无法判定;MDR-AB:多重耐药鲍曼不动杆菌;MDR-PA:多重耐药铜绿假单胞菌;MIC:最小抑菌浓度
*按照美国FDA推荐折点判定
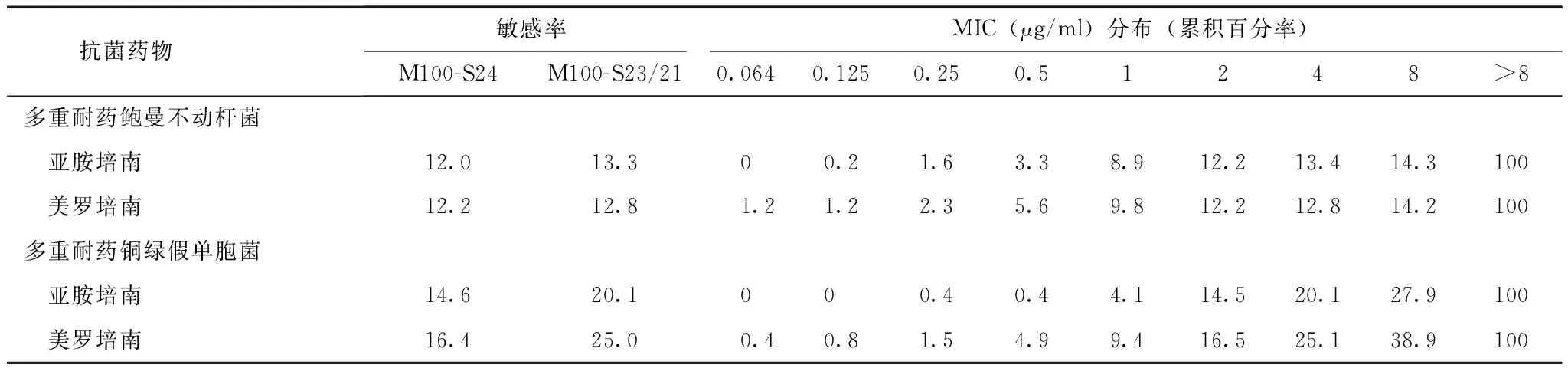
表 2 亚胺培南及美罗培南MIC分布及新旧折点菌株敏感率比较(%)
MIC:同表1
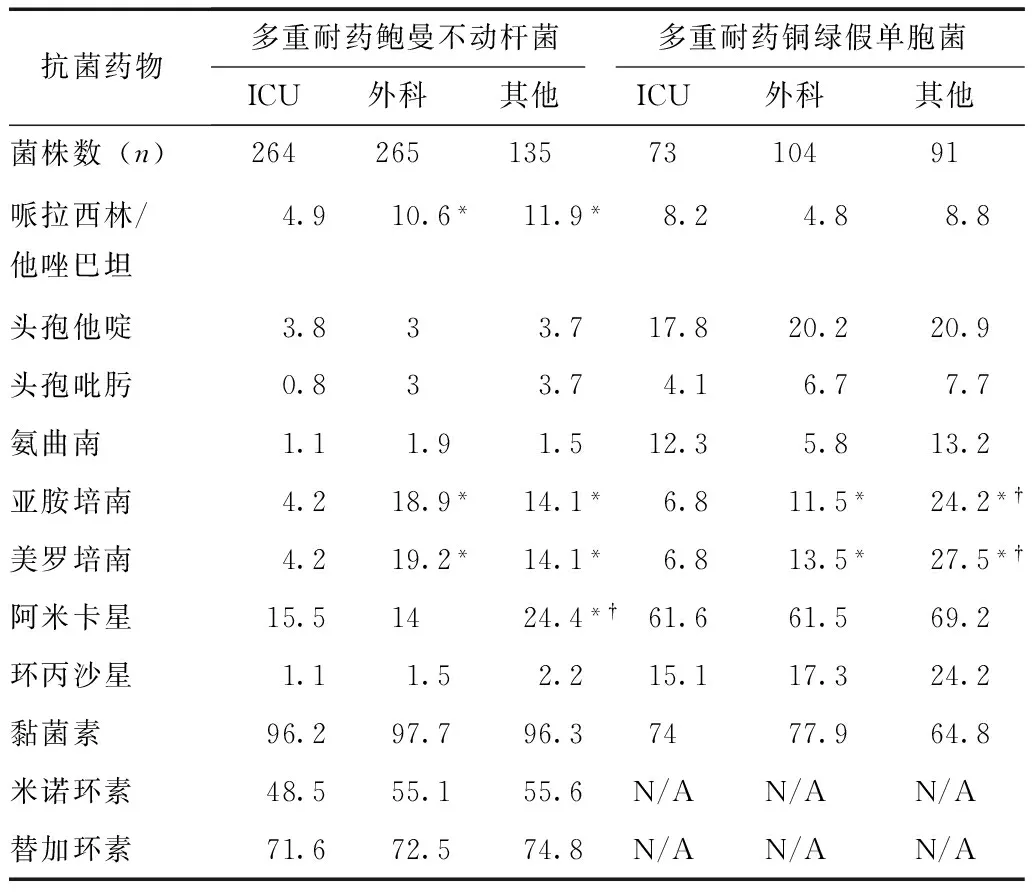
表 3 不同科室多重耐药鲍曼不动杆菌及铜绿假单胞菌体外药物敏感率比较(%)
N/A:无法判定;与ICU病房比较,*P<0.05;与外科病房比较,†P<0.05
不同地域来源菌株药敏结果比较
根据菌株来源的地域分析,不同地域MDR-AB菌株的耐药谱有所差异,华东地区MDR-AB对米诺环素的敏感率仅27.3%,而西南地区菌株的敏感率可高达98.4%;西南地区MDR-AB对替加环素100%敏感,但中南地区和华东地区菌株敏感率仅为62.7%及63.6%;西北地区MDR-AB对哌拉西林/他唑巴坦及碳青霉烯类的敏感率都明显高于华东地区来源菌株。不同地域来源MDR-PA菌株耐药谱差异较大,未发现明显规律性差异(表4)。
讨 论
细菌耐药性的日趋增长是全球共同面临的重大问题。在我国,由于广泛存在抗菌药物使用不合理等情况,临床所面临的细菌耐药问题更加严重[11],对于多重耐药菌的控制和治疗已经成为医疗机构面临的众多挑战之一。MDR-AB及MDR-PA是目前国内医院防控的重要病原菌。多重耐药菌感染对患者住院时间、疾病预后等都有直接影响[2- 3]。
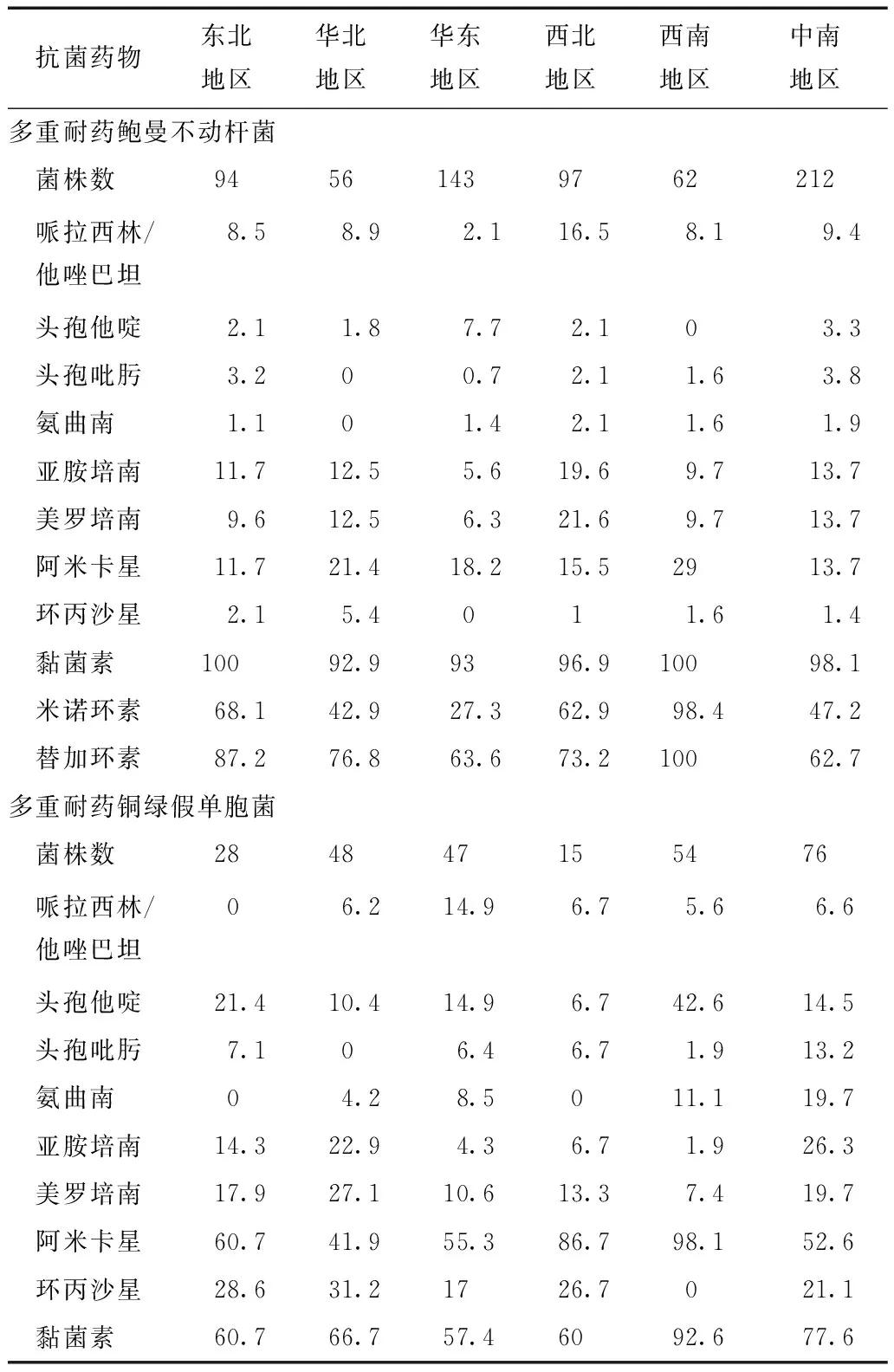
表 4 全国各地区多重耐药鲍曼不动杆菌及铜绿假单胞菌药物敏感率比较(%)
华北地区:北京市、天津市、河北省、山西省、内蒙古自治区;东北地区:辽宁省、吉林省、黑龙江省;华东地区:浙江省、安徽省、山东省;中南地区:河南省、湖北省、湖南省、广东省、海南省、广西壮族自治区;西南地区:四川省、云南省;西北地区:陕西省、甘肃省、青海省、宁夏回族自治区、新疆维吾尔自治区
由于本研究严格排除了痰、筛查性拭子等标本来源的菌株,菌株主要来源于脓、血液等具有明确感染意义的高质量标本,因此调查结果具有一定的临床代表性。本研究数据显示,MDR-AB及MDR-PA主要分离自外科病房及ICU病房,明显高于内科病房及急诊等其他病房,分析可能的主要原因是入住外科及ICU的患者侵入性操作较多,这与文献报道的AB感染的危险因素(主要包括入住监护室、机械通气、侵入性操作、长期住院等)一致[12]。本研究发现,ICU来源的MDR菌株对碳青霉烯类药物的敏感率都明显低于外科病房及其他病房,这可能与ICU病房抗菌药物暴露程度高有关[10]。
CLSI分别在其2012年修订(M100-S22)[6]及2014年修订(M100-S24)[7]版本中,将PA及AB对亚胺培南和美罗培南的敏感性折点进行了更新,将敏感及耐药界值分别从4 μg/ml及16 μg/ml下降至2 μg/ml及8 μg/ml。欧洲抗生素药物敏感试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)文件中除PA对亚胺培南的敏感界值为4 μg/ml之外,PA与AB对亚胺培南、美罗培南的其他折点与CLSI新折点均一致[13]。对比折点改变前后,MDR-AB对亚胺培南及美罗培南的敏感率变化不大,但MDR-PA的敏感率变化较大,分别下降了5.5%及8.6%。目前,我国绝大部分微生物实验室仍然采用CLSI文件进行药敏结果分析,因此,CLSI文件的改变预期将对我国抗菌药物的临床使用产生一定的影响。
替加环素是在我国新近上市的甘氨酰类抗菌药物,具有广谱抗菌活性[14]。本研究结果显示,MDR-AB对替加环素的总体敏感率为72.6%,不同地域来源菌株的敏感率为62.7%到100%不等,与国内其他文献报告结果类似[15]。但是,在替加环素在我国上市之前,张小江等[14]的单中心研究结果显示其对MDR-AB的敏感率为97.3%。替加环素敏感率的下降,可能与药物的临床暴露以及研究菌株的入组条件选择有一定关系。
虽然在本次全国范围的监测研究中,共发现全耐药PA 4株,未发现全耐药AB,但需要注意的是,仍然有174株泛耐药AB,这部分菌株仅对黏菌素或替加环素2种药物敏感。不同地域MDR-AB菌株对哌拉西林/他唑巴坦、碳青霉烯类、米诺环素及替加环素的敏感率有所差别,可能与不同地域抗菌药物使用强度不同有关。由于PA对替加环素、米诺环素天然耐药,具有潜在抗假单胞菌活性的药物中,黏菌素及阿米卡星对MDR-PA的抗菌活性最高,敏感率分别为72.4%和64.2%。近期,Ji等[16]报道了在我国头孢他啶或碳青酶烯类非敏感的PA基因型呈多样化,本研究也发现不同地域来源MDR-PA的耐药谱差异较大,这与基因型多样的情况一致。
总之,对于医院感染相关MDR-AB及MDR-PA持续监测及感染控制仍然是今后微生物实验室及感染控制部门工作的重点。另外,该部分药物敏感性数据将作为进一步分子耐药机制及流行病学研究的基础,结合分子生物学分析,预期研究将可以更全面获得我国医院感染多重耐药革兰阴性菌的重要信息。
致谢:感谢参加本次监测的医院及研究团队(按医院名称拼音排序):安徽医科大学第一附属医院(沈继录)、甘肃省人民医院(魏莲花)、桂平市人民医院(黎日海)、哈尔滨医科大学第一附属医院(路娟)、海口市人民医院(吴多荣)、汉中3201医院(辜依海)、河北医科大学第二医院(赵建宏)、华中科技大学同济医学院附属同济医院(孙自镛)、吉林省人民医院(段穷)、昆明市第一人民医院(胡大春)、宁夏回族自治区人民医院(朴文花)、青海大学附属医院(赵玲莉)、青海红十字医院(马慧英)、青海省人民医院(阿祥仁)、山东省立医院(金炎)、山西医科大学附属第一医院(赵克斌)、深圳市人民医院(吴伟元)、四川省人民医院(喻华)、天津医科大学总医院(胡志东)、新疆医学院附属医院(季萍)、兴安盟人民医院(国钰梅)、浙江大学医学院附属第一医院(陈瑜)、浙江大学医学院附属邵逸夫医院(俞云松)、郑州大学第一附属医院(冯羡菊)、中国人民解放军总医院第一附属医院(蒋伟)、中国医科大学附属盛京医院(秦晓松)、中南大学附属湘雅医院(黄勋)
[1]肖永红,沈萍,魏泽庆,等. Mohnarin 2011年度全国细菌耐药监测[J]. 中华医院感染学杂志,2012,22:4946- 4952.
[2]Pitout JD. Extraintestinal pathogenicEscherichiacoli:an update on antimicrobial resistance,laboratory diagnosis and treatment [J]. Expert Rev Anti Infect Ther,2012,10:1165- 1176.
[3]Falagas ME,Kopterides P. Risk factors for the isolation of multi-drug-resistantAcinetobacterbaumanniiandPseudomonasaeruginosa:a systematic review of the literature [J]. J Hosp Infect,2006,64:7- 15.
[4]Yang Q,Wang H,Chen M,et al. Surveillance of antimicrobial susceptibility of aerobic and facultative Gram-negative bacilli isolated from patients with intra-abdominal infections in China:the 2002-2009 Study for Monitoring Antimicrobial Resistance Trends(SMART)[J]. Int J Antimicrob Agents,2010,36:507- 512.
[5]Yang Q,Zhang H,Wang Y,et al. A ten-year surveillance for antimicrobial susceptibility ofEscherichiacoliandKlebsiellapneumoniaein community- and hospital-associated intra-abdominal infections in China [J]. J Med Microbiol,2013,62(Pt 9):1343- 1349.
[6]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing:twenty-second informational supplement. M100-S22 [S]. Wayne, PA:CLSI, 2012.
[7]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing:twenty-forth informational supplement. M100-S24 [S]. Wayne, PA:CLSI, 2014.
[8]Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically;approved standard-ninth edition. M7-A9 [S]. Wayne, PA:CLSI, 2012.
[9]Falagas ME,Koletsi PK,Bliziotis IA. The diversity of definitions of multidrug-resistant(MDR)and pan-drug resistant(PDR)AcinetobacterbaumanniiandPseudomonasaeruginosa[J]. J Med Microbiol,2006,55(Pt 12):1619- 1629.
[10]Chan MC,Chiu SK,Hsueh PR, et al. Risk factors for healthcare-associated extensively drug-resistantAcinetobacterbaumanniiinfections:a case-control study [J]. PLoS One,2014,9:e85973.
[11]Xiao YH,Giske CG,Wei ZQ,et al. Epidemiology and characteristics of antimicrobial resistance in China[J]. Drug Resist Updat,2011,14:236- 250.
[12]Park SY,Choo JW,Kwon SH,et al. Risk factors for mortality in patients withAcinetobacterbaumanniibacteremia[J]. Infect Chemother,2013,45:325- 330.
[13]The European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 4.0,2014[EB/OL].[2014- 04- 29]http://www.eucast.org/clinical_breakpoints/
[14]张小江,徐英春,原英,等. 替加环素等14种抗菌药物对多重耐药菌的体外抗菌活性研究[J]. 中国感染与化疗杂志,2009,9:365- 368.
[15]陈佰义,何礼贤,胡必杰,等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中华医学杂志,2012,92:76- 85.
[16]Ji J, Wang J, Zhou Z, et al.Multilocus sequence typing reveals genetic diversity of carbapenem- or ceftazidime-nonsusceptiblePseudomonasaeruginosain China [J].Antimicrob Agents Chemother, 2013,57:5697- 5700.
Antimicrobial Susceptibility of Multi-drug ResistantAcinetobacterBaumanniiandPseudomonasAeruginosaIsolates from 27 Hospitals in China
FAN Xin1,2, XIAO Meng1,2, YANG Qi-wen1, DOU Hong-tao1, GUO Li-na1, WANG He1, YUAN Ying1,WANG Peng1, ZHAO Ying1, ZHANG Qi1, XIAO Yong-hong3, XU Ying-chun1
1Department of Clinical Laboratory, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100730, China2Graduate School, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100730, China3State Key Laboratory for Diagnosis and Treatment of Infectious Diseases, the First Affiliated Hospital, Medical College of Zhejiang University, Hangzhou 310003, China
XU Ying-chun Tel: 010-69159766,E-mail:xycpumch@139.com
Objective To investigate the antimicrobial susceptibilities of nosocomial multi-drug resistant
Acinetobacterbaumannii(MDR-AB) and multi-drug resistantPseudomonasaeruginosa(MDR-PA) isolates. Methods MDR-AB and MDR-PA isolates were collected between August 2011 and July 2012 from 27 hospitals in China. All isolates were collected from high quality samples with definite infection diagnoses, whilst isolates from sputum and screen samples were strictly excluded. Minimum inhibitory concentrations (MICs) of 12 commonly used antimicrobial agents were tested by broth microdilution method in a microbiology laboratory. CLSI clinical breakpoints(CBPs) of pre- and post-revision were applied and compared in determination of MDR. Results A total of 664 MDR-AB and 268 MDR-PA isolates were collected. Pan-drug resistant (PDR) was detected in fourPseudomonasaeruginosabut not inAcinetobacterbaumannii. The majority of isolates were collected from ICUs and surgical wards. Colistin and tigecycline were the most active agents against MDR-AB (96.8% and 72.6% susceptible, respectively), while no other drug exhibited activity of >55% susceptible. Only 72.4% of MDR-PA isolates remained susceptible to colistin, but amikacin was more active to MDR-PA (64.2%) than MDR-AB (16.7%). By applying revised CBPs, the susceptibility of MDR-AB isolates to imipenem and meropenem decreased by 1.3% and 0.6%, respectively, whereas the susceptibility of MDR-PA to these two drugs decreased by 5.5% and 8.6%, respectively. The carbapenems susceptible rate of isolates collected from ICUs was lower than surgical and other wards. Isolates collected from different geographic regions showed varied resistant profiles. ConclusionsColistin and tigecycline are the most active drugs against MDR-AB, while colistin and amikacin have comparably good performance to MDR-PA.
multi-drug resistance;Acinetobacterbaumannii;Pseudomonasaeruginosa;antimicrobial susceptibility;nosocomial infection
卫生公益性行业科研专项 (201002021)
徐英春 电话:010-69159766,E-mail:xycpumch@139.com
R446.5
A
1674-9081(2014)03-0253-06
10.3969/j.issn.1674-9081.2014.03.002
2014- 04- 29)

