硅质体作为新型药物载体的研究进展
康传哲,何 伊,马满玲
硅质体作为新型药物载体的研究进展
康传哲,何 伊,马满玲
硅质体;药物载体;研究进展
脂质体(liposome)是磷脂分散在水中时形成的脂质双分子层,又称为人工生物膜。自1971年首次作为药物载体应用以来,由于其良好的生物相容性、靶向性及缓释特性,使其成为世界上生物医药领域最热门的靶向给药技术[1]。但由胆固醇和磷脂构成的传统脂质体存在体内外稳定性差、靶向性不理想等缺点,因而限制了脂质体的临床应用和工业化生产[2]。20世纪80年代开发出了稳定的肽脂质,肽脂质分子在水溶液中通过自组装形成脂质体,分子间酰胺键形成的氢键带大大提高了脂质体的稳定性。Katagiri等[3]在肽脂质结构的基础上,设计合成了一种带有三乙氧基硅烷头部的有机-无机复合脂质分子,该分子在水中通过溶胶-凝胶和自组装过程形成类脂质体囊泡,称为硅质体。硅质体是一种类似于脂质体的有机-无机复合创新材料,以表层的硅氧烷网络大幅提高稳定性而弥补了脂质体的不足,同时具有良好的生物相容性和缓释特性[4-5]。
1 硅质体概述
硅质体(cerasome)是20世纪90年代末开发出来的一种新型类脂质体囊泡。Katagiri等[3]设计合成了一种新的有机-无机复合脂质分子,并将其制备成内部具有脂质双分子层结构和表面具有无机聚硅氧烷网状结构的囊泡(图1)。硅质体的前体有机-无机复合脂质分子是一种新型的有机-无机纳米复合材料,这种材料与通常的聚合物/无机填料体系不同,并不是无机相与有机相的简单加和,而是由无机相与有机相在纳米至亚微米范围内通过较强或较弱化学键(范德华力、氢键)结合而成,兼具有机聚合物和无机材料的优异性能[6]。硅质体类似于脂质体的结构,可以包埋各种水溶液和脂溶性药物,并且通过调控硅氧聚合表面的缩合度和空隙可以控制药物的体内外释放。此外,由于硅氧聚合表面的羟基具有很好的化学活性,通过表面修饰,可以将各种靶向分子连接到硅氧聚合物表面,使其能向病灶组织有效地送递和释放药物[7]。因而,作为一种药物载体,硅质体不仅具有开发控释制剂的优越性能,而且具有开发靶向药物的潜力。
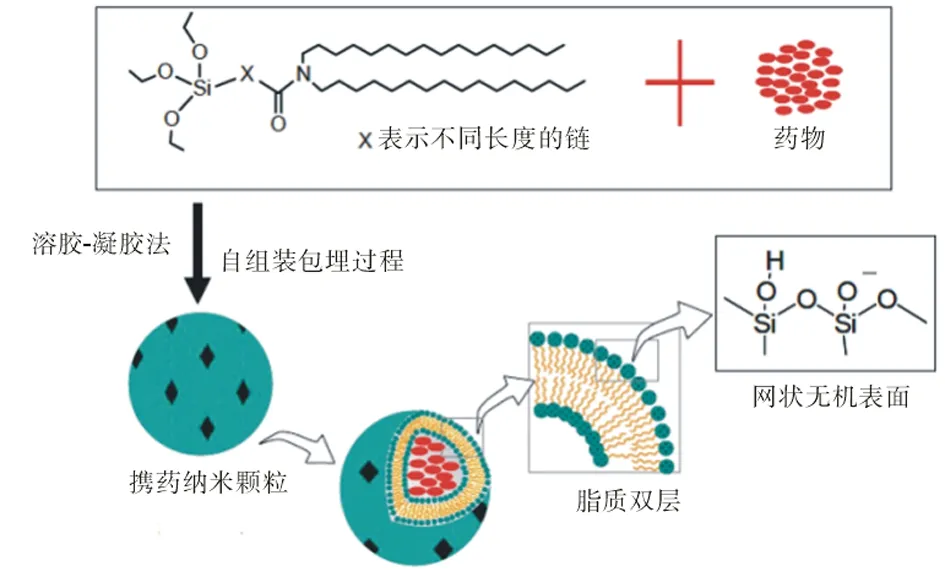
图1 硅质体结构示意图
2 硅质体作为药物载体的特点
作为一种新型的药物传递系统,硅质体在许多方面具有优势:(1)与传统的脂质体相比,硅烷表面大大增加了硅质体的力学稳定性和热稳定性。硅质体纳米粒子能够在干燥状态下组装到固体基片表面,形成三维多细胞结构,这对传统囊泡来说是不可能的[8]。(2)聚硅烷表面能够确保硅质体在弱碱性pH值或者强盐离子浓度环境下稳定存在。(3)与二氧化硅纳米粒子相比,脂质双层结构的存在降低了硅质体粒子整体的刚性和密度,增强了这种粒子在液相环境中的稳定性,防止聚集的发生。(4)硅质体单体分子中含有Si-C键,这样的化学组成使其可以被生物降解。(5)硅质体粒子可以装载亲水、疏水或者两亲性药物分子,通过硅氧聚合表面的缩合度和空隙可以控制药物的体内外释放,同时不破坏它们的形态学稳定性。(6)硅质体外表面的硅醇基团具有很好的化学活性,容易被功能化,通过硅烷耦联化学反应能够很容易地将一些生物分子(抗体)连接到表面,使其能向肿瘤组织有效地输送和释放药物。正是由于硅质体具有以上诸多优势,使其在生物医学领域具有广泛的应用前景,可以作为基因载体、药物运输载体等。
3 硅质体作为药物载体的应用
3.1 烷烃硅质体 烷烃硅质体的疏水尾部为烷烃双链,烷烃硅质体具有和脂质体类似的双分子层结构,有双链烷烃作为其疏水的尾部,表面覆盖无机硅酸盐的网络结构,其中硅元素占整个载体的质量不到4%,在大大提高硅质体稳定性的同时,并没有增加载体的质量密度。且有良好的生物相容性,能装载亲水、疏水和两亲性药物,具备作为药物载体的特性。Zhong等[9]首次将烷烃硅质体作为抗癌药物的载体用于药物转运,制备了紫杉醇和盐酸阿霉素硅质体,并对紫杉醇硅质体的体外稳定性进行了系统的研究。与传统的脂质体相比,装载紫杉醇药物的硅质体具有很高的化学稳定性和贮存稳定性,并且有很好的生物相容性和缓释特性。采用薄膜水化超声法成功制备掺杂磷脂的紫杉醇的混合硅质体,混合硅质体与传统脂质体相比确实有效减缓了药物的释放速率,可通过调节磷脂的比例来控制药物释放速度[10]。该实验结果提供了一种控制药物释放新的思路,为临床应用研究提供了前期的理论和实验基础。Yushen等[11]对盐酸阿霉素硅质体的体外稳定性研究表明,其具有长期储存稳定性及良好的控制释放性能。
3.2 胆固醇硅质体 烷烃硅质体作为药物载体,虽然在生物医学领域得到了广泛的应用,但是,烷烃硅质体疏水的尾部为烷烃双链,这样的结构使其具有较低的相变温度,作为药物载体在体内运输过程中,容易导致药物的提前泄露,在到达靶位点之前大量药物被释放出来,从而对机体产生严重的毒副作用,药物的疗效降低。传统的药物载体本身无治疗作用,大量载体随着药物进入到了人体,增加了机体的负担。因此,研制本身具有治疗效果的“活性”载体具有重要意义。Yan等[12]设计合成了一种疏水链为胆固醇的新型有机-无机复合脂质,并以此为原料制备了胆固醇硅质体。研究发现,在不携带任何药物时,这种硅质体本身能选择性地杀死白血病细胞,而对正常血液细胞没有毒性;而且,在携带化疗药物阿霉素时,可显著增强阿霉素对白血病细胞的杀伤力。由于它既能降低化疗药物的使用量,减少化疗引起的毒副作用,又能降低载体的使用量,减少人体的负担,因此在白血病治疗方面具有重要的应用前景,并为研制新型药物载体提供了新的理念。与烷烃硅质体相比,胆固醇硅质体不仅提高了相变温度增加了硅质体的稳定性,而且大大提高了其生物相容性[13]。
3.3 功能化硅质体 硅质体硅氧聚合表面的羟基具有很好的化学活性,通过表面修饰,可以将各种靶向分子连接到硅氧聚合物表面,使其能向病灶组织有效地送递和释放药物。曹众[14]以烷烃硅质体脂质为基础,制备的Fe3O4磁性盐酸阿霉素硅质体显示了很好的磁靶向功能和脂质体的所有特性。与脂质体相比还具有更高的稳定性,解决了脂质体稳定性和缓释性差的缺点,这种集示踪、靶向和可控释放的多功能药物传输载体将具有重要的临床实际意义。Xiaolong等[15]开发出了一种含偶氮基团的新型复合脂质,并制备成了硅质体,该硅质体具有两个方面的特点,一方面其分子结构中含有-Si(OEt)3或-Si(OCH3)3基团,通过水解缩合可形成稳定的Si-O-Si网络结构,共价键连覆盖于硅质体的表面,从而极大地增强其稳定性;另一方面,由于含有偶氮苯基团,通过光控方法可以方便地改变脂质双层的渗透性,从而实现对药物的可控释放(图2)。Yan 等[16]以胆固醇复合脂质为基础,制备了一种多功能硅质体复合物,即金壳修饰的硅质体复合物,同时装载了阿霉素以及四氧化三铁磁性纳米粒子,这种复合物既具有磁共振成像、磁靶向的药物运输,又具有光引发的药物释放以及光热治疗等多种功能。克服了传统药物载体靶向性差、功能单一的缺点。这种多功能的纳米复合物药物运输系统,在肿瘤的联合治疗中具有重要的应用前景。
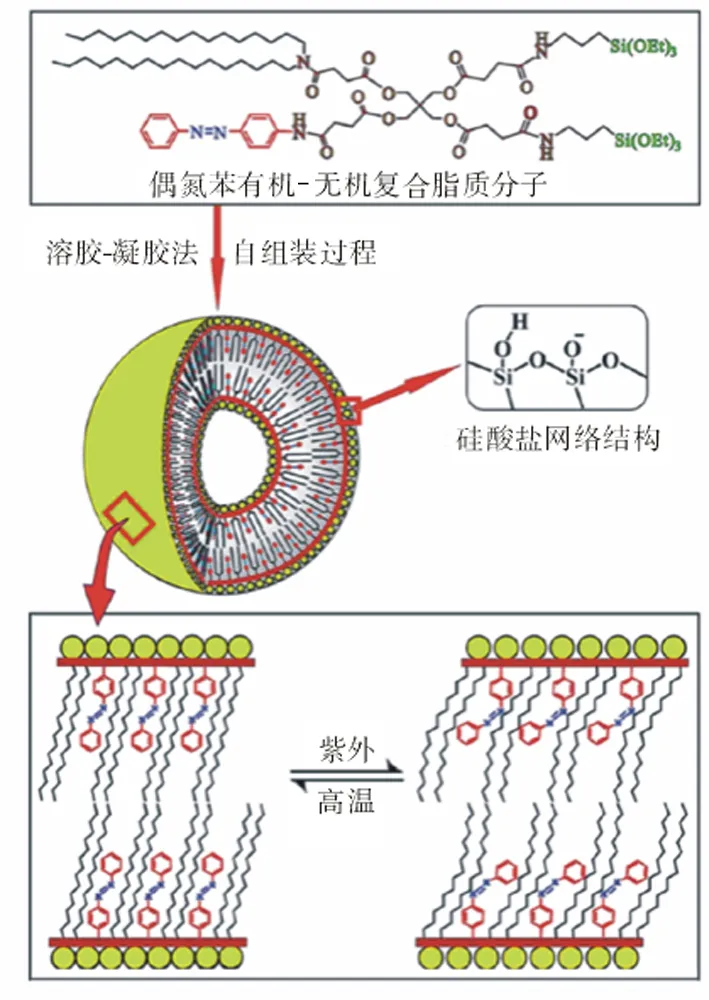
图2 偶氮苯硅质体形成和光控改变其脂质双层渗透性示意图
4 结语
硅质体是一种新型的纳米药物载体,由于其自身的诸多优势,使其在生物医学领域得到了广泛的应用。近年来对硅质体的研究也越来越深入,设计并制备出了一些具有特殊功能的硅质体。但是硅质体体内释药行为、靶向性及代谢途径等还缺乏深入的研究。硅质体是具有我国自主知识产权的新型药物载体,无需采用特殊方法便可实现极高的物理化学稳定性,制备工艺简单,便于工业化生产,将为我国药物制剂的研究、开发、应用和推广提供一个全新的开放式技术平台。
[1] Abolfazl Akbarzadeh,Rogaie Rezaei-Sadabady,Soodabeh Davaran,et al.Liposome:classification,preparation,and applications[J].Nanoscale Res Lett,2013,8(1):102.
[2] Andreas Wagner,Karola Vorauer-Uhl.Liposome technology for industrial purposes[J].Journal of Drug Delivery,2011,2011:1-9.
[3] Katagiri K,Ariga K,Kikuchi J.Preparation of organic-inorganic hybrid vesicle “cerasome” derived from artificial lipid with alkoxysilyl head[J].Chemistry Letters,1999(7):661-662.
[4] Katagiri K,Hashizume M,Ariga K,et al.Preparation and characte-rization of a novel organic-inorganic nanohybrid “cerasome” formed with a liposomal membrane and silicate surface[J].Chem Eur J,2007,13(18):5272-5281.
[5] Katagiri K.Sol-gel nanohybrid materials prepared via supramolecular organization[J].J Sol-Gel Sci Technol,2008,46(3):251-257.
[6] Mineo Hashizume,Hiroyuki Horii,Jun-ichi Kikuchi,et al.Effects of surface carboxylic acid groups of cerasomes,morphologically stable vesicles having a silica surface,on biomimetic deposition of hydroxyapatite in bodyfluid conditions[J].J Mater Sci,2010,21:11-19.
[7] Daiki Minamida,Shusuke Okada,Mineo Hashizume.Creation of magnetic cerasomes through electroless plating and their manipulation using external magnetic fields[J].J Sol-Gel Sci Technol,2008,48:95-101.
[8] Zhifei Dai,Wenjie Tian,Xiuli Yue,et al.Efficient fluorescence reso-nance energy transfer in highly stable liposomal nanohybrid cerasome[J].Chemical Communications,2009,15:2032-2034.
[9] Zhong Cao,Yan Ma,Xiuli Yue,et al.Stabilized liposomal nanohybrid cerasomes for drug delivery applications[J].Chemical Communications,2010,46(29):5265-5267.
[10] Zhong Cao,Xiuli Yue,Yushen Jin,et al.Modulation of release of paclitaxel from composite cerasomes[J].Colloids and Surfaces B,2012,98:97-104.
[11] Yushen Jin,Xiuli Yue,Qingyuan Zhang,et al.Cerasomal doxorubicin with long-term storage stability and controllable sustained release[J].Acta Biomaterialia,2012,8:3372-3380.
[12] Yan Ma,Zhifei Dai,Zhengbao Zha,et al.Selective antileukemia effect of stabilized nanohybrid vesicles based on cholesteryl succinyl silane[J].Biomaterials,2011,32(35):9300-9307.
[13] Yan Ma,Zhifei Dai,Yanguang Gao,et al.Liposomal architecture boosts biocompatibility of nanohybrid cerasomes[J].Nanotoxicology,2011,5(4):622-635.
[14] 曹众.基于硅质体的新型纳米药物载体材料的研究[D].哈尔滨:哈尔滨工业大学生命科学与技术学院,2011.
[15] Xiaolong Liang,Xiuli Yue,Zhifei Dai.Photoresponsive liposomal nanohybrid cerasomes[J].Chemical Communications,2011,47:4751-4753.
[16] Yan Ma,Xiaolong Liang,Sheng Tong,et al.Gold Nanomicelles for potential magnetic resonance imaging,light-triggered drug release and photothermal therapy[J].Advanced Functional Materials,2013,23(7):815-822.
150001 哈尔滨,哈尔滨医科大学附属第一医院(康传哲,马满玲);黑龙江省齐齐哈尔市中医医院药剂科(何 伊)
马满玲,E-mail:mamanling@126.com
R 966
A
1004-0188(2014)02-0226-03
10.3969/j.issn.1004-0188.2014.02.049
2013-09-25)

