一种从血浆及血清中提取循环microRNA的方法
宁启兰,高 宁,2,张 蕊,3,田 稼,阎 融,吕社民,马 捷,4
(1. 西安交通大学医学部基础医学院生物化学与分子生物学系,陕西西安 710061;2. 西安交通大学医学部第二附属医院,陕西西安 710004;3. 西安交通大学医学部附属红会医院,陕西西安 710054;4. School of Medicine, University of California, San Diego, CA 92093, USA)
◇技术方法研究◇
一种从血浆及血清中提取循环microRNA的方法
宁启兰1,高 宁1,2,张 蕊1,3,田 稼1,阎 融1,吕社民1,马 捷1,4
(1. 西安交通大学医学部基础医学院生物化学与分子生物学系,陕西西安 710061;2. 西安交通大学医学部第二附属医院,陕西西安 710004;3. 西安交通大学医学部附属红会医院,陕西西安 710054;4. School of Medicine, University of California, San Diego, CA 92093, USA)
目的 提取和检测血浆和血清中的循环microRNA(miRNA)分子。方法 使用TRI REAGENT®BD试剂盒提取血浆和血清中的总RNA分子后,运用非变性凝胶电泳方法进行检测。随后采用miRNA反转录试剂盒反转录miRNA的cDNA分子,并使用实时定量荧光PCR方法检测miRNA分子。结果 成功提取和检测到了血浆和血清中的总RNA,同时实时定量荧光PCR方法检测出血浆和血清中的循环miRNA分子。结论 成功提取和检测到血浆和血清中的循环miRNA,并可用于实时定量PCR实验,为进一步的miRNA的理论研究和临床应用奠定了一定的实验基础。
血浆;血清;循环microRNA
microRNA(miRNA)是一类大约包含22个核苷酸序列的内源性单链非编码RNA,可通过与靶基因mRNA 3′非编码区特异的碱基配对,负向调节靶基因的表达[1]。研究表明,miRNA在细胞增殖、分化、运动、信号传递、衰老和凋亡以及疾病的发生发展等过程中都发挥着重要作用[2-3]。在人类基因组中,已知大约有30%的基因受到miRNA的调节[4],同时,miRNA自身的表达具有细胞特异性和组织特异性[5]。
近期一些研究表明miRNA在血浆和血清中的表达比较稳定[6-8]。MITCHELL等[9]研究发现,这些循环miRNA来自于组织,在体内免受内源性RNA酶的作用,且在血浆和血清含量中非常稳定,可以作为疾病诊断的一个非侵入性的生物学标记。这为疾病诊断开辟了新的领域,在临床实践中具有重大作用和诊断价值。
由于总RNA在血浆和血清中的含量较低以及在体外相对不稳定的特点,影响了后续miRNA的相关研究工作。在此,本课题组经过反复实验、检测和比较分析,成功探索出提取血浆和血清中总RNA的技术方法,并在不同条件下采用实时荧光定量PCR的方法检验和分析miRNA的含量,从而为基于血液样本的循环miRNA的科研工作奠定了一定的技术基础。
1 材料与方法
1.1 实验样本 在西安交通大学医学部附属红会医院和第二附属医院检验科,随机选取健康志愿者外周静脉血液样本,并分离血浆和血清作为研究对象。样本的收集和研究工作得到西安交通大学医学部生物医学伦理委员会批准,所有研究对象均知情同意。
1.2 实验试剂和仪器 TRI REAGENT®BD(TB-126,MRC)试剂;miRNA反转录试剂盒One StepScript®miRNA cDNA Synthesis Kit(Perfect Real Time, TaKaRa);SYBR®Premix ExTaqTMⅡ(TaKaRa);5810R高速冷冻离心机(Eppendorf);凝胶成像系统(SYNGENE);iQ5实时定量荧光PCR仪(BIO-RAD, USA);miRNA上游引物由Invitrogen公司合成。
1.3 样本处理 随机选用4名健康志愿者的外周血样本,分离收集血浆后,分为3组。步骤如下:首先用EDTA试管收集健康志愿者外周血,放入4 ℃冰箱。2 h内在4 ℃ 3 000 r/min条件下离心10 min,收取上清血浆,每份200 μL分装入DEPC水处理过的离心管中。第一组样本即时提取总RNA;第二组样本放入-20 ℃冰箱保存2月后提取总RNA;第三组样本放入-80 ℃保存2月后提取总RNA。同时,考虑到临床检验科室收集血清样本的特点,另设立1份血清样本组,即:随机选取10份健康志愿者的血清样本,每份250 μL新鲜血清样本放入-20 ℃冰箱保存,2月 后进行总RNA的提取。
1.4 RNA提取 参照试剂盒说明书进行提取。加入0.2 mL的血浆或0.25 mL的血清于0.75 mL TRI BD溶液中,加入5 mol/L乙酸20 μL,混匀。在室温下放置裂解5 min。加入0.2 mL三氯甲烷,震荡后在4 ℃条件下12 000 r/min离心15 min。将水相转移入一新EP管,加入0.5 mL的异丙醇混合,沉淀过夜。最后在4 ℃条件下12 000 r/min离心8 min。移除液体,加入750 mL/L无水乙醇1 mL,使RNA沉淀悬浮。然后在4 ℃条件下12 000 r/min离心5 min。移除乙醇,在空气中干燥5 min,用适量DEPC水溶解总RNA。
1.5 琼脂糖凝胶电泳检测总RNA 制胶的模具、电泳槽及电泳所用梳子等用具均用30 mL的过氧化氢溶液浸泡5~10 min,然后用DEPC水冲洗,室温晾干。使用DEPC水配制电泳缓冲液TAE及其他溶液。用DEPC配制的0.5×TAE配制10 g/L琼脂糖凝胶,溴化乙锭(EB)直接加入凝胶。加入2 μL总RNA,0.4 μL 6×上样缓冲液,以5 V/cm的电压持续电泳30 min后,在凝胶成像系统中观测并拍照。
1.6 反转录cDNA 用试剂盒法进行反转,试剂盒中带有进行下一步实时定量荧光PCR反应的通用下游引物[10]。10 μL 2×miRNA Reaction Buffer Mix, 2 μL 1 g/L BSA,2 μL miRNA PrimerScript®RT Enzyme Mix, 6 μL总RNA。反应条件为37 ℃保温60 min后,85 ℃持续5 s。
1.7 实时定量荧光PCR方法检测血浆和血清中miRNA的含量 根据文献[11]报道,选取在健康志愿者外周血血浆中表达量较高以及几乎不表达的几个miRNA进行验证比较。选取的3个表达量较高的miRNA分别是miR-16、miR-21、miR-451[9,11];2个几乎不表达的miRNA为miR-208、miR-499[11-12]。进行实时定量荧光PCR的上游引物如表1所示。反应体系为:5 μL SYBR®Premix ExTaqTMⅡ,0.5 μL上游引物(浓度为10 μmol/L),0.5 μL反转录试剂盒所带的下游共同引物(10 μmol/L),0.2 μL cDNA,加双蒸水至总反应体系为10 μL。每份样品均重复做2次。反应条件为:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 45 s,共40个循环。
表1 miRNA的引物序列
Tab.1 Primer sequence of miRNAs

miRNA编号引物序列(5'-3')has-miR-16MIMAT0000069TAGCAGCACGTAAATATTGGCGhas-miR-21MIMAT0000076TAGCTTATCAGACTGATGTTGAhas-miR-451MIMAT0001631AAACCGTTACCATTACTGAGTThas-miR-499MIMAT0002870TTAAGACTTGCAGTGATGTTThas-miR-208MIMAT0026474GAGCTTTTGGCCCGGGTTATAC
2 结 果
2.1 血浆和血清总RNA非变性琼脂糖凝胶电泳结果 由于健康志愿者外周血血浆和血清中总RNA的含量较少,且只含有片段较小的RNA,因此在电泳时,第一组即时抽提的样本组显示出1条电泳条带,加入异丙醇后分别在―20 ℃沉淀2 h和过夜后均可以观察到RNA电泳条带(图1)。放入-20 ℃和放入―80 ℃冰箱保存2月后抽提的样本均未见电泳条带,血清样本组也未见电泳条带。
2.2 血清和血浆中循环miRNA实时定量荧光PCR结果 miR-16、miR-21和miR-451在得到血浆样本后即时抽提、―20 ℃保存2月后抽提、―80 ℃保存2月后抽提以及―20 ℃保存2月的血清样本中均显示扩增曲线平滑完好,熔解曲线具有单一的峰,表明相应miRNA确实存在,且扩增片段特异性好。图2显示了miR-16的扩增曲线和熔解曲线。而miR-499和miR-208在4组样本中扩增曲线杂乱,在35个循环后出现曲线且没有正常的平台期,熔解曲线杂乱而多峰,表明未能检测到目的miRNA。图3显示了miR-499的扩增曲线和熔解曲线。
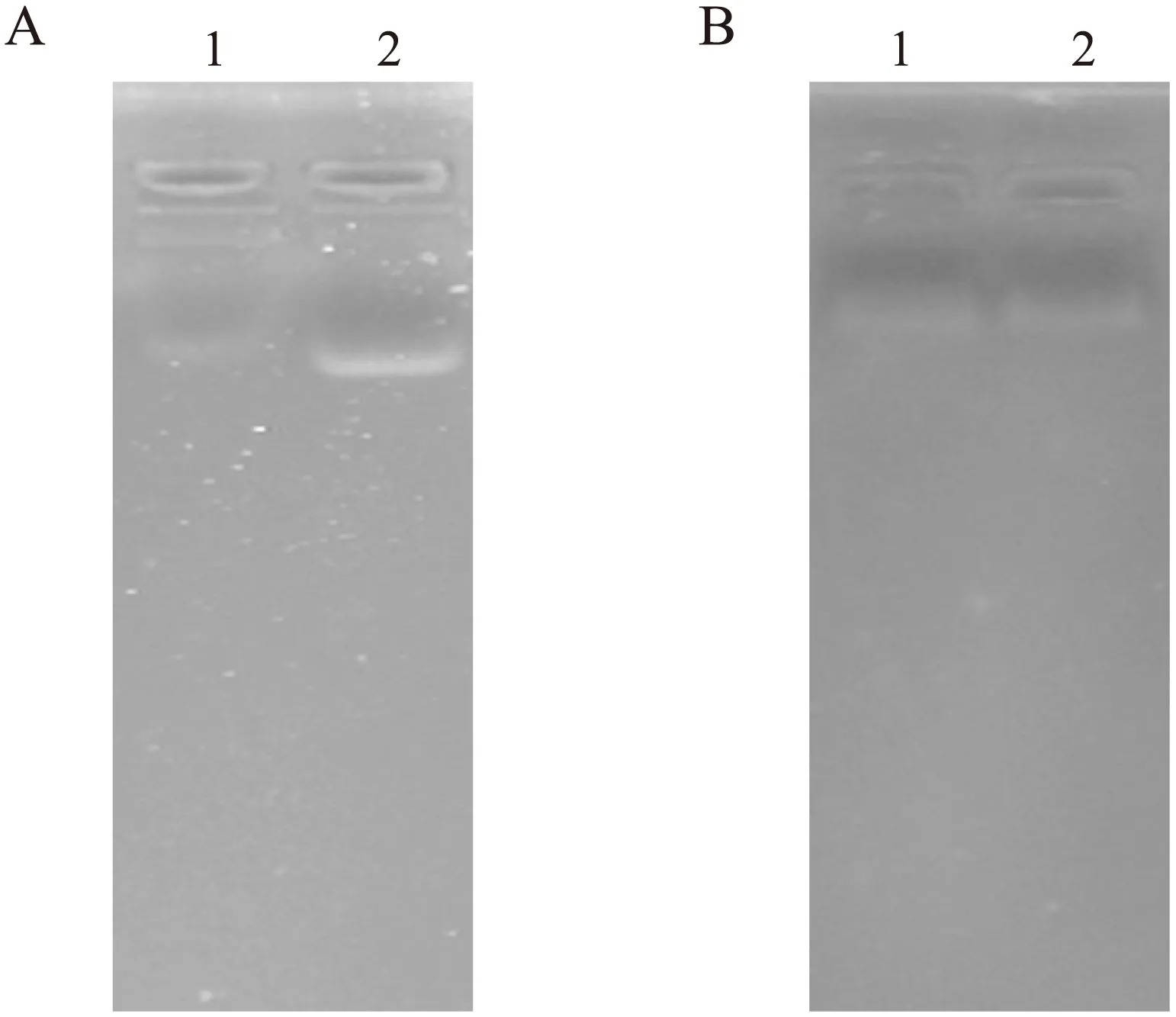
图1 血浆中总RNA的10 g/L 非变性琼脂糖凝胶电泳图
Fig.1 10 g/L non-denatured agarose electrophoresis of the total RNA in plasma
A:加入异丙醇后―20 ℃沉淀2 h;B:加入异丙醇后―20 ℃沉淀过夜。1:健康志愿者1;2:健康志愿者2。
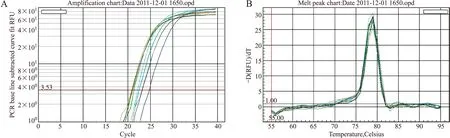
图2 健康志愿者血浆中miR-16的实时定量荧光PCR的扩增曲线(A)和熔解曲线(B)
Fig.2 The amplification curve (A) and melting curve (B) of miR-16 in healthy volunteers’ plasma

图3 健康志愿者血浆中miR-499的实时定量荧光PCR的扩增曲线(A)和熔解曲线(B)
Fig.3 The amplification curve (A) and melting curve (B) of miR-499 in healthy volunteers’ plasma
3 讨 论
血浆和血清中miRNA的相对稳定性及组织来源性使其有可能成为一个非侵入性临床诊断的重要潜在标记物,因此这些miRNA的检测成为关键的第一步。由于血浆和血清中总RNA含量较少且为一些小RNA分子,给RNA的提取和检测工作带来了困难。在前期工作中,本课题组采用经典的TRIzol®试剂和常规提取方法未能获得血浆和血清中的miRNA。经文献检索和多方查询,课题组新购置了TRI REAGENT®BD(TB-126,MRC)试剂,用其进行本实验,最终成功提取出了血浆和血清中的总RNA,并检测到了miRNA。
众所周知新鲜血浆中含有一些少量的总RNA,这些RNA用常规的非变性凝胶电泳方法就能检测到,但其电泳条带不同于全血中总RNA的条带。全血中有3条电泳条带,分别是28s、18s和5s的RNA,其中包含了mRNA分子、tRNA分子以及小RNA分子。而血浆和血清的RNA,主要来自于组织中释放入血液的RNA分子,因此是少量一些容易渗透的小RNA分子。这些小RNA分子在电泳时显示为单一条带。
同时,在―20 ℃和―80 ℃保存2个月的血浆样品和―20 ℃保存2个月的血清样品,由于RNA酶的降解作用,使得总RNA的含量极少,因此用常规的电泳方法未能检测到条带,而实时定量PCR方法能够很好检测到这些长期保存样本中特定miRNA的表达状态,具备更好的灵敏度。本实验中实时定量PCR的检测结果显示,miRNA在不同保存状态的处理组中,持续存在且相对稳定。
在实际临床工作中,获得患者的血清样本后常放入―20 ℃保存。本实验为紧密联系临床需要,单独设立了―20 ℃保存的血清组,并进行了总RNA的提取和miRNA的检测工作。用实时定量PCR方法检测血清中miRNA的含量,最终得到了与相同条件下血浆样本一致的实验分析结果。
本研究选择本课题组已经报道过的在健康志愿者血浆和血清中含量较多的miR-16、miR-21、miR-451[9,11]进行实时定量PCR检测,在得到血浆样本后即时抽提、―20 ℃保存2月时抽提、―80 ℃保存2月时抽提以及血清―20 ℃长期保存的4组样本中均显示扩增曲线平滑完好,熔解曲线图形表明扩增片段特异,且含量较多。miR-499和miR-208本身在健康志愿者的血浆中几乎检测不到,而报道称其在急性心肌梗死患者中含量较高,因此可作为该病的早期诊断的重要分子标记[12-13]。本实验在健康志愿者血浆和血清中用实时定量PCR方法进行检测,发现这两种miRNA在3种条件下的处理组中的扩增曲线和熔解曲线均杂乱,且扩增反应循环数均超过35,表明这两种miRNA在健康人血浆和血清中的含量过低,且难以检测。综上所述,虽然血浆和血清中的总RNA在低温存放过程中会有所损失,但是其中循环miRNA的含量依然相对较为稳定。
总之,本实验初步摸索出了提取血浆和血清中的miRNA的方法,并且通过miR-16的实时定量荧光PCR的扩增曲线和熔解曲线的一致性,验证了在不同存贮条件下血浆和血清中的miRNA含量相对稳定。提示可通过检测miRNA以反映组织中miRNA的异常变化,从而为临床诊断、功能调控以及疾病的治疗各方面提供线索和依据。
[1] BARTEL DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[2] MA L, TERUYA-FELDSTEIN J, WEINBERG RA. Tumour invasion and metastasis initiated by microRNA-10b in breast cancer[J]. Nature, 2007, 449(7163):682-688.
[3] THUM T, GROSS C, FIEDLER J, et al. MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J]. Nature, 2008, 456(7224):980-984.
[4] LEWIS BP, BURGE CB, BARTEL DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1):15-20.
[5] KLOOSTERMAN WP, PLASTERK RH. The diverse functions of microRNAs in animal development and disease[J]. Dev Cell, 2006, 11(4):441-450.
[6] CALIN GA, CROCE CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6(11):857-866.
[7] CHEN X, BA Y, MA L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18(10):997-1006.
[8] FILIPOWICZ W, BHATTACHARYYA SN, SONENBERG N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?[J]. Nat Rev Genet, 2008, 9(2):102-114.
[9] MITCHELL PS, PARKIN RK, KROH EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci U S A, 2008, 105(30):10513-10518.
[10] 闵自信,杜小云,宁启兰,等. 两种实时定量RT-PCR方法检测miRNAs表达的技术分析[J]. 西安交通大学学报:医学版, 2013, 34 (2): 258-262.
[11] WANG GK, ZHU JQ, ZHANG JT, et al. Circulating microRNA: a novel potential biomarker for early diagnosis of acute myocardial infarction in humans[J]. Eur Heart J, 2010, 31(6):659-666.
[12] ADACHI T, NAKANISHI M, OTSUKA Y, et al. Plasma microRNA 499 as a biomarker of acute myocardial infarction[J]. Clin Chem, 2010, 56(7):1183-1185.
[13] 韩燕,朱文华,何晓静,等. 小反应体积实时定量PCR的可行性评价[J]. 西安交通大学学报:医学版, 2010, 31(2):177-179.
(编辑 国 荣)
Experimental technique of extracting circulating microRNA from the plasma and serum
NING Qi-lan1, GAO Ning1,2, ZHANG Rui1,3, TIAN Jia1, YAN Rong1, LÜ She-min1, MA Jie1,4
(1. Department of Biochemistry and Molecular Biology, Medical School of Xi’an JiaotongUniversity, Xi’an 710061; 2. the Second Affiliated Hospital, Medical School of Xi’anJiaotong University, Xi’an 710004; 3. Xi’an Honghui Hospital, Xi’an 710054;4. School of Medicine, University of California at San Diego, CA 92093, USA)
Objective To extract and test circulating microRNA(miRNA) in the plasma and serum. Methods We utilized TRI REAGENT®BD to extract the total RNA in the plasma and serum, and the RNA was determined by electrophoresis in 10 g/L non-denatured agarose gel. The miRNA cDNA Synthesis Kit was used to reverse the cDNA molecular of miRNA, which was then tested by the real-time PCR method. Results We successfully extracted and tested the total RNA in the plasma and serum. The miRNA in plasma and serum was tested by the reverse transcription and real-time PCR method. Conclusion These results suggest that we have successfully extracted and tested the miRNA in the plasma and serum, which can be used for real-time PCR experiments. This has laid some experimental foundation for further clinical application and theoretical research of miRNA.
plasma; serum; circulating microRNA
2013-12-13
2014-03-12
国家自然科学基金资助项目(No.31371298,81301151);陕西省国际合作重点项目(No.2013KW25-02);教育部“新世纪优秀人才支持计划”资助项目(NCET-13-0452) Supported by the National Natural Science Foundation of China (No.31371298, 81301151), the Key Project of International Scientific Cooperation of Shaanxi Province (No.2013KW25-02), and the Program for New-Century University Excellent Talents Program of Ministry of Education (NCET-13-0452)
马捷,副教授,博士,硕士生导师. E-mail: majie@mail.xjtu.edu.cn; jim013@mail.ucsd.edu
宁启兰(1967-),女(汉族),实验师,学士,从事医学分子生物学研究. E-mail: nqlan@mail.xjtu.edu.cn
时间:2014-09-16 11∶32 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140916.1132.004.html
R34
A
10.7652/jdyxb201406024

