丘脑前核在三叉神经电刺激减轻癫痫发作和海马神经元损伤中的作用*
王先红, 田苗苗, 潘晴晴, 鲁亚楠, 王 玉
(安徽医科大学第一附属医院神经内科,安徽 合肥 230022)
·短篇论著·
丘脑前核在三叉神经电刺激减轻癫痫发作和海马神经元损伤中的作用*
王先红, 田苗苗, 潘晴晴, 鲁亚楠, 王 玉△
(安徽医科大学第一附属医院神经内科,安徽 合肥 230022)
目的: 探讨丘脑前核在三叉神经电刺激(TNS)减轻癫痫发作和海马神经元损伤中的作用。方法:大鼠经腹腔注射匹罗卡品建立慢性癫痫模型,模型大鼠分别给予假刺激、三叉神经电刺激和立体定向毁损丘脑前核预处理后三叉神经电刺激1月,再次诱导癫痫发作,观察大鼠的癫痫行为表现,并通过TUNEL、Fluoro-Jade B (FJB)染色和Nissl染色观察大鼠海马CA1区神经元的凋亡、变性及脱失情况。结果:与未经毁损丘脑前核的TNS处理大鼠相比,毁损丘脑前核后的TNS处理大鼠癫痫发作的级别分数及持续时间明显增加(P<0.05),且毁损丘脑前核后的TNS处理大鼠癫痫发作后海马CA1区TUNEL、FJB阳性细胞及细胞的脱失较TNS组显著增加(P<0.01)。结论:毁损丘脑前核后,TNS减轻癫痫发作及海马神经元损伤的作用被显著降低,表明丘脑前核在TNS抗癫痫中发挥一定的作用;潜在机制可能是TNS通过丘脑前核慢性激活丘脑与大脑皮层的纤维联系,使海马神经元兴奋性易感性改变。
癫痫; 三叉神经电刺激; 神经保护作用; 立体定向毁损; 丘脑前核
癫痫是临床常见的神经系统疾病,发病率约为0.6%,尽管新一代抗癫痫药及先进外科手术的采用使大部分的癫痫患者的病情得到控制,仍有约30%的患者转化为难治性癫痫[1]。最近的研究报道,三叉神经电刺激(trigeminal nerve electrostimulation,TNS)可能为难治性癫痫患者带来新的治疗效果,初步的临床及实验研究成果表明它有抗癫痫作用[2-4]。我们前期的研究也进一步证实了这一作用[5],并发现其潜在的神经保护作用[6]及减轻海马炎症反应的作用[7]。目前尚未有关于TNS抗癫痫作用的神经传导机制的研究报道。有大量的研究表明丘脑前核(anterior thalamic nucleus, ATN)的电活动参与癫痫放电的调节,因此丘脑前核也成了脑深部电刺激(deep brain stimulation,DBS)的重要靶向部位[8]。三叉神经感觉传导与丘脑前核之间有着密切的解剖联系,因此我们推测TNS抗癫痫及神经保护作用可能与丘脑前核相关。本实验在慢性癫痫模型基础上予以人为诱发一次癫痫发作[9-10],并通过立体定向毁损丘脑前核核团观察丘脑前核在TNS抗癫痫中的作用。
材 料 和 方 法
1 实验动物、主要试剂和设备
雄性SD大鼠95只,体重180~220 g,由安徽医科大学实验动物中心提供。饲养于安静、避光的环境中,给予全价营养饲料及水。
匹罗卡品(pilocarpine, Pilo)及东莨菪碱购于Sigma;鹅膏蕈氨酸(ibotenic acid)购于Tocris;尼氏染液购于碧云天;TUNEL试剂盒购于南京凯基;Fluoro-Jade B (FJB)购于Millipore。经皮电刺激仪(KD-2A型)购于北京博洋生物器械有限公司;立体定向毁损仪购于深圳市瑞沃德生命科技有限公司。
2 方法
2.1 动物癫痫模型的制作 95只健康雄性SD大鼠进行随机分组,其中正常对照组20只,实验组75只。实验组大鼠腹腔注射东莨菪碱1 mg/kg以拮抗外周胆碱反应,30 min后,腹腔注射新鲜配制的匹罗卡品380 mg/kg,每30 min追加30 mg/kg,达到癫痫持续状态。15 min后观察大鼠行为,癫痫发作严重程度参照Racine Ⅴ级评价标准[9]:Ⅰ级:出现面部抽搐,鼻毛抽动,前爪抓耳及咀嚼动作;Ⅱ级:出现点头运动,一侧前肢阵挛;Ⅲ级:出现肢阵挛和轻微的身体抽搐;Ⅳ级:肢体阵挛,甩尾,牙关紧闭,全身抽搐;Ⅴ级:全身阵挛,失去平衡跌倒并全身僵直。Ⅲ级或Ⅲ级以上行为重复出现者界定为癫痫发作。癫痫发作后30 min,腹腔注射地西泮(10 mg/kg)终止发作。应用视频监视大鼠1个月,观察其自发性癫痫发作情况,确定具有自发反复性发作的慢性癫痫大鼠。实验组慢性癫痫大鼠随机分为Pilo组(n=25)、TNS组(n=25)和ATN组(n=25),实验中有6只大鼠死亡则予以相应的处理后增补。
2.2 立体定向核团毁损 慢性癫痫大鼠腹腔注射10%水合氯醛(350 mg/kg)进行术前麻醉,固定于立体定向毁损仪,用牙钻分别在颅骨上打洞,根据Pa-xinos and Watson 大鼠脑立体定向图谱,两侧丘脑前核坐标为AP:-1.5 mm; L:1.0 mm或-1.0 mm; DV:6.0 mm[11-12],ATN组立体定向微量注射10 μL/kg鹅膏蕈氨酸磷酸盐缓冲液0.25 μL[13-14],TNS组和Pilo组则立体定向注射磷酸盐缓冲液0.25 μL。缓慢匀速注射后留针5 min,缓慢拔出。术后大鼠腹腔注射青霉素抗感染,自由获取食水,待1周左右恢复。
2.3 三叉神经电刺激 大鼠恢复后,分别对ATN组和TNS组大鼠进行TNS 1个月。操作前大鼠腹腔注射10%水合氯醛(350 mg/kg)麻醉动物 ,大鼠俯卧固定,将2个模式电极对称外置于眼眶上方约1 cm中内1/3处的三叉神经眼支分布区域,固定后外接经皮神经电刺激仪。刺激参数:频率140 Hz、电流10 mA、脉宽0.5 ms、正向脉冲刺激1 min间歇4 min,每天连续刺激60 min[5]。Pilo组大鼠固定后,外接电刺激仪,刺激参数均设置为0,持续60 min。各组操作均在8:00~12:00间进行。
2.4 动物取材 慢性癫痫模型再次腹腔注射匹罗卡品(350 mg/kg)诱导癫痫发作,分别用于癫痫行为观察和海马神经细胞受损及死亡的观察。癫痫发作后30 min腹腔注射地西泮(10 mg/kg)终止发作,于24 h、48 h、72 h、1周各时点每组各取5只大鼠断头取脑观察海马神经细胞受损及死亡情况;用于癫痫行为观察的大鼠(实验组每组各5只)则不予以地西泮终止发作。大鼠腹腔麻醉后固定,开胸暴露心脏,将针插入左心室心尖部,剪右心耳,0.9%氯化钠注射液100 mL快速灌注以冲净血液,再用4%多聚甲醛100 mL先快后慢灌注固定全身后断头取脑。根据Paxinos and Watson 大鼠脑立体定向图谱,分别取含有海马结构,含有丘脑前核的2~3 mm厚脑块(冠状切面)固定于多聚甲醛中,流水冲洗过夜后常规脱水、二甲苯透明、石蜡包埋,海马切片厚4 μm;丘脑前核冠状面连续切片4 μm,Nissl染色观察丘脑前核毁损部位。
2.5 Nissl染色 石蜡切片常规脱蜡至水,滴加尼氏染液(有效成分焦油紫)置于37 ℃温箱中反应20 min,蒸馏水冲洗后梯度乙醇脱水,二甲苯透明,中性树胶封片。
2.6 TUNEL实验检测细胞凋亡 石蜡切片常规脱蜡至水,按照试剂盒说明书行TUNEL染色。 染色后凋亡细胞呈棕黄色至黄色,阴性细胞核蓝色。并做对照实验,阴性对照滴加PBS,代替TdT酶反应液,应无阳性细胞;阳性对照在TdT酶反应液前滴加DNase I处理切片,应全为阳性细胞。
2.7 FJB染色 石蜡切片常规脱蜡至水,浸入1% NaOH和80%乙醇混合液5 min,蒸馏水中2 min,再浸入0.06%高锰酸钾溶液20 min(室温,摇床)后蒸馏水漂洗2 min,再浸入0.0004%的FJB染液中避光反应30 min后蒸馏水漂洗3 min,自然晾干、二甲苯透明后,中性树胶封片。在荧光显微镜下采用蓝色滤色片(激发光波长为450~490 nm)观察并采集图像。
3 统计学处理
根据解剖学定位,每只大鼠取5张非连续的一侧海马切片进行分析,并保证这些脑片的断面水平
在各鼠均相似。400倍光镜下随机取5个视野观察大鼠海马CA1区TUNEL、FJB、Nissl阳性细胞数。用SPSS 16.0软件对数据进行统计处理,计量资料用均数±标准差(mean±SD)表示,多样本间均数比较采用单因素方差分析(One-way ANOVA),组间两两比较用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 丘脑前核毁损结果
ATN组可见大鼠丘脑前核核团细胞形态紊乱,结构消失,符合化学毁损的特点,见图1。
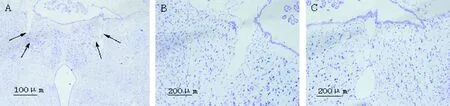
Figure 1.Nissl-stained sections of anterior thalamic nucleus (ATN) region of ATN group. The arrows in figure A mean ATN regions of figure B and C.
图1 ATN组大鼠丘脑前核的Nissl染色结果
2 各组大鼠癫痫发作的比较
正常对照(control)组大鼠无癫痫发作。实验组大鼠再次诱导癫痫发作,TNS组大鼠癫痫发作等级分数、持续时间均较Pilo组有明显减少,而ATN组大鼠发作等级分数、持续时间均较TNS组明显增多,见表1。
表1 各组大鼠癫痫发作等级分数和持续时间的比较
Table 1.Severity and duration of seizures among Pilo group, TNS group and ATN group (Mean±SD.n=5)

GroupSeizurescoreSeizureduration(min)Pilo3.13±0.7223.63±3.24TNS1.88±0.96*10.63±3.68*ATN2.75±0.68#14.56±2.56#
TableP<0.05vsPilo group;#P<0.05vsTNS group.
3 海马CA1区神经元TUNEL的表达
正常对照组未见TUNEL阳性细胞,大鼠海马CA1区见蓝染的锥体细胞,排列紧密,细胞核完整;Pilo组各时点海马CA1区可见TUNEL阳性细胞,锥体细胞凋亡,胞核固缩呈圆形或不规则形,核棕黄色或黄色,72 h达到高峰,1周后略有下降;TNS组TUNEL阳性细胞较Pilo组明显减少;72 h ATN组TUNEL阳性细胞数较TNS组明显增多,见图2、3。
4 海马CA1区神经元FJB 染色结果
正常对照组未见FJB阳性细胞;Pilo组各时点海马CA1区可见FJB阳性细胞,锥体细胞排列紊乱,胞体和部分突起呈亮黄绿色,72 h达到高峰,1周略有下降;TNS组FJB阳性细胞较Pilo组明显减少;72 h ATN组FJB阳性细胞数较TNS组明显增多,见图4、5。
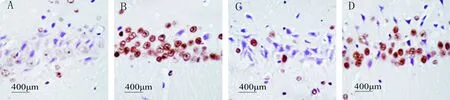
Figure 2.The expression of TUNEL(+) cells 72 h after seizures. A: control group; B: Pilo group; C: TNS group; D:ATN group.
图2 各组大鼠癫痫发作后72 h 海马CA1区TUNEL阳性细胞的表达
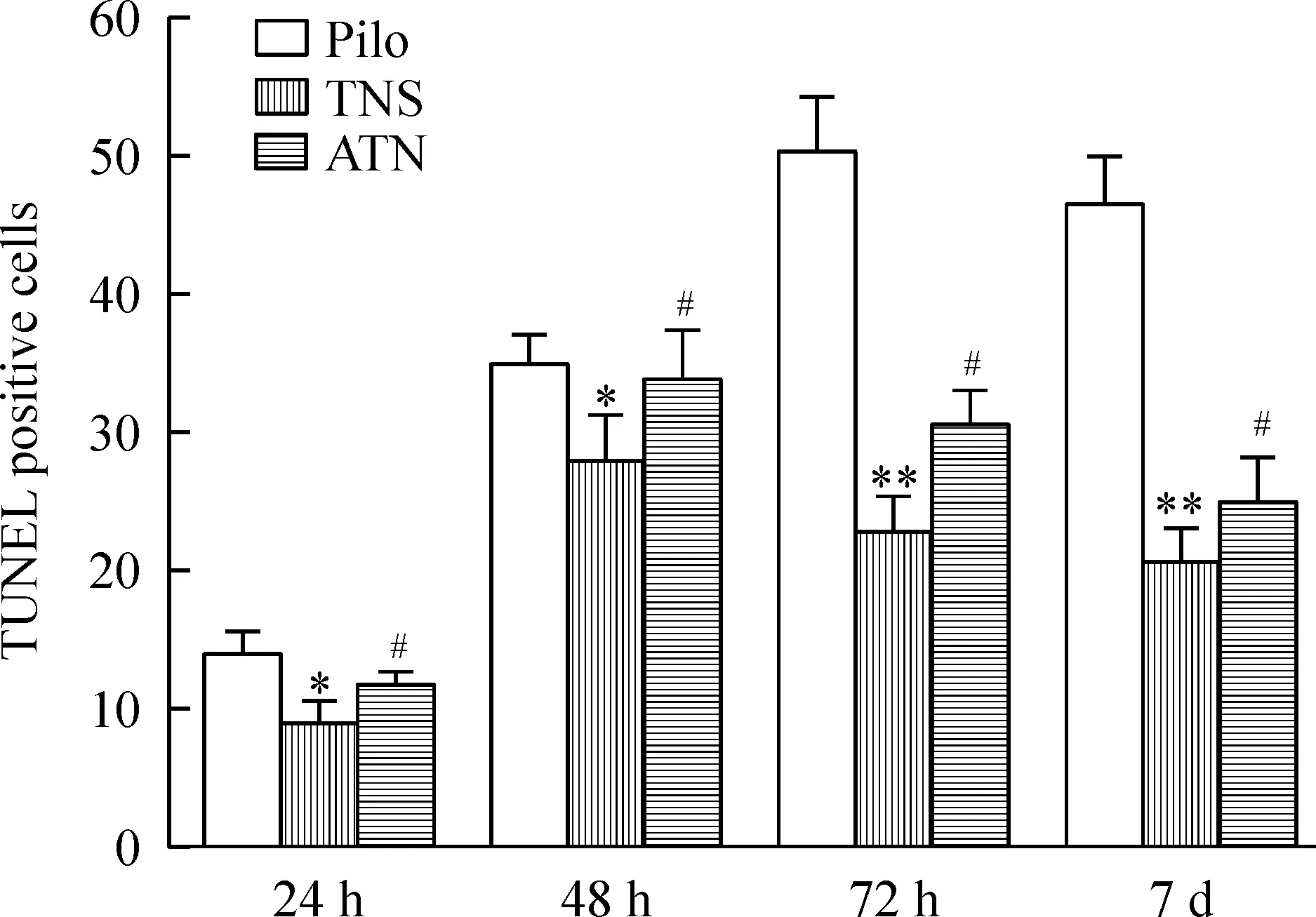
Figure 3.Comparison of the number of TUNEL (+) cells in hippocampal CA1 area at different time points among Pilo group, TNS group and ATN group. Mean±SD.n=5.*P<0.05,**P<0.01vsPilo group;#P<0.05vsTNS group.
图3 不同时点海马CA1区TUNEL阳性细胞数的比较
5 海马CA1区神经元Nissl染色结果
正常对照组大鼠海马CA1区见大量锥体细胞,排列整齐,细胞形态完整,胞浆内含有丰富的尼氏小体;再次诱导癫痫发作72 h后Pilo组锥体细胞大量脱失,排列紊乱,细胞肿胀变形,胞浆内尼氏小体减少;TNS组存活的神经元较Pilo组明显增多;ATN组则较TNS组明显减少,见图6。Control组海马CA1区神经元数目为84.0±4.0,Pilo组为27.0±1.6,TNS组为62.2±6.1,ATN组为41.2±6.8;Pilo组与TNS组比较、ATN组与TNS组比较差异均有统计学意义(P<0.01)。
讨 论
本实验中,TNS治疗组大鼠的癫痫发作严重程度及持续时间较Pilo组明显下降,大鼠海马CA1区神经元的凋亡、变性及脱失较Pilo组明显减轻。结果显示三叉神经慢性电刺激有抗癫痫作用,同时发现其对癫痫发作所致海马CA1区神经细胞损伤有重要的神经保护作用。
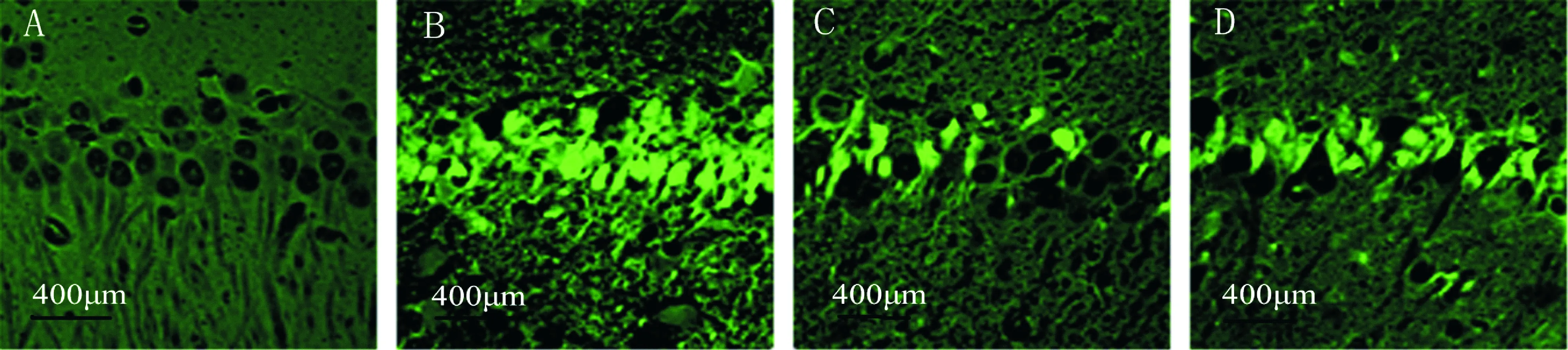
Figure 4.FJB-stained sections of hippocampal CA1 region 72 h after seizures. A: control group; B: Pilo group;C: TNS group; D: ATN group.
图4 各组大鼠癫痫发作后72 h 海马CA1区FJB的染色结果
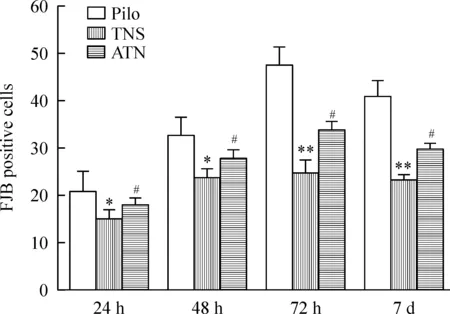
Figure 5.Comparison of the number of FJB(+) cells in hip-pocampal CA1 area at different time points among Pilo group, TNS group and ATN group. Mean±SD.n=5.*P<0.05,**P<0.01vsPilo group;#P<0.05vsTNS group.
图5 不同时点海马CA1区FJB阳性细胞数的比较
关于三叉神经电刺激的抗癫痫作用及其神经保护作用的机制尚未见有研究报道。基于三叉神经的解剖结构,三叉神经将头面部感觉信息传入至三叉神经感觉核,并将触觉、痛觉信息传入丘脑,还有一部分则传入至临近脑干的孤束核、蓝斑核。迷走神经电刺激的抗癫痫机制目前认为系通过激活孤束核和蓝斑核,而使大脑产生去同步化作用[15],因此有推测认为三叉神经的抗癫痫作用可能通过孤束核和蓝斑核发挥作用[16]。而本实验是在慢性癫痫模型中三叉神经慢性电刺激后观察的临床发作和脑损伤结果,因此不能用电刺激所致即刻的脑电去同步化来解释。本实验最重要的发现是部分毁损丘脑前核则降低了三叉神经慢性电刺激对癫痫发作的抑制作用及减轻脑损伤的保护作用,提示三叉神经慢性电刺激的抗癫痫作用至少与通过丘脑前核的冲动传导有关。近年来,已有大量的动物和临床研究表明丘脑前核电刺激具有抗癫痫作用[17-18]。这与我们的研究结果相一致,即TNS通过激活丘脑前核从而起到抗癫痫和神经保护作用。
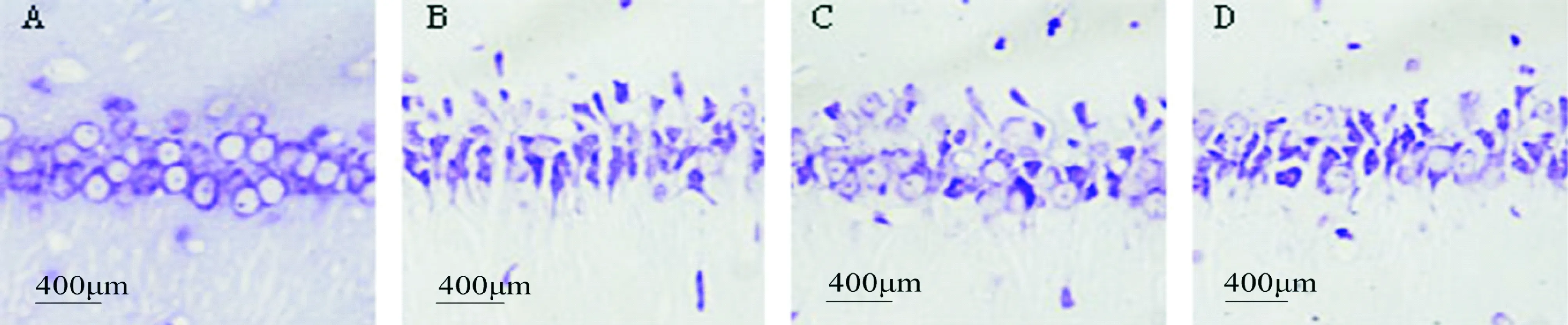
Figure 6.Nissl-stained sections of hippocampal CA1 region 72 h after seizures. A: control group; B: Pilo group; C: TNS group; D: ATN group.
图6 各组大鼠癫痫发作后72 h 海马CA1区神经元Nissl染色结果
丘脑前核与大脑皮层联系广泛。有研究报道,丘脑前核电刺激通过丘脑前核与大脑皮层的纤维联系使大脑扣带回、岛叶、顶叶后部皮层和颞叶皮层等区域皮层神经细胞得到激活[8, 19]。较低强度的丘脑前核电刺激对癫痫发作起抑制作用,而较强的丘脑前核电刺激则对癫痫发作起促进作用[20],表明通过丘脑前核的电刺激进行慢性惊厥阈值下的皮层激活可改变皮层的兴奋性易感性,即提高了癫痫发作阈值,从而减少自发性癫痫反复发作。因此我们认为在本实验模型中,三叉神经电刺激通过不断激活丘脑前核皮层环路,导致皮层的慢性癫痫发作阈下性激活,从而降低了皮层的兴奋性。这与既往报道的慢性阻断谷氨酸受体可诱导自发性痫性放电的结果相一致[21-22],同时也与文献报道的丘脑前核毁损干扰到脑皮层突触可塑性形成的结果相一致[23-24]。
综上,丘脑前核在TNS抗癫痫中发挥一定的作用,其潜在的机制可能与TNS激活丘脑前核与大脑皮层的神经环路有关。但丘脑前核与三叉神经作用的确切机制仍不明确,有待进一步研究。
[1] Schuele SU, Luders HO. Intractable epilepsy: management and therapeutic alternatives[J]. Lancet Neurol, 2008, 7(6):514-524.
[2] DeGiorgio CM, Fanselow EE, Schrader LM, et al. Trigeminal nerve stimulation: seminal animal and human studies for epilepsy and depression[J]. Neurosurg Clin North Am, 2011, 22(4):449-456.
[3] DeGiorgio CM, Murray D, Markovic D, et al. Trigeminal nerve stimulation for epilepsy: long-term feasibility and efficacy[J]. Neurology, 2009, 72(10):936-938.
[4] Moseley BD, Degiorgio CM. Refractory status epilepticus treated with trigeminal nerve stimulation[J]. Epilepsy Res, 2014, 108(3):600-603.
[5] 张慧敏,李良勇,李家林,等. 经皮三叉神经电刺激预处理对戊四氮致痫大鼠海马谷氨酸脱羧酶表达的影响[J]. 安徽医科大学学报, 2011, 46(8):732-736.
[6] 左 健,贺慧艳,王倩倩,等. 三叉神经电刺激对慢性癫痫大鼠癫痫状态所致海马神经元损伤的保护作用观察[J]. 中华物理医学与康复杂志, 2014, 36(4):250-254.
[7] 刘益民,王倩倩,贺慧艳,等. 经皮三叉神经电刺激减轻戊四氮诱导的大鼠癫痫发作并抑制海马内 IL-1β 和 TNF-α 的表达[J]. 中国病理生理杂志, 2014, 30(2):323-327.
[8] Child ND, Benarroch EE. Anterior nucleus of the thalamus: functional organization and clinical implications[J]. Neurology, 2013, 81(21):1869-1876.
[9] Li LY, Li JL, Zhang HM, et al. TGFβ1 treatment reduces hippocampal damage, spontaneous recurrent seizures, and learning memory deficits in pilocarpine-treated rats[J]. J Mol Neurosci, 2013, 50(1):109-123.
[10]韩远远,刘益民,王 玉. 转化生长因子β1降低大鼠自发性癫痫发作并抑制胶质细胞活化[J]. 中国病理生理杂志, 2012, 28(12): 2266-2269,2282.
[11]López Hill X, Scorza MC. Role of the anterior thalamic nucleus in the motor hyperactivity induced by systemic MK-801 administration in rats[J]. Neuropharmacology, 2012, 62(7):2440-2446.
[12]Tomitaka S, Tomitaka M, Tolliver BK, et al. Bilateral blockade of NMDA receptors in anterior thalamus by dizocilpine (MK-801) injures pyramidal neurons in rat retrosplenial cortex[J]. Eur J Neurosci, 2000, 12(4):1420-1430.
[13]Aristieta A, Azkona G, Sagarduy A, et al. The role of the subthalamic nucleus in L-DOPA induced dyskinesia in 6-hydroxydopamine lesioned rats[J]. PLoS One, 2012, 7(8):e42652.
[14]Morera-Herreras T, Ruiz-Ortega JA, Gómez-Urquijo S, et al. Involvement of subthalamic nucleus in the stimulatory effect of Δ9-tetrahydrocannabinol on dopaminergic neurons[J]. Neuroscience, 2008, 151(3):817-823.
[15]Jaseja H. EEG-desynchronization as the major mechanism of anti-epileptic action of vagal nerve stimulation in patients with intractable seizures: clinical neurophysiological evidence[J]. Med Hypotheses, 2010, 74(5):855-856.
[16]Fanselow EE. Central mechanisms of cranial nerve stimulation for epilepsy[J]. Surg Neurol Int, 2012, 3(Suppl 4):S247-S254.
[17]Fisher R, Salanova V, Witt T, et al. Electrical stimulation of the anterior nucleus of thalamus for treatment of refractory epilepsy[J]. Epilepsia, 2010, 51(5):899-908.
[18]Lee KJ, Jang KS, Shon YM. Chronic deep brain stimulation of subthalamic and anterior thalamic nuclei for controlling refractory partial epilepsy[J]. Acta Neurochir Suppl, 2006, 99:87-91.
[19]Zumsteg D, Lozano AM, Wieser HG, et al. Cortical activation with deep brain stimulation of the anterior thalamus for epilepsy[J]. Clin Neurophysiol, 2006, 117(1):192-207.
[20]Covolan L, de Almeida AC, Amorim B, et al. Effects of anterior thalamic nucleus deep brain stimulation in chronic epileptic rats[J]. PLoS One, 2014, 9(6):e97618.
[21]Wang XM, Bausch SB. Effects of distinct classes ofN-methyl-D-aspartate receptor antagonists on seizures, axonal sprouting and neuronal lossinvitro: suppression by NR2B-selective antagonists[J]. Neuropharmacology, 2004, 47(7):1008-1020.
[22]He S, Shao LR, Wang Y, et al. Synaptic and extrasynaptic plasticity in glutamatergic circuits involving dentate granule cells following chronicN-methyl-D-aspartate receptor inhibition[J]. J Neurophysiol, 2013, 109(6):1535-1547.
[23]Dumont JR, Amin E, Poirier GL, et al. Anterior thalamic nuclei lesions in rats disrupt markers of neural plasticity in distal limbic brain regions[J]. Neuroscience, 2012, 224:81-101.
[24]Garden DL, Massey PV, Caruana DA, et al. Anterior thalamic lesions stop synaptic plasticity in retrosplenial cortex slices: expanding the pathology of diencephalic amnesia[J]. Brain, 2009, 132(Pt 7):1847-1857.
Role of anterior thalamic nucleus in trigeminal nerve electrostimulation-induced reduction of seizures and hippocampal damage
WANG Xian-hong, TIAN Miao-miao, PAN Qing-qing, LU Ya-nan, WANG Yu
(DepartmentofNeurology,TheFirstHospitalofAnhuiMedicalUniversity,Hefei230022,China.E-mail:yw4d@hotmail.com)
AIM: To investigate the role of anterior thalamic nucleus in trigeminal nerve electrostimulation (TNS)-induced effects on seizures and hippocampal damage. METHODS: The rats were intraperitoneally injected with pilocarpine to induce chronic epilepsy, and then
sham treatment, TNS treatment and TNS treatment after stereotactic lesion to the anterior thalamic nucleus. The TNS treatment lasted for 1 month in each group. Another injection of pilo-carpine was conducted to induce seizures, and the severity and duration of seizures were quantitatively evaluated. TUNEL, Fluoro-Jade B (FJB) and Nissl staining were applied to determineinsituapoptosis, neuronal degeneration and neuron loss in the hippocampal CA1 area respectively. RESULTS: Compared with TNS group, TNS treatment after stereotactic lesion to the anterior thalamic nucleus significantly increased the severity and duration of seizures (P<0.05), and the numbers of TUNEL positive cells, FJB positive cells and lost neurons in the hippocampal CA1 area (P<0.01). CONCLUSION: Anterior thalamic nucleus plays a role in TNS-induced reduction of seizures and hippocampal damage. The mechanisms might be due to the chronically activation of the cortex through anterior thalamic nucleus pathway induced by TNS, resulting in the down-regulation of neuronal excitatory susceptibility.
Epilepsy; Trigeminal nerve electrostimulation; Neuroprotection; Stereotactic lesion; Anterior thalamic nucleus
1000- 4718(2014)12- 2249- 06
2014- 07- 18
2014- 10- 13
国家自然科学基金资助项目 (No. 81271444); 安徽省战略性新兴产业科技攻关项目(No. 11010402168)
R363
A
10.3969/j.issn.1000- 4718.2014.12.023
△通讯作者 Tel: 0551-62922665; E-mail: yw4d@hotmail.com

