晚期糖基化终产物通过mTORC1/uPAR途径促进足细胞移动*
谈晓凡, 陈源汉, 俞春萍, 赖宇雄, 张 丽, 赵星辰, 张 鸿, 林 婷, 李锐钊, 史 伟△
(1南方医科大学研究生学院,广东 广州 510515;2广东省人民医院肾内科,广东省医学科学院,广东 广州 510080)
晚期糖基化终产物通过mTORC1/uPAR途径促进足细胞移动*
谈晓凡1, 2, 陈源汉2, 俞春萍2, 赖宇雄2, 张 丽2, 赵星辰1, 2, 张 鸿2, 林 婷2, 李锐钊2, 史 伟2△
(1南方医科大学研究生学院,广东 广州 510515;2广东省人民医院肾内科,广东省医学科学院,广东 广州 510080)
目的: 足细胞哺乳动物雷帕霉素靶蛋白复合体1(mTORC1)活化是糖尿病肾病的重要发病机制。我们前期在db/db小鼠中观察到调控足细胞活动度的尿激酶型纤溶酶原激活物受体(uPAR)表达增加。本研究旨在研究晚期糖基化处理的牛血清白蛋白(AGE-BSA)对mTORC1、uPAR和足细胞活动度的影响并初步探索其可能的分子联系。方法: 体外培养小鼠肾小球足细胞,MTT法和免疫荧光分析各刺激物及干预剂对足细胞存活率及细胞骨架的影响。Western blotting检测正常对照组、对照BSA组及AGE-BSA处理组mTORC1的活性及uPAR的表达水平,划痕实验检测足细胞的活动度。进一步采用雷帕霉素抑制AGE-BSA组mTORC1的活性,观察uPAR和细胞活动性的改变。结果: 在预设浓度及干预时间下各刺激物及干预剂对细胞存活率及细胞骨架无明显影响。AGE-BSA 可上调足细胞mTORC1的活性和uPAR的水平,并促进足细胞移动。雷帕霉素能抑制AGE-BSA引起的uPAR表达水平的上调和细胞活动性的增强。结论: AGE-BSA 可能通过mTORC1/uPAR途径导致足细胞移动性增强。
足细胞; 细胞移动性; 晚期糖基化终产物; 哺乳动物雷帕霉素靶蛋白复合体1; 受体, 尿激酶型纤溶酶原激活物
糖尿病肾病是发达国家导致终末期肾病最常见的原因,中国近年的发病率也逐渐增加[1]。足细胞损伤是糖尿病肾病的重要致病原因,近年受到研究者的重视[2-3]。晚期糖基化终产物(advanced glycosylation end products,AGEs)是高浓度葡萄糖或其它还原性的单糖与蛋白质、脂质、核酸等在无酶参与的条件下形成的稳定共价合成物,是糖尿病的重要致病物质,其中以糖基化白蛋白的研究最多[4-5]。糖基化牛血清白蛋白(AGE-BSA)能通过AGE受体介导足细胞凋亡[6]。近年发现,在亚致死损伤条件下,足细胞活动性增加也是其致病的一个重要机制[7]。但是,AGEs对足细胞活动性的影响及详细的分子机制尚不完全清楚。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种丝氨酸/苏氨酸激酶,新近发现它是一个引起糖尿病肾病的重要致病分子[8-9]。哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1, mTORC1)在介导细胞生长和增殖方面发挥重要作用[10]。糖尿病肾病小鼠模型中足细胞内mTORC1活性显著增强;小鼠足细胞特异性高表达mTORC1可出现糖尿病肾病样的肾小球损伤[8-9]。最近发现mTORC1 在调节细胞的移动性方面发挥着重要作用[11-12]。本研究旨在明确AGEs能否通过mTORC1途径影响足细胞活动性,并探索AGEs通过mTORC1活性增强引起足细胞损伤的新机制。
材 料 和 方 法
1 主要仪器和试剂
二氧化碳培养箱(Thermo);SW-CJ-D1F型洁净工作台(苏州安泰空气技术有限公司);倒置相差显微镜、荧光显微镜和激光共聚焦显微镜(OLYMPUS);酶标仪(Molecular Devices);Mini-PROTEAN®3电泳系统(Bio-Rad)。
RPMI-1640(Corning);胎牛血清(FBS)、0.25%胰酶(Gibco);鼠尾胶原Ⅰ型(BD);γ干扰素(ProSpec);雷帕霉素、BSA和 D-葡萄糖(Sigma);P70S6K抗体、p-P70S6K抗体、驴抗羊Alexa Fluor 488抗体(Cell Signaling);尿激酶型纤溶酶原激活物受体(urokinase-type plasminogen activator receptor, uPAR)抗体和synaptopodin 抗体(Santa Cruz);GAPDH抗体(GOOD HERE);防荧光淬灭剂(Beyotime);MTT试剂盒(KeyGEN)。
2 AGE-BSA的制备
将40 g/L BSA与90 g/L葡萄糖溶于0.2 mol/L PBS,在无菌条件下37 ℃避光孵育90 d。孵育结束后用10倍体积的0.01 mol/L PBS充分透析以替换0.2 mol/L PBS及去除未结合的剩余葡萄糖;为了更充分地去除未结合葡萄糖,使用50 kD大小的超滤管过滤除去葡糖糖而截留浓缩AGE-BSA。浓缩的AGE-BSA使用0.01 mol/L PBS稀释并使用0.22 μm滤器过滤除菌,新制备的AGE-BSA采用BCA法测定其浓度。对照BSA(control BSA, co-BSA)不加高渗葡萄糖,其余处理同AGE-BSA制备。
3 足细胞的培养和实验分组
条件永生化足细胞系由美国J. Resier教授(Rush University Medical Center, Chicago, IL, USA)惠赠。细胞复苏后用含10% FBS的RPMI-1640和(20~100)×103U/L重组小鼠γ干扰素在5% CO2、33 ℃环境下诱导传代增殖。然后转入5% CO2、37 ℃培养箱,用不含重组小鼠γ干扰素的RPMI-1640加5% FBS在包被有Ⅰ型鼠尾胶原的培养皿中诱导分化。经8~12 d的培养诱导,足细胞进入分化阶段并最终分化成熟,细胞分化成熟后用足细胞特异性骨架蛋白synaptopodin染色阳性确定足细胞已分化成熟。本实验所有足细胞实验均在分化成熟后进行。
根据实验设计,分化成熟足细胞将分为(1)正常对照组(control):未加任何干预;(2)co-BSA对照组:co-BSA(100 mg/L)干预24 h;(3)AGE-BSA组:AGE-BSA(100 mg/L)干预24 h;(4)雷帕霉素组:10 nmol/L雷帕霉素干预24 h;(5)AGE-BSA+雷帕霉素组:AGE-BSA(100 mg/L)+10 nmol/L雷帕霉素干预24 h。
4 主要实验方法
4.1 MTT实验检测足细胞存活率 分化成熟的足细胞按100 μL/well(约5 000个细胞)接种到96孔板中,5% CO2、37 ℃孵育过夜。按照实验分组加入刺激物及干预剂,在培养箱内孵育24 h,加入50 μL MTT孵育4 h后,吸弃上清液,每孔加入150 μL二甲基亚砜(DMSO),室温振荡10 min用全自动酶标仪读取550 nm处吸光度(A)。细胞存活率(%)=检测孔的A值/对照孔的A值×100%。
4.2 免疫荧光激光共聚焦检测 将足细胞接种至预先用Ⅰ型鼠尾胶原包被的6孔板(含盖玻片)中,37 ℃分化成熟。按实验要求给予相关干预,干预结束后采用4%多聚甲醛固定15 min,之后PBS洗3次,每次5 min。5%牛血清白蛋白封闭1 h,PBS洗3次,每次5 min。I抗羊抗小鼠多克隆synaptopodin抗体(1∶80)4 ℃孵育过夜,PBS洗3次,每次5 min。之后操作均在避光环境下进行。荧光Ⅱ抗驴抗羊Alexa Fluor 488(1∶250)室温孵育1 h,PBS洗3次,每次15 min。加DAPI(1∶1 000)孵育5 min染核,PBS洗3次,每次10 min。采用抗荧光淬灭剂封片,激光扫描共聚焦显微镜下观察,所用图片均在400倍油镜下拍摄。
4.3 划痕实验检测足细胞移动性 将已分化成熟的足细胞按每孔1×108/L数量接种到6孔板,5% CO2、37 ℃孵育过夜。用1 mL无菌枪头末端刮除每孔盖玻片上的细胞,PBS轻轻洗涤1次后换上新鲜培养基,同时按实验分组进行处理24 h。处理结束后去上层培养液,PBS轻轻洗涤1次,4%多聚甲醛室温固定10 min,PBS洗3次,0.5% Triton X-100透化10 min,PBS洗3次。DAPI染色5 min显示细胞核,避光PBS洗3次后防荧光淬灭剂封片,置于荧光显微镜下观察,取同样大小方形视野计数并照像。
4.4 Western blotting检测 实验处理结束后用预冷的PBS洗3遍,加入含蛋白酶抑制剂的细胞裂解液在冰上裂解10 min,收获细胞总蛋白并定量。变性10 min后,取30~50 μg蛋白上样到10.5%分离胶进行电泳分离,然后以220 mA恒流湿转到PVDF膜上,5%脱脂奶粉室温封闭1 h,与待测目的蛋白的特异性抗体4 ℃孵育过夜,用相应Ⅱ抗室温孵育1 h后,使用ECL化学发光剂进行曝光。GAPDH作为内参照,图像分析系统扫描并定量分析胶片条带的灰度值,以目的条带与相应GAPDH的灰度值之比表示相关含量。每组实验重复3次。
5 统计学处理
数据以均数±标准差(mean±SD)表示,用统计软件SPSS 13.0进行统计学分析,组间比较用单因素方差分析(One-way ANOVA),采用LSD检验进行两组间比较。以P<0.05为差异有统计学意义。
结 果
1 各刺激物及干预剂对足细胞细胞活性及细胞骨架的影响
如图1A所示,co-BSA、AGE-BSA及雷帕霉素干预24 h后MTT实验结果显示足细胞的存活率分别为(108.67±18.58)%、(107.50±14.86)%和(98.67±10.26)%,与对照组相比均没有显著差异(P>0.05)。相同干预下,足细胞骨架同样未见明显改变,见图1B。由此可见,本实验设计可有效避免刺激物浓度过高产生的细胞毒性对实验结果的影响。

Figure 1.The effects of various stimuli and intervention agents on cell viability and cytoskeleton. A: the viability of podocytes treated with co-BSA (100 mg/L), AGE-BSA (100 mg/L) or rapamycin (10 nmol/L) for 24 h compared with control; B: representative confocal images of the cytoskeleton of the podocytes with different treatments (×400). Synaptopodin (green) was used to mark the cytoskeleton of the podocytes. Mean±SD.n=3.
图1 各刺激物及干预剂对足细胞活力及骨架的影响
2 AGE-BSA促进足细胞移动
与control和co-BSA组比较,AGE-BSA组能明显增强足细胞的移动度,见图2。
3 AGE-BSA上调细胞移动性关键调控分子uPAR
uPAR在介导足细胞移动性增强及足细胞损伤中有着重要作用[7]。本实验发现,与control和co-BSA组相比,AGE-BSA组的uPAR蛋白表达水平明显升高,见图3。
4 AGE-BSA上调足细胞mTORC1的活性
mTORC1促进下游靶分子P70S6K的磷酸化,检测P70S6K的磷酸化形式即p-P70S6K的水平可反映mTORC1活性。与control和co-BSA组相比,AGE-BSA组 p-P70S6K明显升高,表明AGE-BSA 可上调足细胞mTORC1活性水平,见图4。
5 AGE-BSA促进足细胞移动依赖mTORC1
雷帕霉素能降低AGE-BSA组足细胞的移动度和uPAR水平,见图5、6。
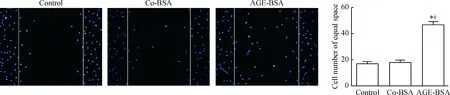
Figure 2.The effects of AGE-BSA on the motility of podocytes (DAPI staining,×100). Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA.
图2 AGE-BSA对足细胞运动的影响
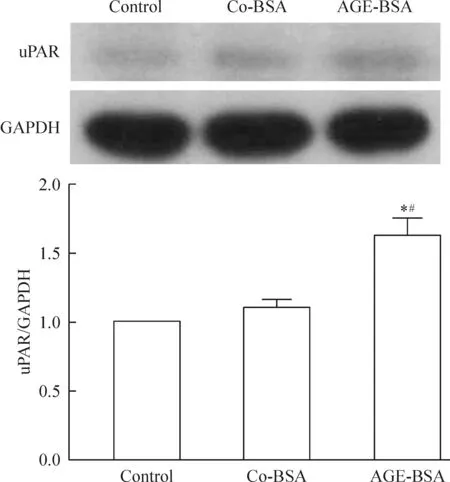
Figure 3.The effects of AGE-BSA on the expression level of uPAR. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA.
图3 AGE-BSA对uPAR表达水平的影响
讨 论
蛋白尿是糖尿病肾病的一个独立的危险因素,蛋白尿水平和持续时间是糖尿病肾病进展程度的一个重要临床指标。缓解蛋白尿水平的进展是肾病科临床医师治疗糖尿病肾病的重要策略。然而,目前仍缺乏针对糖尿病肾病的理想降蛋白尿药物,且糖尿病肾病相关蛋白尿的发病机制也不明确。因此,深入研究糖尿病肾病的致病机制并寻找到相关特异靶点是当前的极为紧迫的任务。大量研究提示足细胞损伤在介导糖尿病肾病蛋白尿中有着重要意义[2]。

Figure 4.The effects of AGE-BSA on the activity of mTORC1. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA.
图4 AGE-BSA对mTORC1下游分子P70S6K磷酸化的影响
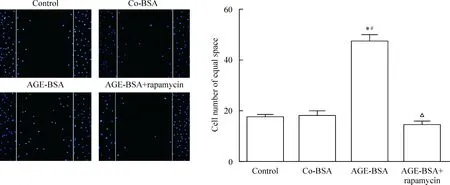
Figure 5.Rapamycin inhibited the increase in podoctye migration induced by AGE-BSA treatment (DAPI staining,×100). Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA;△P<0.05vsAGE-BSA.
图5 雷帕霉素抑制AGE-BSA导致的足细胞移动性增强
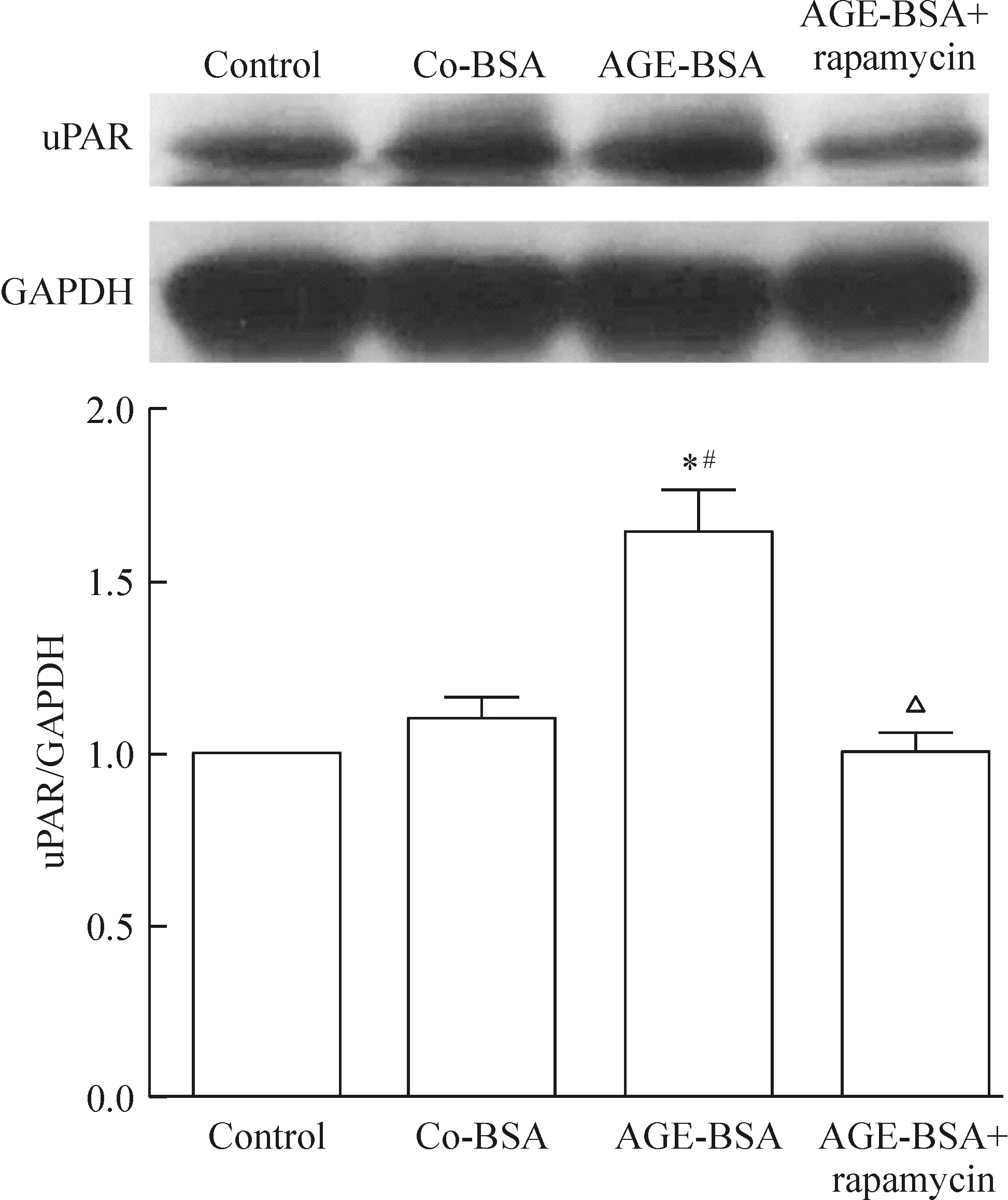
Figure 6.Rapamycin down-regulated the expression level of uPAR in the podocytes treated with AGE-BSA. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA;△P<0.05vsAGE-BSA.
图6 雷帕霉素下调AGE-BSA导致的足细胞uPAR表达水平增强
足细胞是特异分化的终末期细胞,位于肾小球基底膜外侧。正常足细胞具有一定程度的活动性以适应毛细血管袢跨壁压不同程度的变化。然而,足细胞活动性的增强却是足细胞的一个重要损伤因素,在体内会引起足细胞足突的融合甚至足细胞丢失导致蛋白尿,在体外表现为足细胞移动性的增强同足突融合有着相似的机理[13]。抑制损伤足细胞的活动度是公认的保护足细胞抑制蛋白尿的关键之一。
足细胞是通过整合素锚定在基底膜上,生理情况下足细胞表达高黏附性的β1整合素,以维持低水平的活动性以适应毛细血管袢跨壁压变化。在病理条件下低黏附性的β3整合素活化,足细胞的活动性增强,可引起肾小球通透性增加,导致蛋白尿,甚至引起足细胞丢失[13-14]。uPAR为一种糖基化磷脂酰肌醇锚定蛋白,能与整合素形成复合物并调控整合素,参与炎症、肿瘤侵袭和转移[15]。足细胞uPAR过度上调可活化β3整合素,导致细胞移动度增加,从而介导蛋白尿发生[7, 16]。我们最近在db/db糖尿病肾病小鼠中发现uPAR上调可能参与了糖尿病肾病的发生[17]。既往多数研究采用高水平葡萄糖作为研究处理因素。目前认为AGEs是糖尿病肾病的重要致病因子。本实验首次观察到AGE-BSA能上调uPAR并引起足细胞活动性增加,提示该途径可能是导致糖尿病条件下引起肾脏损伤的一个重要途径。
mTORC1是mTOR两种复合物中的一种,其活性可被雷帕霉素特异性抑制,主要参与细胞的生长和增殖,最新研究显示mTORC1可通过mTORC1-S6K1/4E-BP1信号通路调控RhoA、cdc42和Rac1等细胞骨架相关分子的表达及活性而参与调控细胞的移动性[11-12]。足细胞mTORC1在人和小鼠糖尿病肾病中发挥重要作用[8]。本研究中我们观察到AGE-BSA能促进足细胞mTORC1活化,提示糖尿病可能通过提高AGEs水平引起足细胞mTORC1活化而进一步引起肾损害。为更加深入地研究AGE-BSA介导足细胞移动性的增强与mTORC1及uPAR间的关系,本实验采用mTORC1的特异性抑制剂雷帕霉素来探讨mTORC1与足细胞移动性及uPAR的联系。我们在AGE-BSA干预的基础上给予雷帕霉素,结果显示用雷帕霉素抑制mTORC1后,经AGE-BSA刺激的足细胞的uPAR表达水平和细胞活动性都恢复到对照水平,表明AGE-BSA促进足细胞移动依赖mTORC1/uPAR途径。
本文结果提示AGE-BSA能通过mTORC1/uPAR途径促进足细胞移动,这可能是AGEs参与糖尿病肾病的一个潜在致病机制。这些初步结果值得进一步在动物实验中验证。
[1] Liu ZH. Nephrology in China[J]. Nat Rev Nephrol, 2013, 9(9):523-528.
[2] Rask-Madsen C, King GL. Diabetes: Podocytes lose their footing[J]. Nature, 2010, 468(7320):42-44.
[3] Reidy K, Kang HM, Hostetter T, et al. Molecular mechanisms of diabetic kidney disease[J]. J Clin Invest, 2014, 124(6):2333-2340.
[4] Wendt T, Tanji N, Guo J, et al. Glucose, glycation, and RAGE: implications for amplification of cellular dysfunction in diabetic nephropathy[J]. J Am Soc Nephrol, 2003, 14(5):1383-1395.
[5] 胡鹏飞,赖东武,何 红. 自噬在晚期糖基化终产物诱导的内皮细胞凋亡中的作用[J]. 中国病理生理杂志, 2012, 28(6):1006-1011.
[6] Zhou LL, Cao W, Xie C, et al. The receptor of advanced glycation end products plays a central role in advanced oxidation protein products-induced podocyte apoptosis[J]. Kidney Int, 2012, 82(7):759-770.
[7] Wei C, Moller CC, Altintas MM, et al. Modification of kidney barrier function by the urokinase receptor[J]. Nat Med, 2008, 14(1):55-63.
[8] Godel M, Hartleben B, Herbach N, et al. Role of mTOR in podocyte function and diabetic nephropathy in humans and mice[J]. J Clin Invest, 2011, 121(6):2197-2209.
[9] Inoki K, Mori H, Wang J, et al. mTORC1 activation in podocytes is a critical step in the development of diabetic nephropathy in mice[J]. J Clin Invest, 2011, 121(6):2181-2196.
[10]Wullschleger S, Loewith R, Hall MN. TOR signaling in growth and metabolism[J]. Cell, 2006, 124(3):471-484.
[11]Liu L, Luo Y, Chen L, et al. Rapamycin inhibits cytoskeleton reorganization and cell motility by suppressing RhoA expression and activity[J]. J Biol Chem, 2010, 285(49):38362-38373.
[12]Liu L, Li F, Cardelli JA, et al. Rapamycin inhibits cell motility by suppression of mTOR-mediated S6K1 and 4E-BP1 pathways[J]. Oncogene, 2006, 25(53):7029-7040.
[13]Reiser J, Oh J, Shirato I, et al. Podocyte migration du-ring nephrotic syndrome requires a coordinated interplay between cathepsin L and α3integrin[J]. J Biol Chem, 2004, 279(33):34827-34832.
[14]Zhang B, Xie S, Shi W, et al. Amiloride off-target effect inhibits podocyte urokinase receptor expression and reduces proteinuria[J]. Nephrol Dial Transplant, 2012, 27(5):1746-1755.
[15]Blasi F, Carmeliet P. uPAR: a versatile signalling orchestrator[J]. Nat Rev Mol Cell Biol, 2002, 3(12):932-943.
[16]Zhang B, Shi W, Ma J, et al. The calcineurin-NFAT pathway allows for urokinase receptor-mediated beta3 integrin signaling to cause podocyte injury[J]. J Mol Med (Berl), 2012, 90(12):1407-1420.
[17]Zhang L, Li R, Shi W, et al. NFAT2 inhibitor ameliorates diabetic nephropathy and podocyte injury indb/dbmice[J]. Br J Pharmacol, 2013, 170(2):426-439.
Advanced glycosylation end products promote migration of podocytes through mTORC1/uPAR pathway
TAN Xiao-fan1, 2, CHEN Yuan-han2, YU Chun-ping2, LAI Yu-xiong2, ZHANG Li2, ZHAO Xing-chen1, 2, ZHANG Hong2, LIN Ting2, LI Rui-zhao2, SHI Wei2
(1GraduateSchool,SouthernMedicalUniversity,Guangzhou510515,China;2DepartmentofNephrology,GuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Guangzhou510080,China.E-mail:weishi_gz@126.com)
AIM: To investigate the influence of advanced glycosylation end products-modified bovine serum albumin (AGE-BSA) on mammalian target of rapamycin complex 1 (mTORC1), urokinase-type plasminogen activator receptor (uPAR), and cell mobility in the podocytes, and to further explore the probable relationship. METHODS: The conditionally immortalized mouse podocyte cell line was culturedinvitro. MTT assay and immunofluorescence were used to analyze the cell viability and cytoskeleton of the podocytes treated with the stimuli and intervention agents. The activity of mTORC1 and the expression level of uPAR in normal podocytes and podocytes treated with control BSA or AGE-BSA were detected by Western blotting. The migration ability of the podocytes was determined by would-healing assay. Rapamycin was added to inhibit the activity of mTORC1 along with the addition of AGE-BSA to observe the changes of uPAR and the motility of podocytes. RESULTS: No significant difference of the cell viability or cytoskeleton in the podocytes treated with the stimuli and intervention agents was observed. AGE-BSA up-regulated the activity of mTORC1 and the expression of uPAR, and induced the high mobility of the podocytes. Rapamycin obviously reduced the high expression level of uPAR and the increase in the migration ability of podocytes caused by AGE-BSA treatment. CONCLUSION: AGE-BSA might cause the high migration of podocytes through the mTORC1/uPAR signaling pathway.
Podocytes; Cell mobility; Advanced glycosylation end products; Mammalian target of rapamycin complex 1; Receptors, urokinase-type plasminogen activator
1000- 4718(2014)12- 2232- 06
2014- 07- 09
2014- 10- 13
国家自然科学基金资助项目(No. 81270784);国家临床重点专科建设项目
R363
A
10.3969/j.issn.1000- 4718.2014.12.020
△通讯作者 Tel: 020-83850849; E-mail: weishi_gz@126.com
——雷帕霉素

