CB2受体激动剂JWH133对百草枯中毒致急性肺损伤大鼠的保护作用*
刘振宁, 韩 军, 郑 强, 赵 敏
(中国医科大学附属盛京医院急诊科,辽宁 沈阳 110004)
CB2受体激动剂JWH133对百草枯中毒致急性肺损伤大鼠的保护作用*
刘振宁, 韩 军, 郑 强, 赵 敏△
(中国医科大学附属盛京医院急诊科,辽宁 沈阳 110004)
目的: 研究大麻素CB2受体激动剂JWH133对百草枯中毒致急性肺损伤大鼠的保护作用。方法: 72只SD雄性大鼠随机平均分成4组。百草枯中毒组:按照20 mg/kg剂量腹腔注射;低剂量JWH133预处理组:在给予百草枯腹腔注射前1 h腹腔注射5 mg/kg JWH133;高剂量JWH133预处理组:在给予百草枯腹腔注射前1 h腹腔注射20 mg/kg JWH133;正常对照组:1 mL生理盐水腹腔注射。在注射百草枯后8 h、1 d和3 d时,收集动脉血、肺泡灌洗液和肺组织标本。采用血气分析仪测定动脉血氧分压(PaO2),采用ELISA方法检测支气管肺泡灌洗液中IL-1β和TNF-α含量,行组织切片HE染色进行肺损伤评分,利用Western blotting方法检测肺组织中NF-κB和AP-1 蛋白表达水平。结果: 与正常对照组相比,百草枯中毒组大鼠的动脉血PaO2明显下降,肺组织结构破坏,肺泡间质水肿,肺损伤指数增加,支气管肺泡灌洗液中炎性细胞因子IL-1β和TNF-α含量明显增加。JWH133预处理,尤其是高剂量JWH133可以减轻肺组织损伤程度,降低支气管肺泡灌洗液中IL-1β和TNF-α含量,减少肺组织中NF-κB和AP-1 蛋白的表达。结论: 应用CB2受体激动剂JWH133可以抑制百草枯中毒大鼠肺组织中NF-κB和AP-1 蛋白的表达,减少炎性细胞因子IL-1β和TNF-α的分泌,减轻百草枯中毒导致的急性肺损伤。
百草枯; 急性肺损伤; 大麻素CB2受体; 核因子κB; 激活蛋白1
百草枯(paraquat,PQ)是目前我国农业应用广泛的除草剂之一。在临床上,自杀性口服百草枯中毒患者较多,其病死率可达到60%~80%[1],成为致死性最高的农药中毒事件。百草枯化学结构与多胺结构十分相似,所以百草枯很容易被肺组织中的多胺摄取系统[2]所摄取,并通过氧化应激以及炎症反应损伤肺泡上皮细胞,破坏肺泡组织结构,炎性细胞浸润,急性期患者临床上表现为呼吸衰竭甚至多器官功能障碍[3]。
百草枯进入体内后,除了氧化应激反应以外,免疫细胞的激活以及炎性细胞因子分泌等炎症反应是肺损伤的重要因素。百草枯可以激活免疫细胞,激活炎症反应关键调控因子——核因子κB(nuclear factor-κB,NF-κB)[4]和激活蛋白-1(activator protein-1,AP-1)[5],导致下游的炎细胞因子表达增加。大麻素CB2受体(cannabinoid CB2 receptor)为G蛋白偶联受体,主要分布于外周免疫系统,能够激活多种信号通路。在骨性关节炎[6]、动脉粥样硬化[7]以及缺血再灌注损伤[8]过程中,CB2受体的激活参与抑制免疫细胞的活化、增殖和迁移,抑制炎症细胞因子(IL-1β、IL-6和TNF-α)的表达[9],发挥重要的抗炎作用。而CB2受体的激活能否对百草枯致大鼠急性肺损伤能否产生保护作用,国内文献未见报道。本研究将采用CB2受体激动剂JWH133对百草枯中毒大鼠进行预处理,研究分析对肺损伤的保护作用以及对转录因子NF-κB 和AP-1的影响。
材 料 和 方 法
1 试剂与仪器
百草枯(Sigma);JWH133(Enzo Life Sciences);TNF-α和IL-1β ELISA试剂盒(R&D);超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物公司);NF-κB p65和β-actin抗体(Abcam);c-Fos和c-Jun抗体(Santa Cruz);动脉血气分析仪(ABL);其余均为进口或国产分析纯化学试剂。
2 动物与分组
清洁级雄性Sprague-Dawley大鼠,体重200~250 g,由中国医科大学实验动物中心提供。适应性喂养1周,大鼠饲养的温度控制在20~25 ℃,湿度控制在40%~70%,昼夜节律控制为12 h,自由进食水。该实验方案经过中国医科大学动物伦理委员会批准。
将72只大鼠随机平均分成4组:百草枯中毒组(PQ组):按照20 mg/kg剂量腹腔注射;低剂量JWH133预处理组(LJWH133组)在给予PQ腹腔注射前1 h腹腔注射5 mg/kg JWH133;高剂量JWH133预处理组(HJWH133组)在给予PQ腹腔注射前1 h腹腔注射20 mg/kg JWH133;对照组(control组):1 mL生理盐水腹腔注射。在相同条件下常规饲料饲养,自由取食和饮水,房间温度(25±5)℃、湿度(50±10)%,人工照明,明暗各12 h。
3 主要方法
3.1 标本的采集及保存 在腹腔注射后8 h、1 d和3 d时,每组取出6只大鼠,使用10%水合氯醛300 mg/kg腹腔麻醉。待麻醉充分后,将大鼠仰卧于鼠台上固定,常规消毒后,切除皮肤,并逐层暴露股动脉鞘,完全游离股动脉约1 cm,将1 mL注射器以1%的肝素钠润管后,向股动脉近心端穿刺采血1 mL,以备血气分析使用。打开大鼠胸腔暴露出肺脏,结扎右侧肺门。血管夹夹闭右主支气管,将顶端圆钝的特制针头插入气管,用4 mL生理盐水行肺泡灌洗,回收肺泡灌洗液,重复3次。将标本计量后,4 ℃离心(1 000×g)10 min,分离并收集上清液置于-80 ℃保存。取肺左叶部分置于-80 ℃保存以备检测,另一部分置于4%多聚甲醛溶液中固定48 h以上,石蜡包埋切片,苏木精-伊红(HE)染色。
3.2 动脉血氧分压(arterial partial pressure of oxygen, PaO2)的测定 将动脉血标本约1 mL放入动脉血气分析仪中,测定动脉血氧分压。
3.3 支气管肺泡灌洗液IL-1β和TNF-α含量的测定 将收集的大鼠支气管肺泡灌洗液,使用ELISA方法严格按照说明书检测血清中IL-1β 和TNF-α含量。
3.4 肺组织损伤评分 将固定好的大鼠肺组织切割组织块,至厚度约0.5 cm左右,常规组织梯度乙醇脱水、透明、浸蜡、包埋后连续切片,行HE 染色。光镜下观察肺组织病理学变化,并按Mikawa等[10]方法进行肺损伤评分。评分标准如下:对肺泡充血、出血、肺泡腔或血管壁中性粒细胞浸润或聚集、肺泡壁增厚和(或)透明膜形成4项指标,分别依病变轻重评0~4分(0:无病变或非常轻微;1:轻度病变;2:中度病变;3:重度病变;4:极重度病变)。各项评定分数相加为肺损伤总评分。
3.5 Western blotting 法检测肺组织NF-κB和AP-1的表达 按照细胞核蛋白提取试剂盒说明,提取肺组织核蛋白,进行蛋白定量后,加样品缓冲液煮沸5 min,各取20 μL 加样;使用10% 聚丙烯酰胺凝胶在150 V、30 mA条件下电泳1.5 h;50 V 条件下PVDF 膜转膜2 h;5%脱脂牛奶封闭,滴加NF-κB p65Ⅰ抗(1∶50)和c-Fos、c-JunⅠ抗(1∶50),4 ℃过夜; 用含0.1% Tween 20 的TBS 冲洗5 min 3次,再加入Ⅱ抗(1∶500)室温下孵育2 h,用0.1% TBST 冲洗15 min 3 次,ECL 发光检测,X 线片显影,扫描图像,测得各条带的灰度值,以β-actin为内参照标准后,比较其表达量的变化。
4 统计学处理
采用SPSS 16.0 统计软件进行分析,所有数据均以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 大鼠PaO2的变化
正常对照组大鼠PaO2在90 mmHg以上,百草枯中毒以后PaO2明显下降,中毒3 d时比较显著;当使用CB2受体激动剂JWH133预处理以后,尤其是高剂量组(20 mg/kg),随时间的延长PaO2下降的程度有所缓和,在中毒1 d 和3 d时,与百草枯中毒组比较具有显著差异(P< 0.05),见图1。
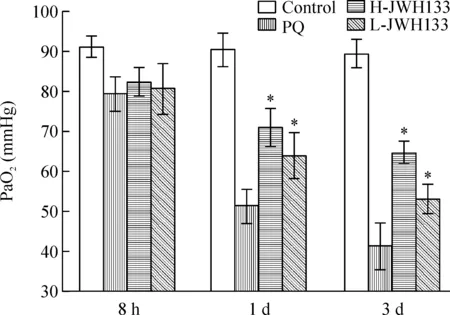
Figure 1.PaO2levels of rats in different groups at different time points. Mean±SD.n=6.*P<0.05vsPQ group.
图1 不同组别大鼠在不同时点动脉血氧分压的变化
2 支气管肺泡灌洗液IL-1β和TNF-α含量测定
百草枯中毒组随着中毒时间的延长,支气管肺泡灌洗液中IL-1β和TNF-α含量明显增加;当使用CB2激动剂JWH133预处理后二者表达量明显下降,在百草枯中毒1 d 和3 d,与百草枯中毒组比较有显著差异(P<0.05),见图2。
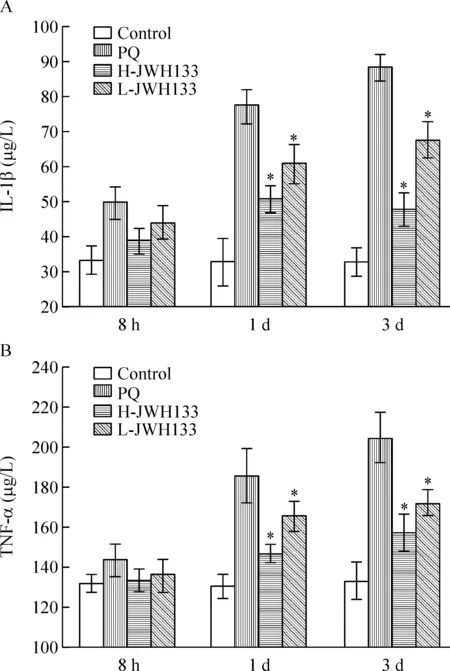
Figure 2.The levels of IL-1β (A)and TNF-α (B)in BALF of the rats in different groups at different time points. Mean±SD.n=6.*P<0.05vsPQ group.
图2 不同组别大鼠在不同时点支气管肺泡灌洗液IL-1β和TNF-α含量的变化
3 肺组织损伤评分
光镜下所见正常肺组织肺泡结构完整,间质清晰,无炎性渗出,而百草枯中毒组3 d 时大鼠肺组织损伤严重,显微镜下可见肺泡结构破坏,肺间质水肿,大量炎性细胞浸润。百草枯中毒组肺组织损伤评分较正常组比较明显增加,而 JWH133预处理组的肺损伤程度明显减轻,损伤评分下降,与百草枯中毒组比较有显著差异(P<0.05),见图3。
4 NF-κB p65和AP-1(c-Fos、c-Jun)蛋白在肺组织中的量化分析
Western blotting 结果提示NF-κB p65和AP-1(c-Fos、c-Jun)蛋白在百草枯中毒组中表达较正常组明显增加,而JWH133预处理组二者表达明显下降,高剂量JWH133组更为显著,与百草枯中毒组相比较差异有统计学意义(P<0.05),见图4、5。
讨 论
百草枯中毒后,主要造成急性肺损伤,而且发展迅速。目前其机制并不是很清楚,除了本身可以造成氧化还原反应,炎性细胞因子的参与也起到非常重要的作用。百草枯中毒后产生大量活性氧自由基等除了直接的细胞毒性外,还通过激活炎性细胞,增加花生四烯酸代谢产物的产生,增加肺组织中基质金属蛋白酶(matrix metalloproteinases,MMP)-2和MMP-9的表达[11],刺激炎症细胞因子如TNF-α和IL-1β分泌,参与炎症反应[12]。在组织病理学上可表现为肺泡结构破坏、肺间质水肿以及炎症细胞浸润。

Figure 3.HE staining of rat lung tissue (×200) and the lung injury scores in different groups at 3 d after PQ poisoning. Mean±SD.n=6.*P<0.05vsPQ group.
图3 不同组别大鼠肺组织HE染色及肺组织的损伤评分
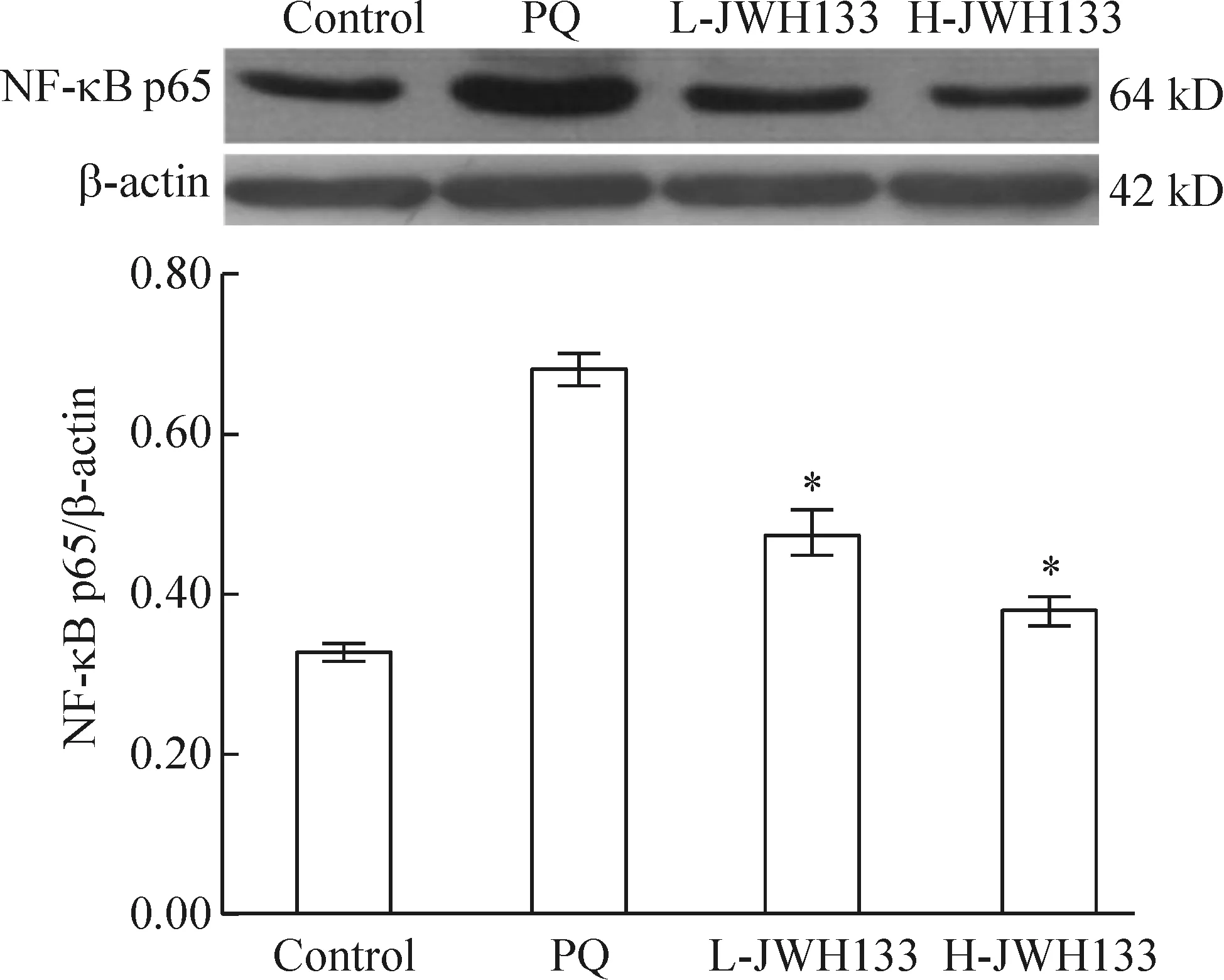
Figure 4.The protein expression of NF-κB p65 in different groups at 3 d after PQ poisoning. Mean±SD.n=6.*P<0.05vsPQ group.
图4 不同组别大鼠肺组织NF-κB p65蛋白在百草枯中毒3 d的表达
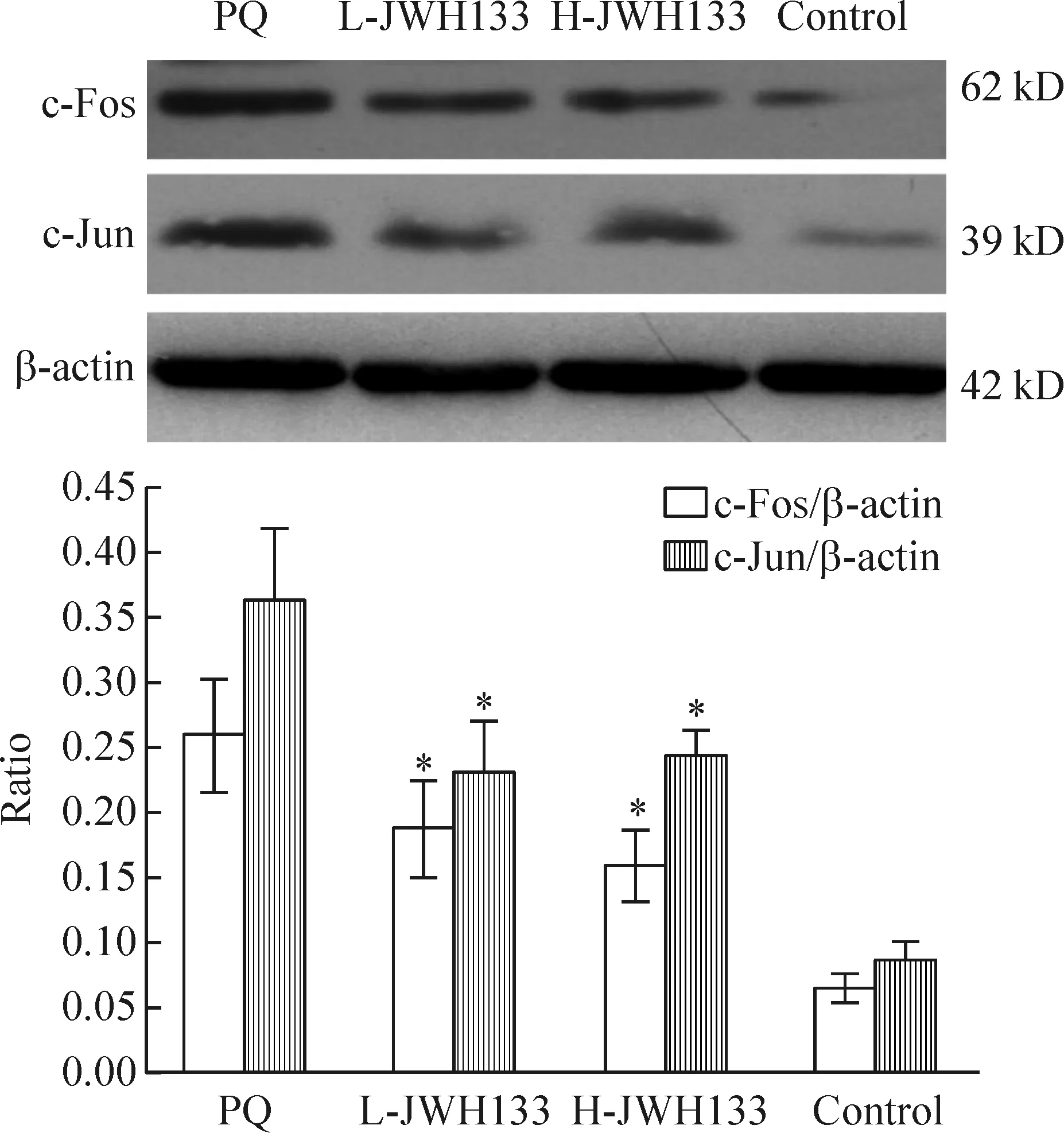
Figure 5.The protein expression of c-Fos and c-Jun in different groups at 3 d after PQ poisoning. Mean±SD.n=6.*P< 0.05vsPQ group.
图5 不同组别大鼠肺组织c-Fos和c-Jun蛋白在百草枯中毒3 d的表达
NF-κB是由Rel/NF-κB家族的多肽成员组成的一组转录因子,被称为是免疫炎症反应的中枢调节者[13]。在细胞静息状态下,Rel/NF-κB转录复合物以无活性的状态存在于细胞浆中,当细胞暴露于各种细菌、病毒以及其代谢产物时,或者在缺血/再灌注、出血及休克等应激状态下,NF-κB便可以被激活,进入细胞核内,启动和调控多种与炎症反应有关的细胞因子(IL-1β、TNF-α等)、黏附分子(ICAM-1、VCAM-1、E-选择素等)和趋化因子(IL-8等)的基因表达。AP-1是由 c-Fos 和 c-Jun 蛋白组成的同源或异源二聚体。静息状态下,AP-1 的蛋白浓度和活性极低,当细胞受到刺激时,c-Jun和c-Fos 表达水平增高,参与调控炎性细胞因子如TNF-α、IL-1β、IL-6和IL- 8的表达,影响炎症反应持续和发展[14]。TNF-α 是导致细胞或组织损伤的主要细胞因子,在局部或全身损伤后几分钟内由巨噬细胞释放,然后直接作用于细胞并造成损伤;作用于中性粒细胞时,生成自由基,释放各种蛋白酶和水解酶,诱导细胞凋亡[15]。IL-1β对巨噬细胞及中性粒细胞有趋化和黏附作用,增强血管通透性,能够诱导IL-6合成[16]。
我们研究结果提示在百草枯中毒导致急性肺损伤的过程中,大鼠动脉血氧分压随着时间延长明显降低,显微镜下所见大鼠肺泡组织结构破坏,肺间质水肿,中性粒细胞、巨噬细胞等炎症细胞数量增加,肺组织中NF-κB和AP-1蛋白的表达增加,下游炎性细胞因子如IL-1β和TNF-α的表达不断增加。分析升高的原因可能有两方面原因:一是百草枯中毒后产生的大量氧自由基,导致其NF-κB和AP-1的激活;另一方面细胞因子如TNF-α、IL-1β等的大量释放,也进一步参与两者的活化。
CB2受体作为内源性大麻素系统重要组成部分之一,主要在包括B细胞、自然杀伤细胞、单核细胞、巨噬细胞和中性粒细胞等免疫细胞中表达[17-18]。CB2受体被激活以后可通过抑制细胞内cAMP生成来发挥作用,减少T淋巴细胞的增殖,降低巨噬细胞生物活性和功能,明显抑制脂多糖(lipopolysaccharide, LPS)所诱发的炎性细胞因子TNF-α和 IL-1β的表达,抑制炎症反应[19]。有研究报道在LPS诱导的葡萄膜炎实验研究中,使用CB2受体激动剂HU308可以降低转录因子NF-κB和AP-1表达,减少致炎因子TNF-α、 IL-1β、 IL-6、 CCL5和CXCL2表达[20]。与该研究结果类似,我们研究发现百草枯中毒致大鼠急性肺损伤模型中,使用CB2受体激动剂JWH133进行预处理以后,肺组织损伤程度较百草枯中毒组有所缓解,动脉氧分压较中毒组有一定程度的提高,肺泡灌洗液中的炎性细胞因子TNF-α和 IL-1β浓度均有不同程度减少,肺组织中NF-κB和AP-1蛋白表达含量明显下降,尤其是高剂量组JWH133组更为明显。分析认为JWH133激活肺组织中免疫细胞CB2受体,抑制免疫细胞活性和功能,进而抑制炎症调控因子NF-κB和AP-1,减少下游TNF-α和 IL-1β等细胞因子的表达,减轻百草枯所导致的肺部炎症反应,具体生物学机制需要进一步研究探讨。
综上所述,JWH133作为CB2受体激动剂,可以激活CB2受体,抑制NF-κB和AP-1蛋白的表达,抑制炎症反应,缓解百草枯中毒所导致的大鼠急性肺损伤。CB2受体可以作为研究和治疗百草枯中毒的新靶点。
[1] Bertolote JM, Fleischmann A, Eddleston M, et al. Deaths from pesticide poisoning: a global response[J]. Br J Psychiatry, 2006, 189(3):201-203.
[2] Hoet PH, Lewis CP, Demedts M, et al. Putrescine and paraquat uptake in human lung slices and isolated type II pneumocytes[J]. Biochem Pharmacol, 1994, 48(3):517-524.
[3] Kao CH, Hsieh JF, Ho YJ, et al. Acute paraquat intoxication: using nuclear pulmonary studies to predict patient outcome[J]. Chest, 1999, 116(3):709-714.
[4] 余海放, 聂 虎. 百草枯中毒后NF-κB及其下游产物变化的研究[J]. 四川大学学报:医学版,2010, 41(2):276-279.
[5] 吴 伟,刘 莹,胡 明,等. 百草枯中毒大鼠肺TGF-β和 c-Jun 的表达及姜黄素的干预作用[J]. 中国医科大学学报,2011, 40(1): 12-16.
[6] Richardson D, Pearson RG, Kurian N, et al. Characterization of the cannabinoid receptor system in synovial tissue and fluid in patients with osteoarthritis and rheumatoid arthritis[J]. Arthritis Res Ther, 2008, 10(2):R43.
[7] Pacher P, Ungvári Z. Pleiotropic effects of the CB2 cannabinoid receptor activation on human monocyte migration: implications for atherosclerosis and inflammatory diseases[J]. Am J Physiol Heart Circ Physiol, 2008, 294(3):H1133-H1134.
[8] Pacher P, Haskó G. Endocannabinoids and cannabinoid receptors in ischaemia-reperfusion injury and preconditio-ning[J]. Br J Pharmacol, 2008, 153(2):252-262.
[9] Zhang J, Chen L, Su T, et al. Electroacupuncture increases CB2 receptor expression on keratinocytes and infiltrating inflammatory cells in inflamed skin tissues of rats[J]. J Pain, 2010, 11(12):1250-1258.
[10]Mikawa K, Nishina K, Takao Y, et al. ONO-1714, a nitric oxide synthase inhibitor, attenuates endotoxin-induced acute lung injury in rabbits [J]. Anesth Analg, 2003, 97(6):1751-1755.
[11]胡业佳,石 磊,王蔚琛,等. 依达拉奉联合还原型谷光甘肽对百草枯肺纤维化的干预及影响[J]. 中国病理生理杂志,2010, 26(10):1965.
[12]Dinis-Oliveira RJ, Duarte JA, Snchez-Navarro A, et al. Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol, 2008, 38(1):13-71.
[13]Gilmore TD. Introduction to NF-kappaB: players, pathways, perspectives[J]. Oncogene, 2006, 25(51):6680-6684.
[14]Meade AJ, Meloni BP, Cross J, et al. AP-1 inhibitory peptides are neuroprotective following acute glutamate excitotoxicity in primary cortical neuronal cultures[J]. J Neurochem, 2010, 112(1):258-270.
[15]田 莉,郑媛媛,胡巢凤,等. NOD8对LPS诱导巨噬细胞释放NO、TNF-α和IL-1β的影响[J]. 中国病理生理杂志,2013, 29(5):889-894.
[16]Bauer TT, Montón C, Torres A, et al. Comparison of systemic cytokine levels in patients with acute respiratory distress syndrome, severe pneumonia, and controls[J]. Thorax, 2000, 55(1):46-52.
[17]Galiegue S, Mary S, Marchand J, et al. Expression of central and peripheral cannabinoid receptors in human immune tissues and leukocyte subpopulations[J]. Eur J Biochem, 1995, 232(1):54-61.
[18]Leleu-Chavain N, Desreumaux P, Chavatte P, et al. Therapeutical potential of CB2receptors in immune-related diseases[J]. Curr Mol Pharmacol, 2013, 6(3):183-203.
[19]Raduner S, Majewska A, Chen JZ, et al. Alkylamides fromEchinaceaare a new class of cannabinomimetics. Cannabinoid type 2 receptor-dependent and -independent immunomodulatory effects[J]. J Biol Chem, 2006, 281(20):14192-14206.
[20]Toguri JT, Lehmann C, Laprairie RB, et al. Anti-inflammatory effects of cannabinoid CB2receptor activation in endotoxin-induced uveitis[J]. Br J Pharmacol, 2014, 171(6):1448-1461.
CB2 receptor agonist JWH133 exerts protective effects on rat model of paraquat-induced acute lung injury
LIU Zhen-ning, HAN Jun, ZHENG Qiang, ZHAO Min
(DepartmentofEmergencyMedicine,ShengjingHospitalofChinaMedicalUniversity,Shenyang110004,China.E-mail:wfzd999@126.com)
AIM: To study the protective effects of cannabinoid CB2 receptor agonist JWH133 on rat acute lung injury induced by paraquat (PQ).METHODS: Male Sprague-Dawley rats (n=72) were randomly divided into 4 groups. PQ group: PQ was administered intraperitoneally at the dose of 20 mg/kg; Low-dose JWH133 pretreatment group (L-JWH133 group): JWH133 (5 mg/kg, ip) was administered 1 h before PQ exposure; high-dose JWH133 pretreatment group (H-JWH133 group): JWH133 (20 mg/kg, ip) was administered 1 h before PQ exposure; control group: 1 mL saline was administered intraperitoneally. Arterial blood, bronchoalveolar lavage fluid (BALF) and lung tissue samples were collected at 8 h, 1 d and 3 d after PQ exposure. PaO2and the levels of TNF-α and IL-1β in BALF were measured via blood gas analyzer and ELISA, respectively. The pathological changes and lung injury scores were assessed at 3 d after PQ exposure. NF-κB and AP-1 protein levels were also determined by Western blotting.RESULTS: The decrease in PaO2, structural injury of the lung tissues, interstitial pulmonary edema, and the increase in IL-1β and TNF-α in BALF were observed in PQ-treated rats compared with control group. JWH133 pretreatment reduced the degree of lung tissue injury, decreased the levels of IL-1β and TNF-α in BALF and the NF-κB and AP-1 protein expression in the lung tissue compared with PQ group, especially in H-JWH133 group. CONCLUSION: CB2 receptor agonist JWH133 inhibits NF-κB and AP-1 protein expression in the lung tissues, and reduces the secretion of IL-1β and TNF-α in BALF after paraquat exposure, thus attenuating paraquat-induced acute lung injury.
Paraquat; Acute lung injury; Cannaboid CB2 receptor; Nuclear factor-κB; Activator protein-1
1000- 4718(2014)12- 2179- 06
2014- 07- 21
2014- 09- 13
国家自然科学基金资助项目(No. 81171793/H1503); 辽宁省科学计划项目(No.201102278);辽宁省教育厅高等学校科学研究一般项目(No. L2014300)
R392.32
A
10.3969/j.issn.1000- 4718.2014.12.011
△通讯作者 Tel: 024-96615-64131; E-mail: wfzd999@126.com

