测定高分子聚合物-金属配合物稳定常数及平均配位数的新方法
杨士凤 段华玲 林继军 朱建颖 弓振斌
(1厦门大学近海海洋环境科学国家重点实验室,厦门 361102)
(2厦门大学海洋与地球学院,厦门 361102)
(3厦门大学环境与生态学院,厦门 361102)
配合物稳定常数、平均配位数是表征高分子聚合物与金属离子配合反应的重要参数,也是研究高分子聚合物应用于金属离子分离、富集过程或工艺参数优化的理论基础[1-3]。水溶性聚合物因其具有良好的化学稳定性、大量的配位基团以及与金属离子较好的配位能力[4-5],得到广泛应用[6-9]。聚乙烯亚胺(PEI)是最常用的水溶性高分子聚合物,其分子链上大量的胺基[4,10]可与金属离子形成稳定的配合物,广泛应用于地下水处理[11]、工业废水中金属离子的去除及回收[12],以及海水中痕量/超痕量金属离子与基体分离研究[13]。
水溶性高分子聚合物-金属离子配合物稳定常数、配位数的测定方法有电化学法[14-17]、分光光度法[18-19]、超滤法[3,20-22]等。电化学法是基于配合物形成导致溶液电化学性质的改变进行测定,主要有电位滴定法[14-15]、pH 电位法[16]和极谱法[17]等,但测定和计算过程较繁琐。分光光度法基于金属离子与配位体形成有色配合物,根据溶液吸光度的变化,确定配合物化学组成及稳定常数,适用于摩尔吸收系数较大且与配位体的摩尔吸收系数有明显差别的配合物[18-19]。超滤法则通过超滤技术将聚合物-金属离子配合物与金属离子的其它形态分离,然后计算稳定常数和平均配位数;黄佳华等[22-23]利用离心超滤技术,结合化学平衡理论模型,测定了PEI-Cd配合物的稳定常数和平均配位数;该方法具有模型简单、通用的特点,但离心超滤过程费时、繁琐,容易造成玷污进而影响结果的准确性。为此,本文在研究组建立的化学平衡理论模型基础上[22-23],建立一种快速、准确的在线分离、测定技术,提高聚合物与金属离子配合物稳定常数、平均配位数测定的准确性。
凝胶过滤色谱(GFC)因其操作简单、分离条件温和、重现性好、应用范围广[24],在多肽、蛋白质等生化组分的分离、纯化及分子量的测定中得到广泛应用[25-27]。本文尝试将GFC技术与电感耦合等离子体质谱(ICPMS)结合,建立水溶性高分子聚合物-金属离子配合物稳定常数和平均配位数测定的新方法。文中以PEI和Cu2+为例,介绍了测定PEI-Cu配合物稳定常数、平均配位数的过程,并研究了溶液pH值对测定结果的影响。
1 实验部分
1.1 仪器与试剂
Agilent 1100HPLC(美国 Agilent Technologies公司),TSK-GEL PWH 柱(7.5 mm×7.5 cm,12 μm,日本Tosoh 公 司 );Agilent 7700x ICPMS(美 国 Agilent Technologies公司);THZ-82型水浴恒温振荡器(金坛市富华仪器有限公司)。仪器优化后的操作条件如表1。
聚乙烯亚胺质量分数为50%的水溶液,平均分子量 Mw=750 kD(美国 Sigma-Aldrich公司),用超纯水稀释后得到 1 000 mg·L-1的工作液;1 000 mg·L-1Cu2+标准储备溶液(国家标准物质中心);硝酸、醋酸和醋酸钠为优级纯(德国Merck公司);HAc-NaAc缓冲溶液浓度为 0.02 mol·L-1,pH 值分别为 4.1、4.5、4.9、5.3; 实验用水为超纯水(18.2 MΩ·cm,美国Millipore公司);低密度聚乙烯(LDPE)瓶、聚四氟乙烯(PTFE)瓶(美国 Nalgene 公司)。

表1 GFC-ICPMS工作参数Table 1 Optimum operatiing conditions for GFC-ICPMS
1.2 实验过程
实验中使用的LDPE瓶、PTFE瓶等器皿的洗涤步骤[28]:1%洗洁液浸泡1 d,超纯水清洗3次;然后用30%HNO3(V/V)浸泡7 d,超纯水淋洗3次;最后用10%HNO3(V/V)浸泡7 d,超声3次,超纯水淋洗3次,于洁净工作台内风干备用。
移取 20 mL pH=4.1的 HAc-NaAc缓冲溶液于30 mL LDPE 瓶中,加入 100 μL 1 000 mg·L-1PEI溶液和 20 μL 10 mg·L-1Cu2+标准溶液,置于 25 ℃水浴恒温振荡器中振荡反应25 min,直至溶液反应完全;反应后的混合溶液用GFC分离及ICPMS测定,流动相为pH值与上述反应液一致的HAc-NaAc缓冲液,流速为 0.5 mL·min-1,进样量 100 μL;分离后的流出物直接引入ICPMS进行测定。改变溶液的pH 值分别为 4.5、4.9、5.3,研究溶液酸度对 PEI与Cu2+配合反应平衡的影响,流动相为相应pH值的HAc-NaAc缓冲液。
2 结果与讨论
2.1 溶液中的配合反应-化学平衡理论模型
若溶液中仅含Cu2+,加入PEI后,溶液中发生的反应主要有PEI与Cu2+的配合、PEI的质子化以及Cu-氢氧配合物的形成;实验中使用HAc-NaAc缓冲液控制溶液pH值,溶液中还存在Cu2+与Ac-的配合反应。在上述所有反应中,PEI与Cu2+的配合反应为主反应,其它反应均为副反应。
溶液中的主反应方程式为:
Cu2++nPEI⇌Cu(PEI)n
为简单起见,反应方程式中忽略了电荷平衡。当溶液的反应达到平衡时,反应常数即为形成PEI-Cu配合物的稳定常数(KPEI-Cu):

式中,cCu2+和cCu(PPEI)n为配合反应达到平衡时,溶液中分别以自由离子和高分子配合物形式存在的浓度;cPEI为反应达到平衡时,未形成PEI-Cu配合物的中性胺基基团的浓度;n为溶液中Cu2+与PEI分子中配位的胺基基团的个数,即PEI-Cu配合物的平均配位数。
溶液同时还存在副反应,即PEI的质子化、Cu2+与OH-或Ac-的配合等副反应,反应方程式为:
PEI+H+⇌ PEI·H
Cu2++iOH⇌Cu(OH)i
Cu2++jAc-⇌Cu(Ac)j
上述各副反应方程式中,同样忽略了电荷平衡。PEI·H表示PEI分子中的一个胺基基团与H+的质子化反应,其浓度cPEI·H是PEI分子中质子化胺基的浓度。各副反应的反应常数分别为:

式(6)中,仅有n、KCu(PEI)n是未知的。实验设计时,通过改变溶液中参与反应的Cu2+和PEI初始浓度的比值,得到不同的lgY值;而lgY与lgcPEI之间呈线性关系,待测的平均配位数n为直线的斜率,而KCu(PEI)n则包含在直线的截距中。此即为本文实验中使用的化学理论模型。
上述理论模型中,以下过程影响测定结果的准确性,实验中需要进行控制:
(1)色谱柱材料与溶液中的PEI-Cu及Cu的其它化学形态不能发生化学反应,且在分离过程中没有化学形态的改变[29-30];实验选择聚甲基丙烯酸酯填料的分离柱,并控制流动相的离子强度大于0.1 mmol·L-1,可达到此要求[29]。
(2)控制溶液的pH值在合适范围,以减少Cu(OH)i的形成,降低由于其形成沉淀影响测定结果的准确性。实验中控制pH<6.0,可以认为没有Cu(OH)i形 成[31]。
(3)PEI-Cu配合物与溶液中PEI中性分子、质子 化 的 PEI·H 的保留时间相同[3];Cu2+、Cu(OH)i、Cu(Ac)j的保留时间也相同。实验中选择极低分离能力的GFC保护柱进行,仅能将大分子量的聚合物、聚合物-金属配合物与小分子量金属配合物及自由态Cu2+分离开,而分子量相差1~2个数量级的化合物保留时间近似。
2.2 PEI-Cu配合物稳定常数的测定
依照上述化学平衡理论模型及GFC-ICPMS测定方法,实验中采用以下2种实验方案测定PEI-Cu配合物的稳定常数:
(1)在 10 μg·L-1的 Cu2+溶液中加入浓度分别为0.5、1.0、2.0、5.0、10.0 mg·L-1的 PEI溶液,得到一系列不同Cu2+、PEI浓度比的混合溶液,待配合反应达到平衡后,测定溶液中cCu(PEI)n与cCu2++cCu(OH)i+cCu2+的浓度比值,依照式(6)处理数据并进行线性拟合,求得PEI-Cu配合物的稳定常数和平均配位数。图1、图2分别为该方案得到的GFC-ICPMS谱图及数据线性拟合结果。
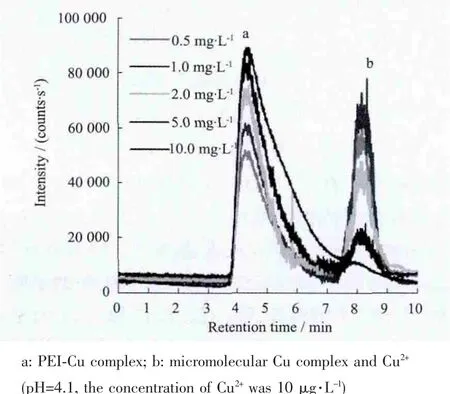
图1 不同PEI浓度时的GFC-ICPMS色谱图Fig.1 GFC-ICPMS chromatogram at different concentration of PEI
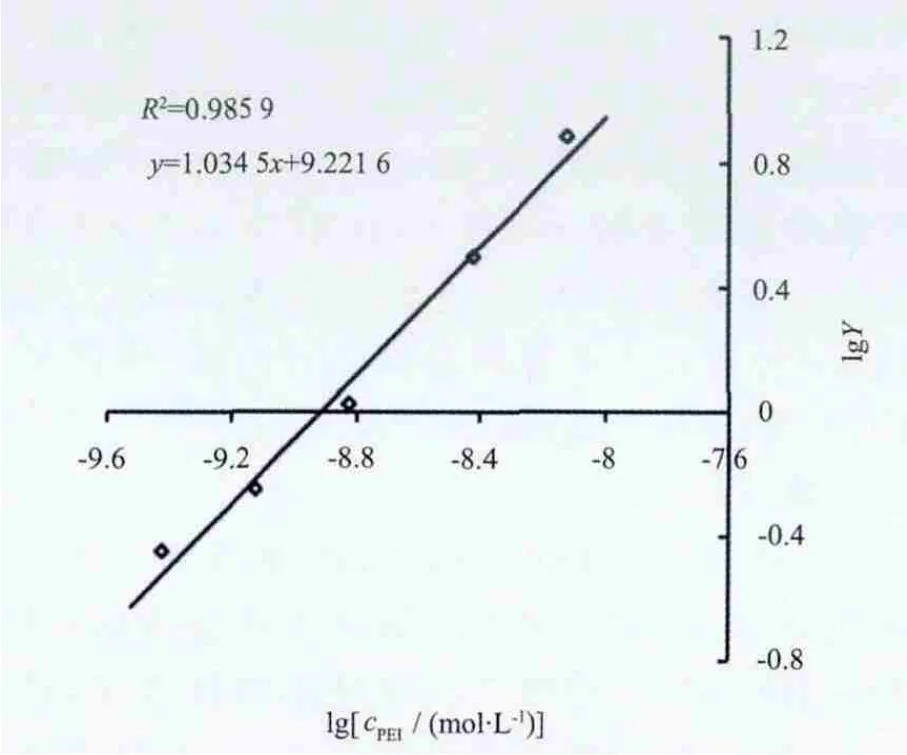
图2 lgY与lgcPEI的线性拟合曲线Fig.2 Linear Regression curve of lgY and lgcPEI
(2)在 5.0 mg·L-1PEI溶液中加入浓度分别为10、20、30、50、70 μg·L-1的 Cu2+,得到一系列不同Cu2+、PEI浓度比的混合溶液,测定配合反应达到平衡时溶液中cCu(PEI)n与cCu2++cCu(OH)i+cCu(Ac)j的浓度比值,利用方案(1)得到的平均配位数和式(6)计算得到PEI-Cu配合物的稳定常数。图3为该方案得到的GFC-ICPMS谱图。
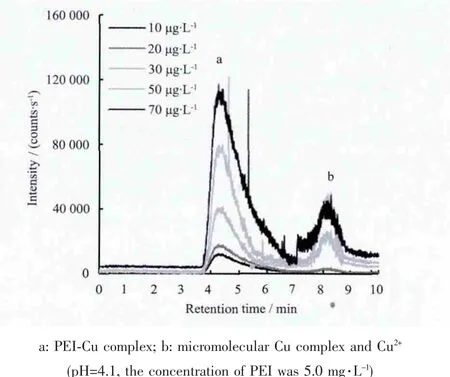
图3 不同Cu浓度时的GFC-ICPMS色谱图Fig.3 GFC-ICPMS chromatogram at different concentration of Cu2+
在25℃,pH=4.1时,依据上述2种方案测定了PEI-Cu配合物的稳定常数及平均配位数,如表2示。实验结果表明,上述2种方案测得PEI-Cu稳定常数基本一致,可采用其中任一种方法测定稳定常数。
表 3 列出了 25 ℃、pH=4.1~5.3 时,本法测得PEI-Cu配合物的稳定常数与文献报道结果的比较。尽管本文使用的PEI的平均分子量、采用的测定方法以及使用的化学理论模型等与已有报道存在差异,但实验测得的稳定常数、平均配位数与报道结果相当接近,且重复性好、准确度高,说明本实验建立的方法合理、可靠。
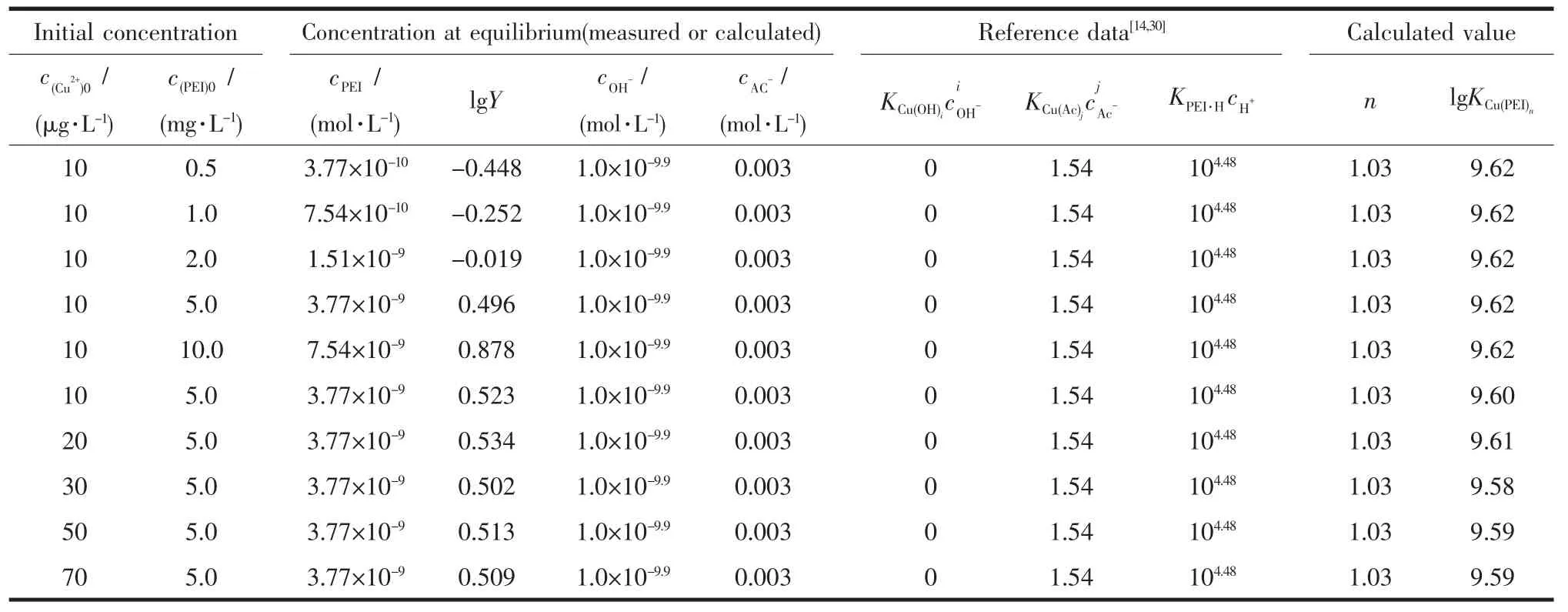
表2 PEI-Cu配合物的稳定常数及平均配位数(25℃,pH=4.1,I=0.003 mol·L-1)Table 2 Complexation stability constant and coordination number of PEI-Cu complex(25 ℃,pH=4.1,I=0.003 mol·L-1)
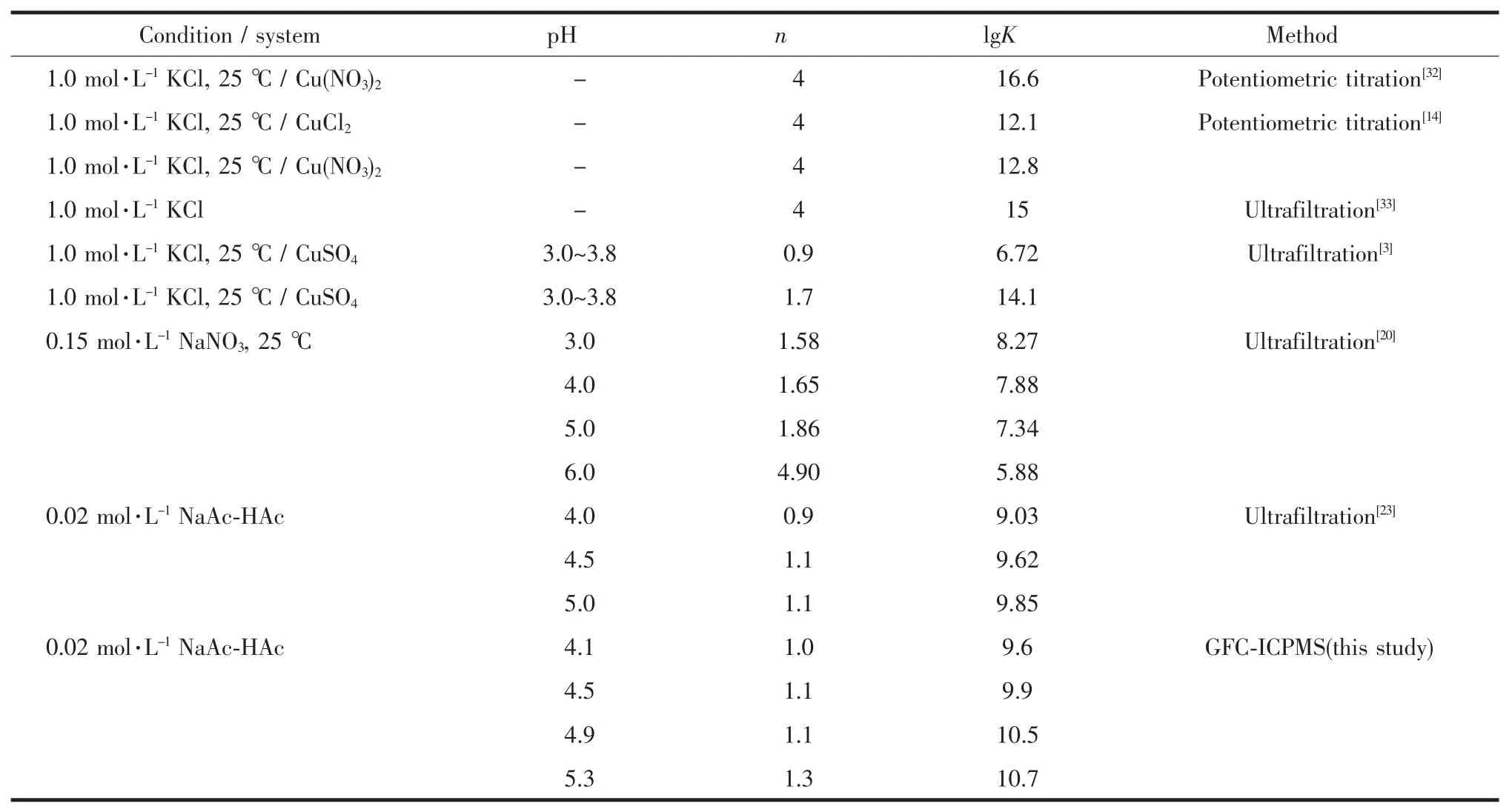
表3 PEI-Cu配合物的稳定常数和平均配位数Table 3 Complexation stability Constants and coordination numbers of PEI-Cu
2.3 pH值对PEI-Cu配合反应平衡的影响
实验选用HAc-NaAc缓冲体系,以保证PEI与Cu2+的配合反应在固定的pH条件下进行。当溶液pH 值分别为 4.1、4.5、4.9、5.3 时,溶液 pH 值对 PEICu配合反应平衡的影响如图4示。实验结果表明,pH对Cu2+与PEI配合反应平衡的影响显著,PEI-Cu配合稳定常数及平均配位数均随pH的增大而增加。产生这种影响的主要原因是pH值影响PEI分子中胺基的质子化,表现为以下两个方面:

图4 pH值对PEI与Cu2+配合反应的影响Fig.4 Effect of pH on the reaction of PEI and Cu2+
(1)溶液中存在金属离子与质子的竞争反应。实验条件下(pH=4.1~5.3),PEI 质子化程度相当严重;研究表明[14],pH=3.0时只有约10-7的胺基未发生质子化,pH=5.0 时约为 0.001%; 即使 pH=7.0,仍有99.91%质子化。因此,溶液中存在金属离子与质子对PEI分子中胺基基团上孤对电子的竞争。pH值较低时,溶液中质子的竞争占优势,降低了与Cu2+配合的PEI分子中中性胺基的含量;随pH值增加,金属离子的竞争占优势,PEI与金属离子的配合作用加强。
(2)影响了PEI分子的结构。在较低的pH值时,PEI分子强烈的质子化,由于带正电荷胺基基团的静电排斥作用,聚合物链延伸至相对较大的空间范围[3],不利于配合作用的发生;随着pH值的升高,PEI分子中因质子化而带正电荷的基团数量减少,PEI分子产生较小的排斥作用,甚至可能会发生分子与分子之间的缠绕,增强了聚合物的配合作用[34]。
3 结 论
本实验将GFC分离与ICPMS技术相结合应用于聚合物-金属离子配合物稳定常数及平均配位数的研究,利用化学平衡理论模型,实现了PEI-Cu配合物稳定常数及平均配位数的测定;研究并考察了不同pH值对配合反应平衡的影响,结果表明,25 ℃、pH=4.1~5.3 时,PEI-Cu 配合物稳定常数及平均配位数均随pH的增加而增加。
文中建立的新方法实现了高分子聚合物-金属离子配合物及金属元素其它形态的在线分离及测定,降低了实验过程中可能的玷污,方法简便、快速、可靠;可以应用于不同金属离子与PEI以及其它水溶性高分子聚合物形成的配合物稳定常数、平均配
位数的准确测定。
[1]Rumeau M,Persin F,Sciers V,et al.J.Membr.Sci.,1992,73(2/3):313-322
[2]Juang R S,Liang J F.J.Membr.Sci.,1993,82(1):163-174
[3]Juang R S,Chen M N.Ind.Eng.Chem.Res.,1996,35(6):1935-1943
[4]Geckeler K,Lange G,Eberhardt H,et al.Pure Appl.Chem.,1980,52(7):1883-1905
[5]Rivas B L,Pereira E D,Moreno-Villoslada I.Prog.Polym.Sci.,2003,28(2):173-208
[6]Geckeler K E,Volchek K.Environ.Sci.Technol.,1996,30(3):725-734
[7]Uludag Y,Özbelge H Ö,Yilmaz L.J.Membr.Sci.,1997,129(1):93-99
[8]Juang R S,Chiou C H.J.Membr.Sci.,2000,177(1):207-214
[9]Molinari R,Argurio P,Poerio T.Desalination,2004,162:217-228
[10]Rivas B L,Geckeler K E.Polymer Synthesis Oxidation Processes.Berlin Heidelberg:Springer,1992:171-188
[11]Cañizares P,Pérez Á,Camarillo R.Desalination,2002,144(1):279-285
[12]Molinari R,Poerio T,Argurio P.J.Membr.Sci.,2007,295(1):139-147
[13]LIN Ji-Jun(林继军),DUAN Hua-Ling(段华玲),GONG Zhen-Bin(弓 振 斌).Chinese J.Anal.Chem.(分 析 化 学 ),2011,39(6):906-910
[14]Kobayashi S,Hiroishi K,Tokunoh M,et al.Macromolecules,1987,20(7):1496-1500
[15]Jarvis N V,Wagener J M.Talanta,1995,42(2):219-226
[16]LUO Qin-Hui(罗勤慧),SHEN Meng-Chang(沈孟长),DING Yi(丁益),et al.Acta Chim.Sinica(化学学报),1982,40(2):125-133
[17]Çaykara T,I˙nam R,Öztürk Z,et al.Colloid Polym.Sci.,2004,282(11):1282-1285
[18]Leyte J C,Zuiderweg L H,Van Reisen M.J.Phys.Chem.,1968,72(4):1127-1132
[19]Yamaoka K,Masujima T.Bull.Chem.Soc.Jpn.,1979,52(2):1286-1296
[20]Tomida T,Hamaguchi K,Tunashima S,et al.Ind.Eng.Chem.Res.,2001,40(16):3557-3562
[21]Islamoglu Kadioglu S,Yilmaz L,Onder Ozbelge H.Sep.Sci.Technol.,2009,44(11):2559-2581
[22]HUANG Jia-Hua(黄佳华),GONG Zhen-Bin(弓振斌),LIN Ji-Jun(林继军),et al.Chem.J.Chinese U.(高等学校化学学报),2012,33(12):2633-2637
[23]HUANG Jia-Hua(黄佳华).Thesis for the Master Degree of Xiamen University(厦门大学硕士学位论文).2012.
[24]Striegel A,Yau W W,Kirkland J J,et al.Modern Size-ex Clusion Liquid Chromatography:Practice of Gel Permeation and Gel Filtration Chromatography.New York:Wiley,2009.
[25]YeungB,MarecakD.J.Chromatogr.,A,1999,852(2):573-581
[26]Rojas E E G,Reis Coimbra dos JS,Minim L A,et al.Process Biochem.,2004,39(11):1751-1759
[27]Vasudevan P T,Palekar A A,Yan S.Biocatal.Biotransform.,2002,20(3):189-199
[28]Achterberg E P,Holland T W,Bowie A R,et al.Anal.Chim.Acta,2001,442(1):1-14
[29]Liu M,Xie C,Xu W,et al.J.Chromatogr.,A,2004,1046(1):121-126
[30]Cutié S S,Martin S J.J.Appl.Polym.Sci.,1995,55(4):605-609
[31]ZHANG Han-Qi(张寒琦),TIE Yuan(铁元),WANG Da-Ning(王大宁),et al.Brief Handbook of Analytical Chemistry(分析化学简明教程).Changchun:Jilin University Press,1996.
[32]Thiele H,Gronau K H.Makromol.Chem.,1963,59:207-221
[33]Molinari R,Poerio T,Argurio P.Chemosphere,2008,70(3):341-348
[34]Bekturov E A,Bakauova Z K.Synthetic Water-soluble Polymers in Solution.Basel,Heidelberg,New York:Hüthig&Wepf Verlag,1986.

