香鱼巨噬细胞炎性蛋白-2基因的克隆、序列分析及表达
王世会 史雨红 陈炯
(宁波大学应用海洋生物技术教育部重点实验室,宁波 315211)
趋化因子(Chemokines,CK)是一类能使细胞发生趋化运动的小分子细胞因子,从1986年发现第一个趋化因子至今,至少已经发现了60种趋化因子。其中趋化因子家族成员巨噬细胞炎性蛋白(Macrophage inflammatory protein,MIP)是由Wolpe等[1]于1988年首次发现的。脂多糖(Lipopolysaccharide,LPS)刺激鼠巨噬细胞系RAW264.7后,用肝素亲和柱分离出了两种新的蛋白质MIP-1和MIP-2。这两种蛋白质分别占巨噬细胞分泌蛋白质的5%和2%[1,2]。通过这种方法他们所获得的MIP-2是一分子量6 kD、成熟蛋白含有73个氨基酸残基的碱性蛋白[3]。MIP-2具有重要的生理作用,可以特异性地趋化中性粒细胞到炎症部位,从而消除炎症反应。Lentsch等[4]提到,小鼠由于局部出血而引起肝组织损伤中,MIP-2蛋白可以特异性地驱动白细胞到达炎症部位,消除炎症反应。同时在病毒性侵染导致的免疫应答反应中,病毒可以引起趋化因子MIP-2蛋白的表达量上调,影响免疫细胞杀伤病毒的能力,提高寄主对病毒的抗性[5]。小鼠在注射接种柯萨奇B3病毒(CVB3)14 d后,心肌组织MIP-2基因mRNA表达量显著上调[6]。除了具有趋化作用外,在造血调控中MIP-2也发挥着作用。Broxmeyer等[7,8]认为MIP-2起到与其它造血因子协同或影响的作用。目前,关于MIP-2的文献报道以人和鼠为主,而鱼类MIP-2基因只能从数据库中检索到相关序列,暂无相关文献报道。
香鱼(Plecoglossus altivelis,Sweetfish)隶属胡瓜鱼目香鱼科,是东亚地区中国、日本和朝鲜等国家特有的一种小型经济名贵鱼类[9]。近年来在中国的养殖面积日益增加,但病害问题严重。其中鳗利斯顿氏菌(Listonella anguillarum)是养殖香鱼的主要病原菌之一,对香鱼养殖业造成巨大的经济损失[10]。与直接使用化学试剂防治病害相比,免疫学方法对鱼体和食用者更安全,对环境更环保。因此,本研究对香鱼MIP-2基因进行序列分析,分析其mRNA表达与鳗利斯顿氏菌感染相关性;采用原核表达获得香鱼MIP-2蛋白,制备香鱼MIP-2抗血清,旨为进一步深入研究香鱼MIP-2蛋白功能奠定基础。
1 材料与方法
1.1 材料
健康香鱼购自宁海凫溪香鱼养殖场;ICR小鼠购自宁波大学实验动物中心;鳗利斯顿氏菌香鱼分离株sweetfish-H080701、大肠杆菌Top10和BL21 pLys E菌株、原核表达载体pGEX-3X等由本实验室提供;RNAiso试剂、SYBRPremix Ex Taq试剂盒、AMV逆转录酶等购自TaKaRa公司;Gel Extraction Kit购自Omega公司;辣根过氧化酶标记山羊抗小鼠IgG购自北京中山金桥生物技术有限公司;ECL化学发光试剂盒、显影定影试剂盒、柯达X-OMAT BT胶片和压片暗盒购自碧云天生物技术研究所。
1.2 方法
1.2.1 样品制备 购回的香鱼在实验室中饲养1周,随机选取3尾健康香鱼,采集心、肝、鳃、肾、脑、脾、肌肉、肠等组织,投入液氮中,随后转入超低温冰箱中保存。剩余的香鱼均分为试验组和对照组,每3尾一组,试验组每尾腹腔注射100 μL鳗利斯顿氏菌悬液(1.0×105CFU/mL PBS),对照组每尾注射100 μL PBS溶液。分别于注射后4、8、12和24 h取样,取样方法同上。
1.2.2 香鱼MIP-2基因序列分析 利用巨噬细胞转录组测序获得香鱼MIP-2基因序列,采用PCR方法从香鱼巨噬细胞cDNA中扩增后测序验证,经分析所获得的序列与转录组测序结果一致[11]。信号肽序列预测采用SignalP 4.0在线软件(http://www.cbs.dtu.dk/services/SignalP/)。用MEGA 4.0软件[12]进行多重序列比对和系统进化树构建,所需基因序列信息,见表1。

表1 基因、物种、登录号信息
1.2.3 香鱼MIP-2基因mRNA的组织表达特征分析采用RNAiso试剂提取香鱼总RNA,随后用DNase I处理,再以oligo(dT)30为引物合成第一条cDNA链。根据MIP-2基因ORF序列设计扩增引物MIP-2-text-F(5'-CAGAGTCCTGATGCTCCTTGC-3')和MIP-2-text-R(5'-CCAGTCTTATCTTGGGGTCGA-3'),预计扩增片段长度为224 bp。以β-actin基因(AB020884)为内参设计引物,pActin2(+)5'-TCGTGCGTGACATCAAGGAG-3'和pActin2(-)5'-CGCACTTCATGATGCTGTTG-3',预期扩增片段长度为231 bp。实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)检测MIP-2基因mRNA在香鱼各组织中的表达变化。
1.2.4 与鳗利斯顿氏菌侵染相关的香鱼各组织MIP-2基因mRNA的表达变化 取腹腔注射后不同时间的香鱼各组织,检测MIP-2基因mRNA表达量的变化。采用实时荧光定量PCR来研究鳗利斯顿氏菌感染过程中香鱼各组织MIP-2基因mRNA转录水平的表达变化情况。由程序MxPro 3.2读取荧光定量结果,结果分析采用相对标准曲线法2-DDCt[13],获得香鱼各组织MIP-2基因mRNA的相对表达量。试验结果采用SPSS单因素方差分析(One-way ANOVA)进行统计,P<0.05为显著差异。
1.2.5 香鱼MIP-2基因的原核表达和抗血清制备 设计原核表达引物pGEX-3X-MIP-2(+)5'-CGCCATGACAACCAGAGTCCTGAT-3'和pGEX-3X-MIP-2(-)5'-GTCAGACTGTGTCTGGAA GCA-3'(下划线限制性内切酶EcoR I和BamH I的识别序列),以香鱼肾组织cDNA为模板,PCR扩增MIP-2基因,预期大小产物(318 bp)经2%(W/V)琼脂糖凝胶电泳分离后,切胶纯化。纯化产物经连接、转化、测序验证等步骤后,用BamH I和EcoR I双酶切,回收的MIP-2片段插入到同样双酶切的pGEX-3X中,获得重组质粒pGEX-3X-MIP-2。转化大肠杆菌BL21 pLys E后IPTG (终浓度0.4 mmol/L)诱导,SDS-PAGE检测。预期大小的蛋白切胶纯化后免疫小鼠,制备抗血清[9]。
1.2.6 蛋白质印迹 12% SDS-PAGE分离胶中分离蛋白,采用湿转法转PVDF膜。转膜结束后用封闭液(含5%脱脂奶粉配制的PBST缓冲液),37℃封闭2 h。一抗(MIP-2小鼠抗血清)4℃孵育过夜,PVDF膜用PBST缓冲液清洗,每次10 min,共3次。随后加入辣根过氧化物酶标记的山羊抗小鼠IgG,37℃孵育1 h。再用PBST清洗,每次10 min,共3次。加上ECL于暗室显影。
2 结果
2.1 香鱼MIP-2基因cDNA序列分析
MIP-2基因开放阅读框的序列长度为318个核苷酸,编码一个由105个氨基酸组成、相对分子质量为11.6 kD的前体蛋白。用Signal P信号肽预测软件预测前体蛋白N端19个氨基酸为信号肽序列,信号肽的剪切位点是第19位的谷氨酰胺(Gln),成熟肽MIP-2预测相对分子质量为9.4 kD。通过多重序列比对分析(图1),可以看到CXC型趋化因子的典型结构区域。

图1 与MIP-2同源的氨基酸序列多重序列比对
氨基酸序列分析表明,香鱼MIP-2与白斑狗鱼(Esox lucius)MIP-2同源性最高,达54%。与其它鱼类MIP-2的同源性介于39%-41%之间,与哺乳动物MIP-2的同源性低于34%。系统进化树(图2)分析揭示,香鱼的MIP-2和其它鱼类中的MIP-2和IL8、IL-8like比较接近,而和哺乳动物的相关基因则相差较远。
2.2 香鱼MIP-2基因mRNA组织表达特征
图3结果显示MIP-2基因mRNA在各组织表达量有差异。健康香鱼MIP-2基因mRNA在脾、肾、脑、鳃组织中表达量较高,在肝、心、肌肉和肠中表达量相对较少。

图2 基于NJ法构建的MIP-2蛋白氨基酸序列系统进化树

图3 香鱼MIP-2基因mRNA的组织表达特征
2.3 鳗利斯顿氏菌侵染后香鱼各组织MIP-2基因mRNA的表达变化
鳗利斯顿氏菌感染香鱼后,鱼鳍基部出现充血发红、 肌肉腐烂等典型的细菌败血症症状,而对照香鱼未出现异常现象。由实时荧光定量PCR结果可知,鳗利斯顿氏菌侵染香鱼后,各组织中MIP-2基因mRNA出现不同程度表达上调。尤其是在肾组织和肌肉组织中上调最显著,最高值分别为对照组的23和25倍。此后表达量上调趋缓,趋向恢复到对照组表达水平。而在心、鳃和肝组织中,8 h的表达量分别为对照组的15.5、13和11倍。其它组织脾、脑、肠中也都呈上调趋势,最高值分别是对照组的5、4.3和6.8倍(图4)。
2.4 香鱼MIP-2基因的原核表达
重组质粒测序验证后,转化进入大肠杆菌BL21 pLys E中,经IPTG诱导表达,在12% SDS-PAGE分离胶中观察到一条约为37 kD的融合蛋白条带(图5-A),与预测的MIP-2融合蛋白相对分子质量吻合(37.3 kD)。该蛋白条带切胶纯化后免疫小鼠,制备抗血清。Western blotting检测抗血清(图5-B)。
3 讨论
系统进化树分析表明,香鱼MIP-2和白斑狗鱼的MIP-2同源性最高,同时和其它鱼类的IL-8、IL8-like也具有较高的同源性。由于转录组测序结果中,我们获得了与IL8同源性更高的序列,因此,暂将该基因命名为MIP-2,其蛋白特性还需进一步验证。此外,据相关文献报道,鼠中的MIP-2和人类的IL8具有很高的同源性[14],而鼠中的IL8一直未发现,所以有可能鼠中的MIP-2和人类中的IL8发挥着同样的作用[15]。
本文研究表明,鳗利斯顿氏菌侵染后,香鱼各组织中MIP-2基因mRNA表达量均出现显著上调,说明MIP-2基因mRNA表达变化与鳗利斯顿氏菌侵染香鱼的急性反应相关。MIP-2基因mRNA与细菌感染相关性文献主要集中对哺乳动物小鼠和大鼠的研究,鱼类暂无相关报道。大肠杆菌感染小鼠肾组织2 h时,MIP-2基因mRNA的表达上调29倍[16]。Rovai等[17]将LPS注射进入小鼠体内后,小鼠肺、心、肝、脾组织MIP-2基因表达均在感染后2 h出现显著上调,随后上调趋势逐渐放缓。由b型流感嗜血杆菌所引起的小鼠脑膜炎病症中,Diab等[18]发现MIP-2基因在感染12 h时上调表达,48 h达到峰值,7 d表达量趋近于正常水平。此外,关于MIP-2参与防御细菌感染的分子机制也有报道。在由克雷伯氏细菌引起的小鼠肺炎中,MIP-2蛋白表达显著上调,同时可调节中性粒细胞抵达肺部清除病菌[19]。大鼠小肠感染病菌后,上皮细胞分泌MIP-2蛋白,调节中性粒细胞进入到小肠以清除病菌[20]。通过对小鼠的研究发现MIP-2发挥免疫功能的机制是趋化中性粒细胞到炎症部位,从而消除炎症反应。因此我们推测,香鱼MIP-2蛋白可能也具有类似机制,但还需进一步验证。
原核表达作为最经典、最成熟的蛋白表达系统被广泛用于分子生物学和基因工程等研究。通过原核表达获得目的蛋白,制备抗血清,进而采用血清学方法检测,为进一步深入研究蛋白功能奠定了基础[21]。因此,本研究通过原核表达获得香鱼MIP-2蛋白,制备香鱼MIP-2抗血清,为研究MIP-2在香鱼抗菌免疫中的作用奠定了基础。
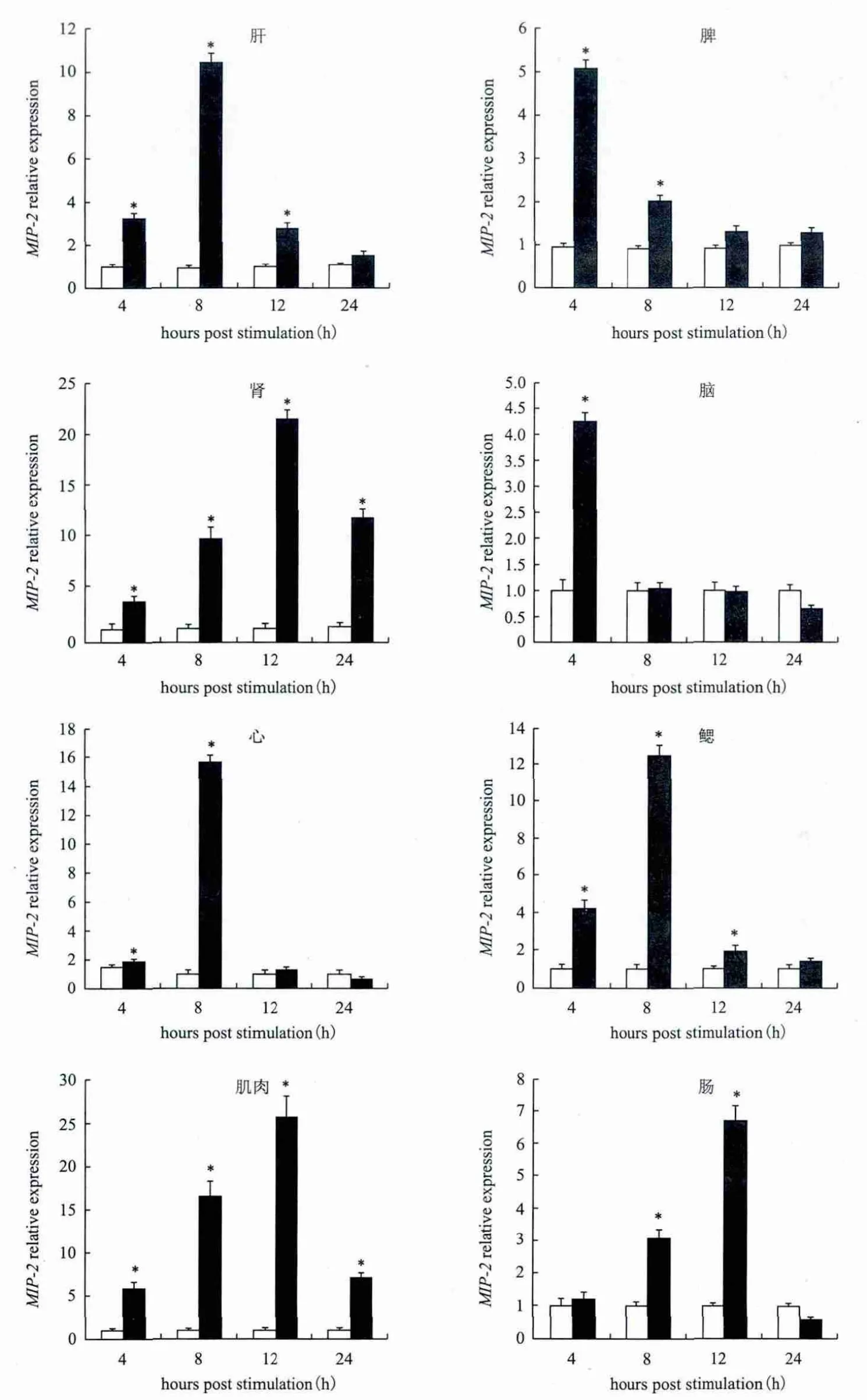
图4 实时荧光定量PCR分析鳗利斯顿氏菌侵染前后香鱼各组织MIP-2基因mRNA表达变化

图5 香鱼MIP-2基因的原核表达的分析(A)SDS-PAGE和抗血清(B)的检测
4 结论
从香鱼巨噬细胞转录组测序结果中获得香鱼MIP-2基因。序列分析表明,香鱼MIP-2具有已知的CXC型趋化因子特征性结构,即含CXC的结构。系统进化树分析表明,香鱼MIP-2和白斑狗鱼的MIP-2同源性最高,同时和其它鱼类的IL-8、IL8-like也具有较高的同源性。组织表达特征研究揭示,健康香鱼MIP-2基因mRNA主要在脾、肾、脑、鳃组织中表达,在肝、心、肌肉、肠组织中表达次之。研究表明,被鳗利斯顿氏菌侵染后,香鱼各组织中MIP-2基因mRNA表达量均出现显著上调,说明MIP-2基因mRNA表达变化与鳗利斯顿氏菌侵染香鱼的急性反应相关。
[1] Wolpe SD, Cerami A. Macrophage inflammatory proteins 1 and 2:members of a novel superfamily of cytokines[J] . Faseb Journal,1989, 3(14):2565-2573.
[2] Wolpe SD, Sherry B, Juers D, et al. Identification and characterization of macrophage inflammatory protein 2[J] . Proceeding s of the National Academy of Sciences, 1989, 86(2):612-616.
[3] Driscoll KE. Macrophage inflammatory proteins:biology and role in pulmonary inflammation[J] . Experimental Lung Research, 1994,20(6):473-490.
[4] Lentsch AB, Yoshidome H, Cheadle WG, et al. Chemokine involvement in hepatic ischemia/reperfusion injury in mice:roles for macrophage in-ammatory protein-2 and Kupffer cells[J] . Hepatology,1998, 27(4):1172-1177.
[5] Melchjorsen J, Sørensen LN, Paludan SR. Expression and function of chemokines during viral infections:from molecular mechanisms toin vivofunction[J] . Journal of Leukocyte Biology, 2003, 74(3):331-343.
[6] 王仲华, 方永祥, 李韧. 巨噬细胞炎性蛋白-2在病毒性心肌炎小鼠中的表达及黄芪的干预作用[J] .心血管医学康复杂志,2011, 20(1):84-88.
[7] Broxmeyer HE, Kim CH. Regulation of hematopoiesis in a sea of chemokine family members with a plethora of redundant activities[J] . Experimental Hematology, 1999, 27(7):1113-1123.
[8] Broxmeyer HE, Sherry B, Lu L, et al. Myelopoietic enhancing effects of murine macrophage inflammatory proteins 1 and 2 on colony formationin vitroby murine and human bone marrow granulocyte/macrophage progenitor cells[J] . The Journal of Experimental Medicine,1989, 170(5):1583-1594.
[9] 黄左安, 陈炯, 陆新江, 等. 鱼凝血因子X基因表达与鳗利斯顿氏菌感染的相关性[J] . 动物学研究, 2011, 32(5):492-498.
[10] 李长红, 陈炯, 史雨红, 李明云. 宁海地区香鱼弧菌病病原菌鉴定[J] . 微生物学报, 2009, 49(7):931-937.
[11] 沈广强, 陈炯, 史雨红, 等. 香鱼IL-12B基因序列及其表达与鳗利斯顿氏菌感染的相关性分析[J] . 中国细胞生物学报,2013, 35(9):1314-1320.
[12] Tamura K, Dudley J, Nei M, Kumar S. MEGA4:Molecular evolutionary genetics analysis(MEGA)software version 4.0[J] .Molecular Biology and Evolution, 2007, 24(8):1596-1599.
[13] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J] .Methods, 2001, 25(4):402-408.
[14] Oquendo P, Alberta J, Wen DZ, et al. The platelet-derived growth factor-inducible KC gene encodes a secretory protein related to platelet alpha-granule proteins[J] . The Journal of Biological Chemistry, 1989, 264(7), 4133-4137.
[15] Feng L, Xia Y, Yoshimura T, Wilson CB. Modulation of neutrophil influx in glomerulonephritis in the rat with anti-macrophage inflammatory protein-2(MIP-2)antibody[J] . Journal of Clinical Investigation, 1995, 95(3):1009-1017.
[16] Roche JK, Keepers TR, Gross LK, et al. CXCL1/KCand CXCL2/MIP-2are critical effectors and potential targets for therapy ofEscherichiacoliO157:H7-associated renal inflammation[J] . Immunopathology and Infectious Disease, 2011, 170(2):526-537.
[17] Rovai LE, Herschman HR, Smith JB. The murine neutrophilchemoattractant chemokinesLIX,KC, andMIP-2have distinct induction kinetics, tissue distributions, and tissue-specific sensitivities to glucocorticoid regulation in endotoxemia[J] .Journal of Leukocyte Biology, 1998, 64(4):494-502.
[18] Diab A, Abdalla H, Li HL, et al. Neutralization of macrophage inflammatory protein 2(MIP-2)andMIP-1α attenuates nervous system during experimental neutrophil recruitment in the central bacterial meningitis[J] . Infection and Immunity, 1999, 67(5):2590-2601.
[19] Greenberger MJ, Strieter RM, Kunkel SL, et al. Neutralization of macrophage inflammatory protein-2 attenuates neutrophil recruitment and bacterial clearance in murine klebsiella pneumonia[J] .The Journal of Infectious Diseases, 1995, 173(1):159-165.
[20] Ohno Y, Lee J, Fusunyan RD, et al. Macrophage inflammatory protein-2:Chromosomal regulation in rat small intestinal epithelial cells[J] . Proceedings of the National Academy of Sciences,1997, 94(19):10279-10284.
[21] Beeler JF, LaRochelle WJ, Chedid M, et al. Prokaryotic expression cloning of a novel human tyrosine kinase[J] . Molecular and Cellular Biology, 1994, 14(2):2982-2988.

