吉富罗非鱼源无乳链球菌Sip-GAPDH融合基因的构建及其原核表达
王蓓 李桂欢 鲁义善 汤菊芬 黄郁葱吴灶和 简纪常
(1.广东海洋大学 水产学院,湛江 524088;2.广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088;3.广东省水产经济动物病害控制重点实验室,湛江 524088;4.仲恺农业工程学院,广州 510225)
罗非鱼,又被称为“白色三文鱼”,是联合国粮农组织推荐的21世纪最有发展前景的淡水养殖品种[1,2]。然而随着高密度养殖和环境日益恶化,病害日趋严重,造成的损失逐年增加。从2009年至今,罗非鱼链球菌病在我国罗非鱼多个主养地区泛滥,发病及死亡率高,并由传统的高温时节发病演变为趋向于全年大部分时间均可发生,发病率和死亡率直线上升(部分地区可高达90%)[3]。
为了预防罗非鱼链球菌病,人们不断地对链球菌病疫苗进行研究和探索。随着分子生物学的发展,通过人工合成或重叠延伸等方法可将几个不同的基因片段相互拼接起来,构成不同蛋白质的融合体,同时展现不同来源蛋白质的活性和功能,甚至可以获得协同效应[4]。表面免疫原性蛋白(Surface immunogenic protein,Sip)是B群链球菌(Group BStreptococcus,GBS)的一种表面蛋白,在GBS 多种血清型的菌株中均有表达,目前该蛋白已在人、小鼠、奶牛及罗非鱼中证实了其具有良好的免疫原性[5-7]。病原微生物中的某些生理代谢作用酶在近年来被作为疫苗和药物的研究靶分子对象[8],甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)便是糖酵解过程中的一种关键代谢酶,在多种病原体中已经进行了其作为保护性抗原的研究并取得了良好的效果[9,10]。
本研究利用重叠延伸PCR技术将罗非鱼源无乳链球菌(Streptococcus agalactiae)Sip基因和GAPDH基因通过特定的Linker序列进行连接,构建无乳链球菌Sip-GAPDH融合基因的原核表达质粒,旨在为研制具有良好保护率的链球菌亚单位疫苗奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株 罗非鱼源无乳链球菌(S. agalactiae)强毒株ZQ0910由本实验室分离保存。
1.1.2 试剂 大肠杆菌DH5α、BL21(DE3)与pET-32a(+)均由本实验室保存。克隆载体pMD18-T购自TaKaRa公司(日本)。表达载体pET-32(a)购自Novagen公司(德国)。限制性内切酶BamH I、SalI、T4 DNA连接酶和Prime STARTMHS DNA polymerase均购自TaKaRa公司(日本)。小鼠抗His-Tag单克隆抗体、辣根过氧化物酶(HRP)标记羊抗鼠IgG和显色底物DAB均为Invitrogen产品(美国)。细菌基因组DNA提取试剂盒为天根生化科技(北京)有限公司产品(中国)。HisTrap HP为GE公司产品(美国)。
1.2 方法
1.2.1 细菌基因组DNA的提取及Sip、GAPDH基因的扩增 按照天根生化科技(北京)有限公司细菌基因组DNA提取试剂盒说明书提取无乳链球菌(S.agalactiae)基因组DNA,根据GenBank上已登录的Sip、GAPDH基因序列(EIM 69670.1、EIM71266.1)设计特异性引物S1/S2和G1/G2,分别引入酶切位点BamH I与SalI,由生工生物工程(上海)股份有限公司合成(表1)。反应条件为:94℃预变性4 min;94℃ 30 s,60℃/57℃(Sip/GAPDH)30 s,72℃ 90 s,共34个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检验后切胶回收,然后克隆入pMD18-T载体,菌落PCR鉴定后将阳性克隆送生工生物工程(上海)股份有限公司测序。

表1 Sip、GAPDH基因的扩增引物
1.2.2 引物设计及基因扩增 根据测序所得到的Sip,GAPDH基因序列,应用Primer5.0软件,设计两对引物P1/P2、P3/P4分别用于扩增准备进行融合的基因,该引物中引入了柔韧性较好的(Gly4Ser)3氨基酸多肽作为linker序列(表2斜体部分)链接两个基因,并在P1/P4引物中分别引入酶切位点BamH I与SalI,由生工生物工程(上海)股份有限公司(表2)。以pMD18-Sip和pMD18-GAPHD质粒为模板,采用引物P1/P2,P3/P4分别扩增Sip和GAPDH基因。PCR体系为:模板2 μL,上下游引物各 1 μL,dNTP Mixture 4 μL,Prime STARTmHS DNA polymerase 0.5 μL,5×Prime STARTMBuffer(Mg+plus)10 μL,ddH2O 31.5 μL。PCR反应条件同1.2.1。
1.2.3Sip与GAPDH基因融合 取Sip与GAPDH回收产物各2 μL混合作为模板,PCR体系为:Sip+GAPDH2 μL+2 μL,10×LA Buffer 5 μL,LA酶1 μL,dNTP Mixture 4 μL,ddH2O 33 μL。PCR反应条件:95℃ 3 min;95℃ 30 s,60℃ 45 s,72℃ 3 min,10个循环;最后向PCR管中补加引物P1、P4和LA酶各1 μL,继续进行PCR循环25个,然后72℃延伸10 min。反应结束后,取5 μL产物用1%琼脂糖凝胶电泳鉴定。然后克隆入pMD18-T载体构建,菌落PCR鉴定后将阳性克隆质粒pMD18-Sip-GAPDH送生工生物工程(上海)股份有限公司测序。

表2 Sip-GAPDH融合基因扩增引物
1.2.4 融合基因的原核表达载体构建 将pMD18-Sip-GAPDH质粒和pET-32a(+)质粒分别采用限制性内切酶BamH I和SalI双酶切,用T4连接酶连接过夜,转入大肠杆菌DH5α感受态细胞中,涂布于含Amp+(100 μg/mL)的LB平板,挑取单个菌落,接种于1mL LB培养基中,37℃振荡培养过夜。PCR菌落及测序鉴定正确后,抽提质粒转入大肠杆菌BL21(DE3)感受态细胞中,再进行PCR菌落和测序检测。将测序结果正确的菌株液以1∶100的比例接种于含Amp+(100 μg/mL)的LB培养基中,37℃振荡培养至OD600为0.4-0.6,加IPTG诱导表达。
1.2.5 诱导表达条件的优化 异丙基-β-D-硫代半乳糖苷(IPTG)的浓度分别为0.02、0.06、0.1、0.4、0.7和1.0 mmol/L,诱导时间为0、1、2、3、4和5 h,诱导温度为28℃和37℃,采用解离非连续缓冲系统垂直板电泳,丙烯酰胺浓度:分离胶12%(V/V),浓缩胶5%(V/V)。每孔上样6 μL,浓缩胶以70V电压跑约20 min,分离胶以140V电压跑约2 h,然后染色、脱色。
1.2.6 目的蛋白纯化和浓度测定及免疫印迹分析 将目的蛋白按最优条件诱导表达后,超声破碎提取融合蛋白,利用HisTrap HP亲和柱纯化融合蛋白,上样细胞裂解液后用不同浓度的咪唑洗脱缓冲液洗柱,得到纯化蛋白,随后将收集到的目的蛋白进行SDS-PAGE分析并进行蛋白浓度测定。纯化的融合蛋白经SDS-PAGE电泳后转至NC膜上,5%脱脂牛奶4℃封闭过夜,加入一抗(鼠抗His单克隆抗体,1∶2 000稀释)孵育1 h,TBST清洗3次,每次10 min;然后,加入二抗(HRP标记的羊抗鼠IgG,1∶500稀释)孵育1 h,再用TBST清洗3次,每次10 min;最后加入DAB显色液,待出现明显条带后用水终止反应。
2 结果
2.1 Sip、GAPDH基因的扩增
PCR扩增后分别得到1 305 bp和1 011 bp的两条特异性条带(图1),克隆入pMD18-T载体,菌落PCR、酶切鉴定正确后测序分析,结果表明,Sip基因含有一个1 305 bp的的开放阅读框(ORF),编码434个氨基酸,预测分子量约为45.6 kD,等电点为6.72,其在GenBank上的登录号为EIM69670.1。GAPDH基因含有一个1 011 bp的开放阅读框(ORF),编码336个氨基酸,预测分子量约为36.01 kD,等电点为5.17,在GenBank上的登录号为EIM71266.1。
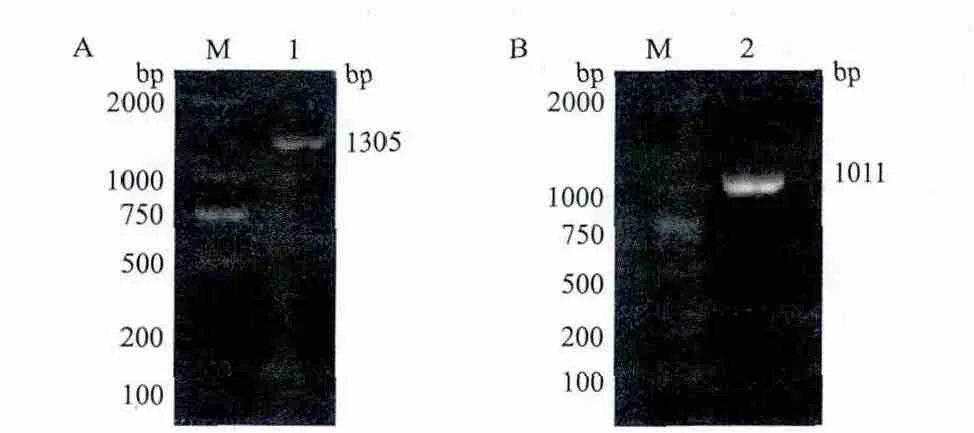
图1 Sip基因(A)和GAPDH基因(B)的PCR产物琼脂糖凝胶电泳图
2.2 Sip-GAPDH融合基因的扩增
通过重叠延伸基因拼接扩增机制扩增出一条长度为2 358 bp的特异性条带,与预期相符,表明已将Sip、GAPDH基因已实现了融合(图2)。
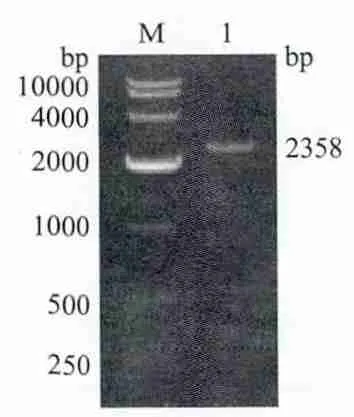
图2 Sip-GAPDH基因的PCR产物琼脂糖凝胶电泳图
2.3 融合基因原核表达重组质粒的构建
将pET-32a(+)质粒与pMD18-Sip-GAPDH质粒经双酶切后连接,构建的原核表达重组质粒命名为pET-32a-Sip-GAPDH。经双酶切鉴定后表明已在pET-32a(+)质粒中插入了一段2 358 bp的序列(图3),结合测序结果确定该原核表达载体构建成功。

图3 重组质粒pET-32-Sip-GAPDH质粒双酶切鉴定
2.4 重组质粒的诱导表达、纯化及Western blot分析
将pET-32a-Sip-GAPDH质粒转化入大肠杆菌BL21(DE3),经优化条件(0.1 mmol/L IPTG,5 h,37℃)诱导后可以表达分子量为102.01 kD左右的融合蛋白(图4,泳道A7、泳道B6、泳道C6),其中Sip-GAPDH的预计分子量为81.61 kD;pET-32a的预计分子量为20.4 kD。未经诱导的含重组质粒pET-32a-Sip-GAPDH的菌体作为阴性对照,诱导后的蛋白电泳带与对照组相比,在102.01 kD处有相应条带(图4)。Western blot(图5)证实pET-32a-Sip-GAPDH重组融合蛋白条带大小与预测结果相一致,说明表达产物能与抗体特异性结合,证实了该蛋白成功表达。
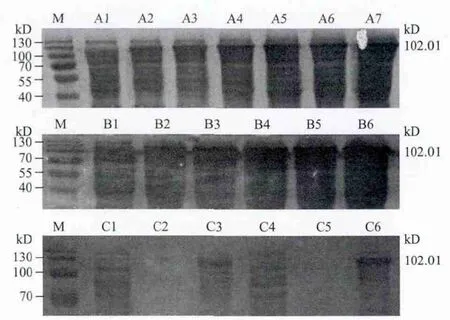
图4 pET-32a-Sip-GAPDH在IPTG浓度(A)、诱导时间(B)和诱导温度(C)表达情况的SDS-PAGE分析

图5 Sip-GAPDH蛋白的Western blot分析
3 讨论
由无乳链球菌引起的罗非鱼链球菌病给我国罗非鱼养殖业造成了巨大的经济损失[11],而现阶段缺乏对罗非鱼源无乳链球菌有效的治疗药物,采用疫苗免疫的策略防控鱼类链球菌病是最有效的途径。寻找有效的疫苗靶蛋白是研制高效渔用疫苗的关键。3-磷酸甘油醛脱氢酶(GAPDH)是一种分布在细胞质中,在糖酵解过程中起关键作用的酶,近年来的研究表明,GAPDH是一种多功能蛋白,参与多种细胞功能的修复及调控[12]。此外,病原体接触到宿主时,GAPDH可以凭借自身的抗氧化功能改变病原体所处的外界环境,减少宿主对病原体产生的氧化毒性作用。因此,GAPDH作为研究疫苗和药物的重要靶分子,引起了业内的关注,目前科学家们已在多种病原生物中进行该基因的免疫原性的研究,并证实了其可作为疫苗候选分子的可能性[13-15]。表面免疫相关蛋白(Sip)是Brodeur等[16]采用免疫学筛选方法从基因库中鉴定出的一种具有高度保护性的蛋白,黎炯等[17]将其应用到免疫吉富罗非鱼中获得了79%-82.6%的保护率。嵌合疫苗是在基因水平上改造病原体,将两种或多种病原体的基因片段用基因工程的方法以不同形式连接或置换,构建一个能表达两种或多种病原体抗原物质的重组基因,然后采用传统方法制备疫苗[18]。近年来此类疫苗的应用范围逐渐扩大,大量的动物试验证明,嵌合疫苗能够增强动物对外来抗原免疫应答反应,具有乐观的应用前景。因此本研究选取了无乳链球菌ZQ0910株中高度保守的Sip与GAPDH基因,成功的通过重叠延伸拼接技术构建了Sip-GAPDH融合基因,并进行原核表达,这为探索该融合基因的免疫原性提供有力的理论依据。
重叠延伸PCR技术(SOEing PCR)是采用具有互补末端的引物,使PCR产物形成重叠链,并能在随后的扩增反应中通过重叠链的延伸,将不同来源的扩增片段重叠拼接起来的技术。该技术的关键是重叠互补引物的设计,Link序列的组成对结构稳定起着关键作用,一般选择氨基酸个数在10-15个碱基,因为Linker序列过长,会在扩增过程中使融合蛋白对蛋白酶敏感,导致产量下降。甘氨酸(Gly)由于分子量小,没有手性碳,是柔性较好的氨基酸,丝氨酸(Ser)是所有氨基酸中亲水性最强的氨基酸,因此本研究中选择大多数沿用的(Gly4Ser)3作为Linker序列[19],郑黎燕等[20]将带有Linker序列与不带Linker序列的融合蛋白进行了比较发现,接头Linker序列对融合蛋白的生物活性没有影响,这为下一步的工作提供了理论支持。此外,为了保证嵌合序列的正确性,有效地校正扩增产物末端的错配碱基,本试验中采用了既具有一般Taq酶5'-3'聚合酶活性,又具有3'-5'核酸外切酶活性的高保真DNA聚合酶来进行扩增,通过测序及后续的表达结果均能证明扩增序列正确性。
pET原核表达载体是有史以来在大肠杆菌中表达重组蛋白功能最强大的系统之一,一旦条件适合,目的蛋白只需诱导几小时,即可表达出占细胞总蛋白量一半以上。利用大肠杆菌表达重组蛋白存在包涵体表达和可溶性表达两种形式,重组蛋白存在于上清中有利于蛋白纯化且大都具有活性。本研究选用表达宿主菌BL21(DE3)和表达载体pET-32a(+),构建无乳链球菌Sip-GAPDH原核蛋白表达系统,通过IPTG诱导及Western blot分析发现表达产物稳定,相对分子质量与预期相符,说明该原核表达系统构建成功。此外,本试验中通过表达得到属可溶性表达的蛋白,为后续试验奠定了良好的基础。
外源蛋白的表达与多种因素有关,如载体、宿主、外源基因及诱导条件。诱导剂、诱导时间及诱导温度是能直接影响蛋白表达的3种关键因子。因此,本试验为获得最优的表达效率,采用了固定其他因子,对单个因子进行不同温度、不同IPTG浓度和不同诱导时间表达后,获得了一个最优化的表达体系。本试验中,IPTG浓度为0.1 mmol/L时,蛋白表达量达到最大,随着IPTG浓度的增加表达量并没有增加,考虑到高浓度的IPTG对大肠杆菌的生长繁殖会有毒性作用,所以选择0.1 mmol/L作为最适诱导浓度。诱导时间不同也会导致表达量的差异,本研究中,当诱导时间再5 h以下时,目的蛋白表达量会随着时间延长而增加,并达到一定的浓度,因此选择了5 h作为最佳诱导时间。此外,本试验中37℃的诱导表达量明显高于其他温度,推测可能与大肠杆菌在37℃时体内酶的活性最大以及T7启动子活性最强有关。通过最佳诱导条件的表达可以得到大量的Sip-GAPDH融合蛋白,该体系的构建为后续需要大量制备蛋白提供了理论基础。此外,免疫印迹实验结果表明,纯化的目的蛋白与鼠抗His-tag单克隆抗体能产生反应,这也从另一个角度佐证了该蛋白的成功表达。
4 结论
本研究采用重叠延伸PCR技术将罗非鱼源无乳链球菌Sip基因和GAPDH基因通过特定的Linker序列进行连接,成功地构建了无乳链球菌Sip-GAPDH融合基因的原核表达载体。
[1] 储霞玲, 曹俊明, 白 雪娜, 等. 2011年广东罗非鱼产业发展现状分析[J] .广东农业科学, 2012(8):12-14.
[2] 雷光英, 曹俊明, 万忠, 等. 2008年度广东省罗非鱼产业发展现状分析[J] .广东农业科学, 2009(7):240-243.
[3] 林庆强.罗非鱼的链球菌病防治[J] .科学养鱼, 2010(11):56.
[4] 章辉, 朱荫昌, 司进, 等.日本血吸虫复合B细胞表位抗原的制备和鉴定[J] .中国寄生虫学与寄生虫病杂志, 2007, 25(4):285-289.
[5] Rioux S, Martin D, Ackermann HW, et al. Localization of surface immunogenic protein on group B streptococcus[J] . Infection and Immunity, 2001, 69(8):5162-5165.
[6] Manning SD, Wood S, Kasha K, et al. Naturally occurring antibodies for the group B streptococcal surface immunogenic protein(Sip)in pregnant women and newborn babies[J] . Vaccine, 2006, 24(47):6905-6912.
[7] 布日额, 郎景民, 刘娣, 等.奶牛无乳链球菌内蒙古分离株SIP基因的克隆与序列分析[J] .黑龙江畜牧兽医, 2009, 9:71-72.
[8] 张咏莉, 吴德, 余新炳.华支睾吸虫3-磷酸甘油醛脱氢酶重组蛋白的纯化、酶学活性及免疫学研究[J] .中国寄生虫学与寄生虫病杂志, 2005, 23(4):231-235.
[9] Hannaert V, Oppendoes FR, Michels PA. Glycosomal glyceraldehydes-3-phosphate dehydrogenase ofTrypanosoma bruceiandTrypanosoma cruziexpression inEscherichia coli, purification and characterization of the enzyme[J] . Protein Expression and Purification,1995, 6:244-250.
[10] Hannaert V, Blaauw M, Kohl L, et al. Molecular analysis of the cytosolic and glycosomal glyceraldehydes-3-phosphate dehydrogenase inLeishmania mexicana[J] . Molecular and Biochemical Parasitology, 1992, 55(1-2):115-126.
[11] 张新艳, 樊海平, 钟全福, 等.罗非鱼无乳链球菌的分离, 鉴定及致病性研究[J] .水产学报, 2008, 32(5):772-779.
[12] 尚海旭, 井然, 贾弘禔, 等. GAPDH功能多样性[J] .生理科学进展, 2011, 42(5):371-374.
[13] Yang HW, Yong TS, Lee JH, et al. Characterization of two glyceraldehydes-3-phosphate dehydrogenase genes inGiardia lamblia[J] . Parasitology Research, 2002, 88:646-650.
[14] Shin GW, Palaksha KJ, Kim YR, et al. Immunoproteomic analysis of capsulate and non-capsulate strains ofLactococcus garvieas[J] . Veterinary Microbiology, 2007, 119(2-4):205-212.
[15] Rayyan W, Kuntz DA, Opperdoes FR, et al. 1992. Expression inBacillus subtilisof the glycosomal glyceraldehydes phosphate dehydrogenase gene fromTrypanosoma brucei[J] . Biochimie,1992, 74(2):137-141.
[16] Brodeur BR, Boyer M, Charlebois I, et al. Identification of group B streptococcal Sip protein, which elicits cross-protective immunity[J] . Infection and Immunity, 2000, 68(10):5610-5618.
[17] 黎炯, 叶星, 可小丽, 等.罗非鱼无乳链球菌Sip基因的克隆,表达及免疫原性分析[J] .水生生物学报, 2012, 36(4):626-633.
[18] 庄敏, 李迪, 谷鸿喜.病毒嵌合疫苗的研究进展[J] .国外医学免疫学分册, 2004, 27(3):137-141.
[19] 刘岩, 于涟.基因融合技术及其应用[J] .农业生物技术学报,2006, 14(2):127-132.
[20] 郑黎燕, 奚永志, 孔繁华, 等.重组人IL-6D24-PE40外毒素融合蛋白的构建及其生物学效应[J] .中华微生物学和免疫学杂志, 2001, 21(1):95-98.

