新型非金属光催化剂
--石墨型氮化碳的研究进展
范乾靖,刘建军,于迎春,左胜利
(北京化工大学化工资源有效利用国家重点实验室,北京 100029)
新型非金属光催化剂
--石墨型氮化碳的研究进展
范乾靖,刘建军,于迎春,左胜利
(北京化工大学化工资源有效利用国家重点实验室,北京 100029)
石墨型氮化碳(g-C3N4)聚合物是一种具有合适禁带宽度(2.7eV)的新型非金属有机半导体光催化剂,它具有良好的热稳定性和化学稳定性。本文介绍了石墨型氮化碳的结构、理化性质和合成方法,重点阐述了进一步提高石墨型氮化碳光催化活性的方法,包括形貌调控、掺杂改性、共聚合改性和硫介质调控。并论述了石墨型氮化碳在可见光下催化分解水和降解有机污染物方面的应用现状。最后指出进一步探索和优化石墨型氮化碳的合成及改性方法,提高其光催化性能依然是g-C3N4在光催化领域应用的研究重点。
氮化碳;催化剂;太阳能;制氢;降解
随着世界人口的迅猛增加和工业化程度的不断提高,日益严峻的环境污染和能源短缺问题成为人类社会面临的重要挑战之一。光催化反应在太阳能的驱动下,既可以催化降解各类污染物,又可以催化分解水生成氢气和氧气,是一种绿色、高效、能解决能源和环境污染问题的有效方法。在各种光催化剂材料中,TiO2以其廉价、无毒、氧化能力强、稳定性好等特点,成为目前研究最多和应用最广的半导体光催化剂之一。但是因其具有较大的禁带宽度(3.0~3.2eV),只能在紫外光驱动下发生有效的光催化反应,而紫外光只占太阳能总能量的 4%左右,这限制了TiO2在实际应用中对太阳能的大规模利用。因此设计研发新型、高效且具有可见光响应的光催化半导体材料是一个重要的研究方向。
近年来的研究发现,氮化碳(C3N4)是一种新型可见光响应的非金属光催化剂[1-2]。氮化碳主要由碳和氮组成,是一种有机聚合物。关于氮化碳的研究最早可追溯到1834年,Liebig[3]在实验室合成一种由碳和氮组成的聚合衍生物,并命名为“melon”(C6N9H3)。20世纪40~80年代初,人们试图通过对硫氰酸盐、三嗪[(C3N3)n,triazine]和七嗪[(C6N7)n,heptazine]等化合物进行热解制备氮化碳,但都未能得到明确的晶体结构。又由于这种物质的化学惰性和不溶解性,其准确化学结构一直不能确定,所以在后来很长的一段时间里被人们遗忘。直到 1989年,Cohen等[4]通过理论计算提出了β-C3N4的结构,并预言它的硬度可以和金刚石相媲美。这一预测使得大量的研究工作投入到高密度 β-C3N4的合成当中。但迄今为止,这种超硬材料还没有在实验室被合成出来。
进一步的理论计算[5]表明,氮化碳存在的物相还可能有α相、立方相(c-C3N4)、准立方相(pc-C3N4)和类石墨相(g-C3N4)等,其中,类石墨相在常温常压下是最稳定的相,具有半导体特性。与传统的金属催化剂相比,石墨型氮化碳具有稳定性高、耐酸碱和便于改性等优点,在催化领域有广阔的应用前景。如已发现g-C3N4可以催化Friedel-Crafts反应、CO2的活化反应、烯烃和腈的环化反应等一些重要的有机反应。而Wang等[6]发现用Pt作为共催化剂,g-C3N4在可见光下可光催化分解水制得H2,这又掀起了g-C3N4作为一种非金属光催化剂的研究热潮。但是由于g-C3N4本身存在比表面积小、对可见光响应范围窄、光生电子-空穴对快速复合、光量子效率低等缺陷,所以其光催化效率很低。研究者用不同的方法对其改性,包括共聚合改性、硫介质调控、形貌调控和掺杂改性等。研究表明,这些方法都可以在一定程度上提高g-C3N4的光催化活性。本文将简单介绍 g-C3N4的分子结构、理化性质和合成方法,并对其改性方法和光催化制分解水和降解有机污染物的应用进行了总结和概述。
1 氮化碳的结构和性质
1.1 g-C3N4的分子结构
理论预测氮化碳的 5种相结构(β-C3N4、α-C3N4、c-C3N4、pc-C3N4和 g-C3N4)中,g-C3N4的结合能最低,在常温常压下最稳定。在目前的实验条件下,人们只能合成得到石墨型氮化碳,其他相的合成结果则存在诸多争议。石墨型氮化碳得名于其具有类似于石墨的层状结构,且其层间距d= 0.326nm。然而,g-C3N4的基本结构单元又存在着triazine和tri-s-triazine两种争论,如图1所示[7]。Kroke等[7]依据密度泛函理论(DFT)计算表明,tri-s-triazine的结合能要比triazine小30 kJ/mol,结构更稳定,所以一般认为tri-s-triazine是g-C3N4的基本单元。
1.2 g-C3N4的理化性质
氮化碳独特的分子结构使其具有特殊的理化性质,不同物相的理化性质各有不同,本文主要介绍石墨型氮化碳的理化性质。g-C3N4的结构与石墨相似,层与层之间的范德华力使其具有良好的热稳定性和化学稳定性。具体表现为g-C3N4在空气中加热到 600℃也不分解,不溶于水、乙醇、丙酮、二氯化碳和N,N-二甲基甲酰胺等很多常见的溶剂。同时g-C3N4还具有耐强酸和强碱性,在pH=1的HCl溶液和pH=14的NaOH溶液中也依然稳定[8]。

图1 g-C3N4的两种可能的结构单元组成
此外,g-C3N4又是一种有机半导体材料[9],表现出优良的光电特性。氮化碳固体对紫外可见光的吸收截止波长约在420nm,对应的带宽为2.7eV。不同制备条件对氮化碳的截止波长略有影响,包括反应前体的选择、煅烧温度的控制等。g-C3N4能发射蓝色荧光,最强荧光峰在470nm,荧光寿命在1~5ns。g-C3N4的半导体特性使其具有成为新型太阳能转换材料的潜力,如光电化学电池。图2是g-C3N4和TiO2的价带和导带位置的对比图[10]。从图2可以看出 g-C3N4价带和导带的位置完全覆盖了水的氧化-还原电位,因此理论上 g-C3N4既可以氧化水制得氧气,又可以还原水得到氢气。
2 氮化碳合成方法
早期人们用类似合成金刚石的高温高压法制备β-C3N4,但是由于N≡N键稳定性高,很容易形成,当温度升高到一定程度,氮就会以N2分子的形式逸出。大多数情况下得到的都是贫氮的碳氮材料,所以合成理论预测的化学计量比的氮化碳是一项巨大的挑战。在实验过程中,偶然得到的g-C3N4给研究者提供了新的思路,希望通过相变来制备高密度β-C3N4,前提是能够合成较多的g-C3N4,所以,此后研究的重点转移到合成相对容易的g-C3N4。
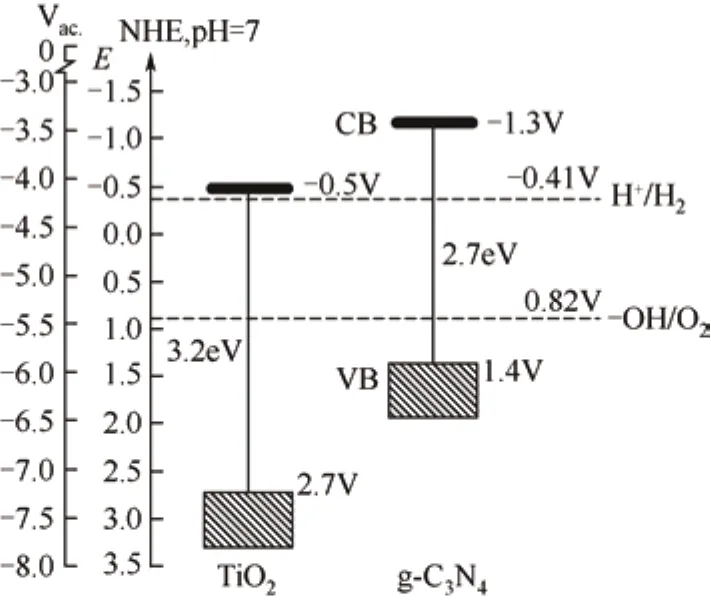
图2 g-C3N4和TiO2的电子带隙结构对比图
研究者尝试用各种不同的方法[11]在实验室中合成 g-C3N4,包括高温高压法、物理气相沉积法(PVD)、化学气相沉积法(CVD)、溶剂热合成法和高温热解法等。其中,高温高压法和气相沉积法会使大量氮以N2分子的形式流失,使产物氮含量很低,且制备的氮化碳大多是非晶态。相对而言,高温热解法和溶剂热法具有一定的优势,一些课题组用这两种方法合成了结晶度较好,碳氮比接近理论值(0.75)的g-C3N4。如Yan等[12]直接煅烧(500~580℃)三聚氰胺,制得了结晶良好、碳氮比在0.721~0.742的g-C3N4。Guo等[13]以苯为溶剂,三聚氰氯和氨基钠为原料,180~220℃下反应 8~12h,制得了碳氮比为0.72的g-C3N4。由于高温热解法合成步骤简单经济,目前常用该方法制备g-C3N4。高温热解法的转化步骤如图3所示(以热解氰胺为例)[11],当温度达到 350℃时,氰胺通过脱氨基缩聚为三聚氰胺,继续升温至 390℃,三聚氰胺重排形成2,5,8-三氨基-3-三嗪(melem),melem在 520℃左右开始继续脱胺缩聚形成网状目的产物——g-C3N4。继续升高温度,发现g-C3N4在600℃时开始分解,到700℃时完全分解。
事实上,人工合成理论预测结构的g-C3N4仍然是一项巨大的挑战。迄今为止,实验室中合成的g-C3N4与理想的无限延伸的网状 g-C3N4还有一定差距,存在较多的结构缺陷并含有一定量的氢。然而,又恰好是这种缺陷使g-C3N4的结构边缘含有氨基,从而具有更高的活性,所以人们将研究重点从纯制备转移到了g-C3N4的应用上。但是,探索具有理想结构氮化碳的合成路线依然是目前氮化碳研究的重要课题。

图3 以氰胺作原料制备g-C3N4的合成路线
3 氮化碳的改性
3.1 形貌调控
虽然 g-C3N4作为新型催化剂具有稳定、耐高温、合适的能带结构等优点,但由于其比表面积只有约10m2/g,大大制约了其在催化领域的应用。众所周知,不同形貌特征的催化剂具有不同的比表面积和不同的催化活性中心,通过增大比表面积可使活性位点增多,催化效率提高。因此合成具有更大比表面积的介孔氮化碳(mpg-C3N4)是提高g-C3N4催化活性的重要方法之一。目前,介孔氮化碳的合成方法主要有硬模板法和软模板法。
3.1.1 硬模板法
硬模板法合成 mpg-C3N4的基本路线是:以介孔二氧化硅为模板,与制备氮化碳的有机前体充分混合,通过高温煅烧使有机前体转化为氮化碳聚合物,再用HF或NH4HF2除去模板,即可得到具有介孔结构的mpg-C3N4。
Vinu等[14]用四氯化碳和乙二胺分别作碳源和氮源,SBA-15为模板,首次合成了比表面积为505m2/g的介孔氮化碳(MCN-1),其孔结构见图4[14]。XRD图[图4(c)]在27.2°处出现了表明g-C3N4类石墨层状堆积结构的特征衍射峰,对应的层间距d=0.342nm,比理论值(0.326nm)略大,且其峰形宽、强度低,表明合成氮化碳结晶度较低。但是,MCN-1的碳氮比约为5,远高于理论值(0.75),表明在合成过程中有较多的氮流失。为了提高氮含量,该研究小组做了大量研究,结果发现:增大乙二胺和四氯化碳的投料比[15]可将 mpg-C3N4碳氮比降至3.3;改用IBN-4为模板[16],碳氮比可降至2.3;改用氨基胍作反应前体,得到了碳氮比在0.6的富氮mpg-C3N4,但比表面积也随之降至 300m2/g[17]。Goettmann等[18]选用40%的SiO2(粒径12nm)水溶液作模板,氰胺为反应前体,成功合成了比表面积为86~439m2/g、碳氮比为0.71(接近理论值0.75)的mpg-C3N4。这是因为这种水溶液模板能够与反应前体氰胺充分混合,使模板的结构得到完全的复制。从图5 SiO2纳米颗粒制备的mpg-C3N4的TEM图中可以看出,其孔结构分布均匀有序,XRD图中也出现了g-C3N4的特征衍射峰,层间距d=0.326nm,与理论值相符[18]。

图4 MCN-1的HRTEM图和XRD图

图5 以SiO2纳米颗粒为模板制备的mpg-C3N4的TEM图和XRD图
由此可见,反应前体中的氮含量和反应前体与模板的结合度是影响 mpg-C3N4碳氮比的两个重要因素,而模板的孔结构则对 mpg-C3N4的比表面积和孔结构有决定性的作用。所以 Kailasam 等[19]尝试用溶胶-凝胶法直接合成了比表面积为167m2/g、碳氮比为0.67的mpg-C3N4;Park 等[20]不用水溶液,直接用熔融的氰胺浸润SBA-15模板,制得比表面积为361m2/g、碳氮比为0.89的mpg-C3N4。而最近,Zhang等[21]发现,用熔融的氰胺浸润盐酸酸化后的SBA-15,经超声处理后煅烧可将比表面积提高至517m2/g,与模板SBA-15相近。这说明该方法可以使氰胺完全进入模板的孔道中,从而更好地实现模板孔结构的复制。
此外,研究者们希望得到具有不同孔结构的介孔氮化碳,如采用KIT-6、IBN-9、INC-2等作模板和尿素、苯二胺、甲醛等作反应前体合成了具有不同孔结构的mpg-C3N4。最近,Sun等[22]用硬模板法合成了比表面积为 35~80m2/g的空心纳米球形结构的氮化碳,其壳壁厚度为 28~85nm。但是到目前为止,只有以 SiO2水溶液为模板和用熔融的氰胺直接浸润 SBA-15的方法是两种合成 mpg-C3N4较成熟的方法,所制得的 mpg-C3N4具有高比表面积,同时碳氮比又接近理论值。所以,探索具有不同孔结构、碳氮比接近理论值的 mpg-C3N4的合成方法还将是硬模板法的研究重点。
3.1.2 软模板法
硬模板法合成 mpg-C3N4步骤繁琐,且需要用腐蚀性很强的HF或NH4HF2除去模板,这对实际操作和保护环境是不利的,所以研究者们希望找到一种可以用软模板直接合成mpg-C3N4的方法。Wang等[23]首次尝试用软模板法合成 mpg-C3N4,并选用Triton X-100、P123、F127、Brij30、Brij58和Brij76为模板剂,做了系列的合成反应。实验中发现,由于氮化碳的聚合温度接近或高于模板剂的分解温度,致使模板剂提前分解而不能形成预期的介孔结构。但通过严格控制升温过程,可以得到较好的结果,如用Triton X-100作模板剂得到了较好的介孔结构[图 6(a)][23],其比表面积按模板剂的比例不同为16~116m2/g,平均孔径为 3.8nm。另一方面,有机模板剂在煅烧过程成会造成一定量的碳沉积,导致碳氮比较高(>1)。其后,该研究小组[24]用BmimBF4作为软模板,用双氰胺(DCDA)作为反应前体,合成了具有海绵状结构的mpg-C3N4[图6(b)][23]。其比表面积为444m2/g,孔容为0.32cm3/g,碳氮比为0.65。这种掺有少量B和F的mpg-C3N4对环己烷氧化成环己酮的反应具有高效、高选择性的催化作用。Yan[25]用Pluronic P123 表面活性剂作模板剂,改用三聚氰胺作反应物,制得了具有不规则蠕虫状孔结构的氮化碳,其比表面积可达90m2/g,碳氮比为0.68。

图6 介孔氮化碳的TEM图
软模板法因为存在合成的 mpg-C3N4比表面积较小、孔结构分布不均匀且不易控制等诸多问题,所以研究进展缓慢,是 mpg-C3N4合成的难点。但是,其操作步骤简单、环境友好等优点依然吸引着研究者们的兴趣。
3.1.3 其他方法
最近报道了一些不用模板,而通过其他手段直接合成 mpg-C3N4的方法,如以尿素[26]和硫脲[27]为原料,直接在空气中煅烧,煅烧过程中生成的气体会以鼓泡的方式使g-C3N4形成孔结构。这种方法可制得比表面积为27~97m2/g的mpg-C3N4,但是产率很低。Jun等[28]用三聚氰胺和三聚氰酸在二甲基亚砜溶液中进行自组装,形成一种平均粒径在 2~3μm的球型超分子复合物,再对这种物质进行煅烧,制得比表面积在 45~77m2/g的 mpg-C3N4。Yang等[29]用溶剂剥离的方法制备了比表面积高达384m2/g的mpg-C3N4。这些无模板直接合成介孔氮化碳的新方法虽然得到的比表面积较小且孔结构不规则,但是它们既可避免硬模板法繁琐的合成步骤和对环境的危害性,又可以避免软模板法中模板剂分解残留的问题,这为介孔氮化碳的制备提供了新的思路。
3.2 掺杂改性
常规合成的g-C3N4除比表面积小外,还存在由于光生电子和空穴快速复合导致量子效率较低的问题;另一方面,其可见光响应范围<420nm,对太阳光能量中可见光的吸收也显不足。通过元素掺杂可以有效改变g-C3N4的电子结构,增大其对可见光的吸收范围,由此调节和拓宽其应用范围和催化性能。贵金属沉积或与合适的半导体复合形成异质结,在光催化反应中可以更有效地分离光生电子和空穴对,提高光催化效率。
3.2.1 非金属元素掺杂
Liu等[30]在450℃下将g-C3N4置于流动的H2S气氛中1h,得到S掺杂的g-C3N4,发现S取代N掺入g-C3N4骨架中。由于S的电负性(2.58)较N的电负性(3.04)小,当其均匀地分布于g-C3N4骨架中后,可以提高价带的上沿和导带的下沿,总体上使g-C3N4的带宽由2.73eV增大至2.85eV;同时S的这种掺杂使g-C3N4的比表面积由12m2/g提高至63m2/g,使g-C3N4的催化活性大为提高。在光解水制氢的反应中,S掺杂的g-C3N4生成氢气的速度较掺杂前提高了近8倍。Wang等[31]对B、F掺杂的g-C3N4进行了深入的研究,以NH4F为F源与DCDA制得F掺杂的g-C3N4(CNF)。实验表明F已掺入氮化碳的骨架中,形成了C—F键,使部分sp2C转化为sp3C并导致g-C3N4的平面结构不规整。此外,随着F掺入量的增多,CNF在可见光区的吸收范围随之扩大,而对应带宽可由2.69eV降至2.63eV。他们又以 BH3NH3为 B源合成 B掺杂的 g-C3N4(CNB)[32],通过表征发现B的掺入是取代g-C3N4结构中的C原子。B可作为一种强Lewis酸性位点,而g-C3N4本身的N又是Lewis碱性位点,从而使CNB具有酸碱双功能特性。最近,Lin等[33]选用四苯硼钠为B源,在引入B的同时,又因苯的离去基团作用使氮化碳形成薄层结构,层厚度仅为 2~5nm,可降低光生电子到达表面所需要消耗的能量,从而提高光催化效率。Zhang等[34]发现 P可进入g-C3N4的骨架中取代C,并形成P—N键,明显改变了g-C3N4的电子结构,使其在可见光区的吸收范围拓展到800nm。
综上可见,由于元素种类的相似性,非金属元素一般均可掺杂进入g-C3N4的骨架中,但具有不同离子半径和电负性的非金属元素的掺杂会不同程度改变g-C3N4的价带结构和光电性质,从而为g-C3N4的性质调变提供了多种可能。
3.2.2 贵金属沉积
Ge等[35]用化学沉积的方法将Ag纳米颗粒均匀地负载到g-C3N4的表面上,发现随着Ag含量的增加,Ag/g-C3N4对可见光的吸收范围和强度都有所增大,使催化效率提高,如光催化降解甲基橙的效率较g-C3N4提高了23倍。这是由于Ag的负载可促进光生电子-空穴对的分离和转移,降低了它们的复合概率。此外,Datta等[36]发现mpg-C3N4可以作为一种载体合成高分散、粒径小于7nm的Au纳米颗粒,原因是 mpg-C3N4一方面可通过限域作用调控Au纳米颗粒的尺寸;另一方面,其表面的—NH2和—NH基团可起到固定剂的作用,从而使Au纳米颗粒充分分散,而不发生聚集。Wang等[37]用这种方法在mpg-C3N4上成功负载了粒径为2~4nm的超细Au、Pt和Pd纳米颗粒,并且尺寸均一、分布均匀。实验表明,这种复合体在光解水制氢方面具有更优异的催化性能。最近,Li等[38]发现,Pd纳米颗粒负载的氮化碳可催化碘苯和苯硼酸发生的Suzuki反应。在室温、可见光照射下,就可以实现很高的转化率(100%)和选择性(97%)。
由此可见,与贵金属沉积能够提高g-C3N4的光催化性能,而 mpg-C3N4则在调控金属纳米颗粒尺寸同时,又使其均匀分散在表面,这将使mpg-C3N4的催化活性得到进一步提高。此外,过渡金属掺杂也能提高g-C3N4的催化性能,如Yue等[39]用g-C3N4和ZnCl2溶液混合搅拌,干燥焙烧后得到Zn掺杂的氮化碳。发现其对可见光的吸收强度明显增大,光催化分解水制氢的产率提高了近10倍。
3.2.3 与其他半导体复合形成异质结
近来,有关g-C3N4和其他材料复合形成异质结的报道很多。如Ge等[40]将g-C3N4和CdS量子点复合后发现对可见光的吸收范围可扩展到550nm,荧光强度较g-C3N4大幅度降低,表明光生电子和空穴的复合概率大大降低,催化效率高于其中任何一个单组分。Fu等[41]用 BiOBr和 g-C3N4复合,形成BiOBr-C3N4异质结,可以有效地分离并转移光生电荷。这种异质结结构光催化降解罗丹明B的催化效率较BiOBr提高了4.9倍,较g-C3N4提高了17.2倍,并且稳定性很好,8次循环使用后活性依然没有降低。Liu等[42]制得的g-C3N4/ZnO异质结的光催化活性和稳定性较任何一个单组分都高。Hou等[43]将同样具有层状结构的MoS2和g-C3N4结合,制得了 MoS2/mpg-CN异质结,发现在同样的条件下,其光催化还原水制H2的效率高于Pt/mpg- CN。而最近Ye等[44]用g-C3N4和Fe2O3复合制备了具有磁性的 CN-Fe2O3异质结,这种催化剂可从溶液中快速分离,分离成本大为降低。
这些都表明通过其他半导体复合形成异质结可有效地分离光生电子和空穴对,不同程度地提高g-C3N4的光催化效率。而且,与不同材料的复合可以实现更多的功用,如提高催化剂的稳定性和简化分离步骤等,在提高g-C3N4催化性能的同时拓展其应用范围。
3.3 共聚合改性和硫介质调控法
有机共聚反应会对产物的结构和性质产生影响。Zhang等[45]用双氰胺和巴比妥酸发生共聚反应,合成的氮化碳对可见光的吸收范围增加至750nm,电流转移效率提高了4倍。之后又选用苯环上连有氨基或氰基等一系列有机物(26种)[46]作为共聚合前体与双氰胺共聚合成g-C3N4。其中,氨基苯甲腈(ABN)共聚所得的g-C3N4对光催化分解水的效率最高。同时发现不同的共聚前体会不同程度地改变g-C3N4的比表面积、层间堆积的结构参数,而含有氨基、氰基的有机物则具有将其他官能团转移到g-C3N4表面的作用。
Zhang等[47]还发现,通过硫介质调控的方法可以实现对g-C3N4的改性,如当用硫代三聚氰酸为原料合成g-C3N4的过程中,由于—SH离去基团的作用能调变g-C3N4的形貌结构和电价结构。实验证明通过这种硫介质调控法方法制得的g-C3N4(CNS)的边缘具有锁扣样折叠结构,可使比表面积增大到约60m2/g,其价带和导带的位置同时下移,如图7所示[47]。这使得CNS的光催化还原水制H2的效率提高到 g-C3N4的12倍,氧化水制备 O2的效率为g-C3N4的5倍。之后,该课题组[48]以硫单质为熔剂(熔点为115.2℃,沸点为444.6℃),三聚氰胺为原料合成g-C3N4,其中硫熔剂一方面可以使反应物分子分散;另一方面,硫单质的歧化反应利于—NH2的离去而促进g-C3N4的缩聚反应。实验表明这种方法所得到的 g-C3N4也在一定程度上同时提高了其光催化制 H2、O2的效率。这充分说明硫介质调控法对g-C3N4光催化活性的改性作用。
4 氮化碳光催化的应用
4.1 光催化分解水
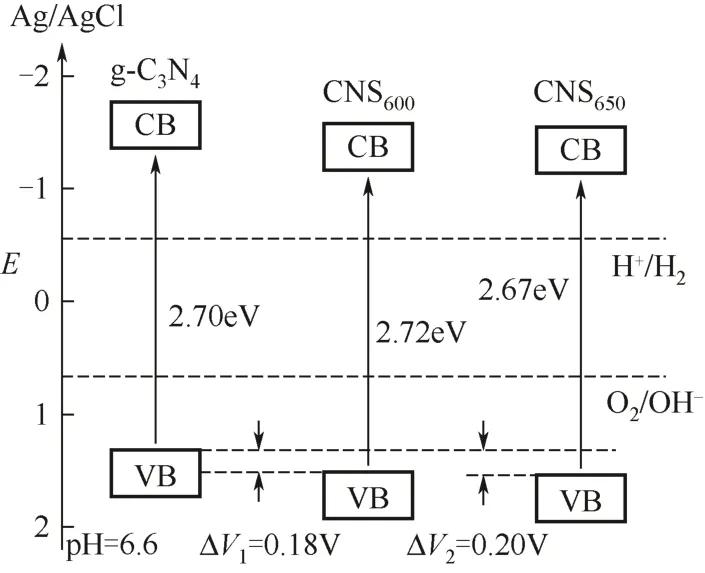
图7 g-C3N4、CNS600和CNS650的价带结构
在可见光下催化分解水生成H2,是直接将太阳能转化为清洁燃料的方法,是解决人类所面临的能源、环境和生态等重大问题的最理想方法。而研发和选择合适的光催化剂又是最关键的一步,迄今已发现很多金属化合物具有催化该反应的能力,但离实际应用还有很大的差距。g-C3N4因其特殊的价带结构,具有在可见光下催化分解水的潜能。Wang等[6]在2009年首次验证了 g-C3N4作为一种非金属光催化剂能在可见光下催化分解水。g-C3N4在可见光的照射下,以铂为共催化剂,三乙醇胺作牺牲剂,可稳定地生成氢气;而当以氧化钌作共催化剂时,可生成氧气。然而光催化氧化水制氧的催化活性比还原制氢低很多,这可能和g-C3N4的价带位置有关(图2),前者较后者的驱动力低很多。光催化制氢的催化活性非常稳定,多次循环也不衰减,但是其量子产率却很低,在420~460nm的光照下仅为0.1%,这是由于光生电子和空穴对快速复合的原因。
之后,大量的研究工作尝试通过不同的方法提高 g-C3N4的量子产率,如前面已经提到的形貌调控、元素掺杂与其他半导体形成异质结等都可以提高g-C3N4光催化还原水制氢的效率。而染料敏化作用也是提高g-C3N4光催化效率的一种有效方法。如Takanabe等[49]用酞青镁(MgPc)和mpg-C3N4复合制得 MgPc/mpg-C3N4,可见光响应范围扩展到900nm之外,使其在可见光下催化还原水制氢的效率大为提高,而且在λ>600nm波长的光照下还可以继续产生氢气。最近 Wang等[50]用多种染料与g-C3N4作用,进一步验证了染料敏化作用可大大提高g-C3N4在可见光下催化还原水的效率。如将赤鲜红(ErB)加入反应后,g-C3N4的最高量子产率在460nm可达到33.4%。
g-C3N4光催化还原水制氢的效率在通过多种改性方法得到提高时,其光催化氧化水制O2的效率多数情况下却不能同步提高。然而,Zhang等[47-48]用硫介质调控法制备的 CNS却可以同时提高光催化分解水的两个半反应,这是因为CNS的价带位置降低的缘故,如图7所示。又用Mo3O4和CNS制备Mo3O4/CNS异质结[51],进一步提高了光催化氧化水制氧的效率,表观量子产率可以达到 1.1%(λ=420nm)。最近Lee等[52]在此基础上,改用钴基磷酸盐催化剂(CoPi)和 mpg-C3N4复合形成mpg-C3N4-CoPi,发现所合成的杂相催化剂在光强为100mW/cm2的可见光照射下生成氧气的速率最优可达到1mmol/(h·g),是mpg-C3N4的400倍。
4.2 光催化降解有机污染物
光催化降解污染物是一种清洁高效处理有机污染物的方法,而在可见光下实现多种污染物的降解是目前光催化领域研究的难点和热点。Yan等[12,53]用g-C3N4在可见光下降解甲基橙(MO)和罗丹明B(RhB),实验表明,降解MO主要是光电子的还原作用,而降解RhB则是光生空穴的氧化作用。这说明 g-C3N4在可见光下既可以通过光生电子还原作用也可以通过光生空穴的氧化作用降解有机污染物。Dong等[54]用碳自掺杂法和Liu等[55]用ZnO与g-C3N4复合法改性后的氮化碳均可以同时催化氧化RhB和还原 Cr(VI),也充分说明了这一点。Cui等[56]和 Lee等[57]发现,mpg-C3N4在可见光下还可降解苯酚和对氯苯酚。最近,Dong等[58]将甲酸根离子(FA)插入g-C3N4的层间形成FA-g-C3N4复合物,将在可见光下催化还原 Cr(VI)由两步(e-+ O2—→·O2-;·O2-还原)变为一步(e-直接还原),反应效率大为提高。原因是FA离子一方面可以消耗光生空穴,促进光还原过程;另一方面,FA离子的插入可提高复合物的表面电势。
5 结论与展望
氮化碳作为一种新型的非金属光催化剂,具有独特的电子结构和合适的价带位置,又具有很高的热稳定性和化学稳定性以及价廉、环保等优点,近几年在光电催化反应中的报道迅速增加,在光催化领域有广阔的应用前景,已成为目前一个新的研究热点。
目前在实验室得到的石墨相氮化碳与理论预测的理想晶体结构还有较大差距,其他一些被预测存在的具有诸多优异理化性能的高密度相还未被实验合成,所以不同相组成氮化碳本身的合成方法依然是值得继续研究的课题。在改性方面,通过引入有序介孔结构、非金属元素掺杂、贵金属沉积、与其他半导体复合等方法可以提高g-C3N4的催化性能。其中,引入孔结构方法又分硬模板法、软模板法和无模板法,硬模板法步骤繁琐且需用对环境有害的HF或NH4HF2来除去模板,软模板法和无模板法简单环保,但却不易得到有序的孔结构。非金属元素如B、F、P、S等均可掺杂进入g-C3N4的骨架中,使其带宽变窄,可见光响应范围增大,而贵金属沉积和与其他半导体的复合,则可促进光生电子和空穴分离,从而提高光电效率。同时,这种掺杂、沉积和复合的方法可不同程度地改变催化剂的价带结构以提高其催化性能。
综上,本文作者认为有关氮化碳未来的研究重点有:①继续探索不同相组成氮化碳的合成方法;②用简单环保的方法(软模板法或无模板法)来合成具有规整孔结构的介孔氮化碳;③通过掺杂、沉积或复合等方法来调控催化剂的能带结构,提高其对不同催化反应体系的适用性及催化活性;④发现新的改性方法并深入探讨g-C3N4的光催化机理。
[1] Wang Y,Wang X,Antonietti M. Polymeric graphitic carbon nitride as a heterogeneous organocatalyst: From photochemistry to multipurpose catalysis to sustainable chemistry[J].Angewandte Chemie-International Edition,2012,51:68-89.
[2] Wang X,Blechert S,Antonietti M. Polymeric graphitic carbon nitride for heterogeneous photocatalysis[J].ACS Catalysis,2012,2(8):1596-1606.
[3] Liebig J. Uber einige stickstoff - verbindungen[J].Annalen Der Pharmacie,1834,10(1):1-47.
[4] Liu A Y,Cohen M L. Prediction of new low compressibility solids[J].Science,1989,245(4920):841-842.
[5] Teter D M,Hemley R J. Low-compressibility carbon nitrides[J].Science,1996,271(5245):53-55.
[6] Wang X,Maeda K,Thomas A,et al. A metal-free polymeric photocatalyst for hydrogen production from water under visible light[J].Nature Materials,2009,8(1):76-80.
[7] Kroke E,Schwarz M,Horath-Bordon E,et al. Tri-s-triazine derivatives. Part Ⅰ. From trichloro-tri-s-triazine to graphitic C3N4structures[J].New Journal of Chemistry,2002,26(5):508-512.
[8] Gillan E G. Synthesis of nitrogen-rich carbon nitride networks from an energetic molecular azide precursor[J].Chemistry of Materials,2000,12(12):3906-3912.
[9] Deifallah M,Mcmillan P F,Cora F. Electronic and structural properties of two-dimensional carbon nitride graphenes[J].The Journal of Physical Chemistry C,2008,112(14):5447-5453.
[10] Cui Y,Ding Z,Liu P,et al. Metal-free activation of H2O2by g-C3N4under visible light irradiation for the degradation of organic pollutants[J].Physical Chemistry Chemical Physics,2012,14(4):1455-1462.
[11] Thomas A,Fischer A,Goettmann F,et al. Graphitic carbon nitride materials:Variation of structure and morphology and their use as metal-free catalysts[J].Journal of Materials Chemistry,2008,18(41):4893-4908.
[12] Yan S C,Li Z S,Zou Z G. Photodegradation performance of g-C3N4fabricated by directly heating melamine[J].Langmuir,2009,25(17):10397-10401.
[13] Guo Q,Xie Y,Wang X,et al. Characterization of well-crystallized graphitic carbon nitride nanocrystallitesviaa benzene-thermal route at low temperatures[J].Chemical Physics Letters,2003,380:84-87.
[14] Vinu A,Ariga K,Mori T,et al. Preparation and characterization of well-ordered hexagonal mesoporous carbon nitride[J].Advanced Materials,2005,17(13):1648-1652.
[15] Vinu A. Two-dimensional hexagonally-ordered mesoporous carbon nitrides with tunable pore diameter,surface area and nitrogen content[J].Advanced Functional Materials,2008,18(5):816-827.
[16] Jin X,Balasubramanian V V,Selvan S T,et al. Highly ordered mesoporous carbon nitride nanoparticles with high nitrogen content:A metal-free basic catalyst[J].Angewandte Chemie,2009,121(42):8024-8027.
[17] Talapaneni S N,Mane G P,Mano A,et al. Synthesis of nitrogen-rich mesoporous carbon nitride with tunable pores,band gaps and nitrogen content from a single aminoguanidine precursor[J].Chem. Sus. Chem.,2012,5(4):700-708.
[18] Goettmann F,Fischer A,Antonietti M,et al. Chemical synthesis of mesoporous carbon nitrides using hard templates and their use as a metal-free catalyst for friedel–crafts reaction of benzene[J].Angewandte Chemie-International Edition,2006,45(27):4467-4471.
[19] Kailasam K,Epping J D,Thomas A,et al. Mesoporous carbon nitride-silica composites by a combined sol-gel/thermal condensation approach and their application as photocatalysts[J].Energy & Environmental Science,2011,4(11):4668-4674.
[20] Park S S,Chu S,Xue C,et al. Facile synthesis of mesoporous carbon nitrides using the incipient wetness method and the application as hydrogen adsorbent[J].Journal of Materials Chemistry,2011,21(29):10801-10807.
[21] Zhang J,Guo F,Wang X. An optimized and general synthetic strategy for fabrication of polymeric carbon nitride nanoarchitectures[J].Advanced Functional Materials,2013,23(23):3008-3014.
[22] Sun J,Zhang J,Zhang M,et al. Bioinspired hollow semiconductor nanospheres as photosynthetic nanoparticles[J].Nature Communications,2012,3:1139.
[23] Wang Y,Wang X,Antonietti M,et al. Facile one-pot synthesis of nanoporous carbon nitride solids by using soft templates[J].Chem. Sus. Chem.,2010,3(4):435-439.
[24] Wang Y,Zhang J,Wang X,et al. Boron- and fluorine-containing mesoporous carbon nitride polymers:Metal-free catalysts for cyclohexane oxidation[J].Angewandte Chemie,2010,122(19):3428-3431.
[25] Yan H. Soft-templating synthesis of mesoporous graphitic carbon nitride with enhanced photocatalytic H2evolution under visible light.[J].Chemical Communications,2012,48(28):3430-3432.
[26] Dong F,Wu L,Sun Y,et al. Efficient synthesis of polymeric g-C3N4layered materials as novel efficient visible light driven photocatalysts[J].Journal of Materials Chemistry,2011,21(39):15171-15174.
[27] Zhang Y,Liu J,Wu G,et al. Porous graphitic carbon nitride synthesizedviadirect polymerization of urea for efficient sunlight-driven photocatalytic hydrogen production[J].Nanoscale,2012,4(17):5300-5303.
[28] Jun Y,Lee E Z,Wang X,et al. From melamine-cyanuric acid supramolecular aggregates to carbon nitride hollow spheres[J].Advanced Functional Materials,2013,23(29):3661-3667.
[29] Yang S,Gong Y,Zhang J,et al. Exfoliated graphitic carbon nitride nanosheets as efficient catalysts for hydrogen evolution under visible light[J].Advanced Materials,2013,25(17):2452-2456.
[30] Liu G,Niu P,Sun C,et al. Unique electronic structure induced high photoreactivity of sulfur-doped graphitic C3N4[J].Journal of the American Chemical Society,2010,132(33):11642-11648.
[31] Wang Y,Di Y,Antonietti M,et al. Excellent visible-light photocatalysis of fluorinated polymeric carbon nitride solids[J].Chemistry of Materials,2010,22(18):5119-5121.
[32] Wang Y,Li H,Yao J,et al. Synthesis of boron doped polymeric carbon nitride solids and their use as metal-free catalysts for aliphatic C—H bond oxidation[J].Chemical Science,2011,2(3):446-450.
[33] Lin Z,Wang X. Nanostructure engineering and doping of conjugated carbon nitride semiconductors for hydrogen photosynthesis[J].Angewandte Chemie International Edition,2013,52(6):1735-1738.
[34] Zhang Y,Mori T,Ye J,et al. Phosphorus-doped carbon nitride solid:Enhanced electrical conductivity and photocurrent generation[J].Journal of the American Chemical Society,2010,132(18):6294-6295.
[35] Ge L,Han C,Liu J,et al. Enhanced visible light photocatalytic activity of novel polymeric g-C3N4loaded with Ag nanoparticles.[J].Applied Catalysis A-General,2011,409-410:215-222.
[36] Datta K K R,Reddy B V S,Ariga K,et al. Gold nanoparticles embedded in a mesoporous carbon nitride stabilizer for highly efficient three-component coupling reaction[J].Angewandte Chemie International Edition,2010,49(34):5961-5965.
[37] Li X,Wang X,Antonietti M. Mesoporous g-C3N4nanorods as multifunctional supports of ultrafine metal nanoparticles:Hydrogen generation from water and reduction of nitrophenol with tandem catalysis in one step[J].Chemical Science,2012,3(6):2170-2174.
[38] Li X,Baar M,Blechert S,et al. Facilitating room-temperature suzuki coupling reaction with light:Mott-schottky photocatalyst for C-C-coupling[J].Scientific Reports,2013,3:1743.
[39] Yue B,Li Q Y,Lwai H,et al. Hydrogen production using zinc-doped carbon nitride catalyst irradiated with visible light[J].Science and Technology of Advanced Materials,2011,12(3):34401.
[40] Ge L,Zuo F,Liu J,et al. Synthesis and efficient visible light photocatalytic hydrogen evolution of polymeric g-C3N4coupled with CdS quantum dots[J].The Journal of Physical Chemistry C,2012,116(25):13708-13714.
[41] Fu J,Tian Y,Chang B,et al. Biobr-carbon nitride heterojunctions:Synthesis,enhanced activity and photocatalytic mechanism[J].Journal of Materials Chemistry,2012,22(39):21159-21166.
[42] Liu W,Wang M,Xu C,et al. Significantly enhanced visible-light photocatalytic activity of g-C3N4viaZnO modification and the mechanism study[J].Journal of Molecular Catalysis A:Chemical,2013,368-369:9-15.
[43] Hou Y,Laursen A B,Zhang J,et al. Layered nanojunctions for hydrogen-evolution catalysis[J].Angewandte Chemie International Edition,2013,52(13):3621-3625.
[44] Ye S,Qiu L,Yuan Y,et al. Facile fabrication of magnetically separable graphitic carbon nitride photocatalysts with enhanced photocatalytic activity under visible light[J].Journal of Materials Chemistry A,2013,1(9):3008-3015.
[45] Zhang J,Chen X,Takanabe K,et al. Synthesis of a carbon nitride structure for visible-light catalysis by copolymerization[J].Angewandte Chemie International Edition,2010,49(2):441-444.
[46] Zhang J,Zhang G,Chen X,et al.Co-monomer control of carbon nitride semiconductors to optimize hydrogen evolution with visible light[J].Angewandte Chemie International Edition,2012,51(13):3183-3187.
[47] Zhang J,Sun J,Maeda K,et al. Sulfur-mediated synthesis of carbon nitride: Band-gap engineering and improved functions for photocatalysis[J].Energy & Environmental Science,2011,4(3):675-678.
[48] Zhang J,Zhang M,Zhang G,et al. Synthesis of carbon nitride semiconductors in sulfur flux for water photoredox catalysis[J].ACS Catalysis,2012,2(6):940-948.
[49] Takanabe K,Kamata K,Wang X,et al. Photocatalytic hydrogen evolution on dye-sensitized mesoporous carbon nitride photocatalyst with magnesium phthalocyanine[J].Physical Chemistry Chemical Physics,2010,12(40):13020-13025.
[50] Wang Y,Hong J,Zhang W,et al. Carbon nitride nanosheets for photocatalytic hydrogen evolution:Remarkably enhanced activity by dye sensitization[J].Catalysis Science & Technology,2013,3(7):1703-1711.
[51] Zhang J,Grzelczak M,Hou Y,et al. Photocatalytic oxidation of water by polymeric carbon nitride nanohybrids made of sustainable elements[J].Chemical Science,2012,3(2):443-446.
[52] Lee R, Tran P D, Pramana S S, et al. Assembling graphitic-carbon-nitride with cobalt-oxide-phosphate to construct an efficient hybrid photocatalyst for water splitting application[J].Catalysis Science & Technology,2013,3(7):1694-1698.
[53] Yan S C,Li Z S,Zou Z G. Photodegradation of rhodamine B and methyl orange over boron-doped g-C3N4under visible light irradiation[J].Langmuir,2010,26(6):3894-3901.
[54] Dong G,Zhao K,Zhang L. Carbon self-doping induced high electronic conductivity and photoreactivity of g-C3N4[J].Chemical Communications,2012,48(49):6178-6180.
[55] Liu W,Wang M,Xu C,et al. Facile synthesis of g-C3N4/ZnO composite with enhanced visible light photooxidation and photoreduction properties[J].Chemical Engineering Journal,2012,209:386-393.
[56] Cui Y,Huang J,Fu X,et al. Metal-free photocatalytic degradation of 4-chlorophenol in water by mesoporous carbon nitride semiconductors[J].Catalysis Science & Technology,2012,2(7):1396-1402.
[57] Lee S C,Lintang H O,Yuliati L. A urea precursor to synthesize carbon nitride with mesoporosity for enhanced activity in the photocatalytic removal of phenol[J].Chemistry – An Asian Journal,2012,7(9):2139-2144.
[58] Dong G,Zhang L. Synthesis and enhanced Cr(VI) photoreduction property of formate anion containing graphitic carbon nitride[J].The Journal of Physical Chemistry C,2013,117(8):4062-4068.
Research progress in a new metal-free photocatalyst——graphitic carbon nitride
FAN Qianjing,LIU Jianjun,YU Yingchun,ZUO Shengli
(State Key Laboratory of Chemical Resource Engineering,Beijing University of Chemical Technology,Beijing 100029,China)
Polymeric graphitic carbon nitride,g-C3N4,is a new organic photocatalyst with semiconductor property and proper band gap of 2.7eV,which possesses high thermal and chemical stability. In this paper,the structure,physicochemical properties and preparation methods of g-C3N4are reviewed. As the photocatalytic activity of g-C3N4is generally low,the methods to make it an effective photocatalyst are summarized,including texture modification,elements doping and constructing heterojunction with other materials,copolymerization and sulfur-mediated function. In addition,the applications of g-C3N4for photocatalytic water splitting and degradation of organic water pollutants under visible light are discussed. At the end,it can be concluded that the developing tendency of g-C3N4as a photocatalyst is exploring and further optimizing the preparation and modification methods to improve its photocatalytic activity.
carbon nitride;catalyst;solar energy;hydrogen production;degradation
O 643
A
1000-6613(2014)05-1185-10
10.3969/j.issn.1000-6613.2014.05.018
2013-11-20;修改稿日期:2013-12-30。
国家自然科学基金项目(10972025)。
范乾靖(1989—),男,博士研究生。联系人:刘建军,副教授,博士生导师。E-mail jjliu717@aliyun.com。
——潘桂棠光生的地质情怀

