高温与干旱胁迫对匍匐翦股颖抗氧化代谢的影响
曲亚楠,杨志民
高温与干旱胁迫对匍匐翦股颖抗氧化代谢的影响
曲亚楠1,杨志民2*
1.南京农业大学园艺学院,江苏南京210095
2.南京农业大学草业学院,江苏南京210095
以冷季型草坪草匍匐翦股颖(Agrostis stolonifera L.)L-93为材料,在人工气候箱内对L-93进行短期(9 d)高温、干旱以及高温干旱复合胁迫处理,研究不同胁迫处理对叶片相对含水量(RWC)、相对电导率(EL)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)活性以及丙二醛(MDA)含量的影响。结果表明,在不同胁迫处理下,L-93叶片SOD活性均出现先上升后下降的趋势;POD、CAT和APX活性随处理时间的延长而降低。双重胁迫对植株抗氧化酶系统造成的伤害最为严重,短时间内造成植物体内MDA含量与EL值的迅速上升。
抗氧化酶系统;匍匐翦股颖;双重胁迫;高温;干旱
匍匐翦股颖(Agrostis stolonifera L.)为禾本科翦股颖属多年生草本植物,作为常见的冷季型草坪草,广泛应用于园林绿化与运动场建设[1,2]。作为开放环境下的植物体系,草坪草在生长的过程中往往会面临多种环境因子的胁迫。匍匐翦股颖属于C3植物[3],绿期长、耐寒性较强,耐热性较差;其耐旱性与多年生黑麦草等冷季型草坪草相比较差。在我国气候过渡地区,夏季持续高温,降水不均,温度和水分条件的不适宜成为该草坪草种在这一地区生长的主要限制因素[4]。
近年来,已有一些高温干旱双重胁迫对草坪影响的报道[5,6]。万里强等[7]选取多年生黑麦草作为试验材料,观察了叶绿体和线粒体超微结构的变化,结果显示,耐热抗旱性较强的品种叶绿体受损程度较轻。刘晓军等[8]以苇状羊茅为材料,研究了干热胁迫下,苇状羊茅对不同水肥条件的响应机理。目前,关于双重胁迫对匍匐翦股颖生理生化反应影响的研究较少。本研究利用人工气候箱模拟干旱与高温环境,观察和比较在不同胁迫下,冷季型草坪草匍匐翦股颖叶片相对含水量、相对电导率、丙二醛含量以及抗氧化酶活性的变化规律,为今后的冷季型草坪草抗逆性研究提供一定的理论依据。
1 材料与方法
1.1材料
挖取生长2年的L-93健康草皮块,种入直径20 cm,高18 cm的塑料盆里预培养。采用草炭与洗净的河沙(草炭:沙=2:1)作为盆栽基质。预培养期间,每周施用一次1/2倍的Hoagland's营养液,每3 d浇透水1次,修剪高度5 cm。
1.2试验处理
试验设4个处理,分别为对照(CK)、干旱(D)、高温(H)、高温+干旱(HD),其中每个处理包括4个重复。材料培养至长势良好覆盖均匀一致时,转入人工气候箱内适应性生长7 d后开始处理。箱内环境条件设置为:箱内湿度50%,光强12000 lux,光周期12 h。材料处理方法如下:对照(CK):昼夜温度25/15℃,每3 d浇水一次,直至容器底部有水分流出;高温处理(H):昼夜温度35/25℃,每3 d浇水一次,每次500 mL/盆;干旱处理(D):昼夜温度25/15℃,自然干旱,不浇水;高温+干旱处理(HD):昼夜温度35/25℃,自然干旱,不浇水。分别于0 d、3 d、6 d、9 d取样。
1.3测定指标及方法
1.3.1 叶片相对含水量(RWC)剪取第二叶位新鲜叶片0.2g,wf;将取得的叶片组织浸泡于去离子水中24h,取出用吸水纸擦干表面水分,称取其饱和重wt;随后将叶片转移至80℃烘箱内烘至恒重,冷却至室温后称取其干重,wd[9]。试验称量使用天平为Sartorius BSA323S型,量程0~220 g,精度0.001 g。相对含水量=(wf—wd)/(wt—wd)*100%
1.3.2 叶片相对电导率(EL)采取相对电导率法[10],取第二叶位新鲜叶片0.2 g,浸泡于装有去离子水的50mL离心管中,震荡24h后测定电导率值,E0;随后将离心管放入水浴中,煮沸后测定电导率值,Eb。相对电导率=E0/Eb*100%。
1.3.3 丙二醛(MDA)含量丙二醛(MDA)含量测定,采用李合生的巴比妥酸(TBA)显色法测定[10]。
1.3.4 抗氧化物酶活性取叶片0.5g,加入液氮研磨成粉末状后溶解于4mL磷酸缓冲液(pH 7.8,0.05 mol/L),在4℃、12000 r/min下离心20 min,得到的上清液放入4℃条件下保存,用于测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)的活性。
SOD活性采取氮蓝四唑(NBT)还原法测定[11]:取50 μL酶液,加入混合反应液含0.05 mol/L磷酸缓冲液、0.13 mol/L Met溶液、750 μmol/LNBT溶液、100 μmol/LEDTA-Na2溶液、20 μmol/L核黄素溶液,以不加酶液作为对照,测量560 nm处的吸光值。
POD活性通过愈创木酚法测定[10]:取40 μL酶液,加入反应液含50 mL 0.2 mol/L pH 6.0的磷酸缓冲液、28 μL磷愈创木酚、19 μL 30%H2O2溶液,以磷酸缓冲液作对照,测量470 nm处的吸光值。
CAT活性的测定[6]:取0.1 mL酶液,加入2.9 mL反应液,以磷酸缓冲液作对照,测定1 min内240 nm处吸光值的变化。反应液中含有100 mL0.05 mol/L pH 7.0的磷酸缓冲液、0.1546 mL 30%H2O2溶液。
APX活性的测定[12,13]:取0.1 mL酶液,加入2.6 mL含0.1 mmol/L EDTA-Na2的磷酸缓冲液(0.05 mol/L,pH 7.0)、0.15 mL 15 mmol/L的抗坏血酸溶液、0.1 mL 20 mmol/L的H2O2溶液,测量290 nm处吸光值在1 min内的变化[10]。
试验测定使用的紫外分光光度计为美国通用GE Ultrospec 9000型。
1.4试验数据处理
以不同的处理条件作为变量,采用SPSS13.0对试验数据进行单因素的方差分析,利用LSD法检验差异显著性(P<0.05)。
2 结果与分析
2.1叶片相对含水量的变化
叶片相对含水量(RWC)用于衡量植物体内的水分状况。如图1所示,干旱处理3~6 d,叶片含水量下降至46.2%,与对照相比差异显著(P<0.05);高温胁迫下,L-93叶片RWC下降时间较晚,处理9 d时由97%下降到27%。高温干旱复合胁迫3 d条件下,L-93叶片RWC与对照相比下降趋势显著,由0 d 94%降低至15%;处理3~9 d,L-93叶片RWC下降趋势减缓。
结果表明,受不同胁迫影响,L-93叶片RWC呈明显下降趋势。处理9 d条件下,L-93叶片RWC由高到低依次是:对照处理、高温处理、干旱处理、双重胁迫处理。
2.2叶片相对电导率

图1 不同胁迫对叶片相对含水量的影响(CK:对照;D:干旱;H:高温;HD:高温+干旱)Fig.1 Relative water content was affected by drought(D), heat(H)and combined stresses(HD)in leaves of‘L-93'

图2 不同胁迫对叶片相对电导率的影响(CK:对照;D:干旱;H:高温;HD:高温+干旱))Fig.2 Electrolyte leakage was affected by drought(D),heat(H) and combined stresses(HD)in leaves of creeping bentgrass
高温或干旱会引起植物细胞膜的功能损伤,叶片相对电导率(EL)可以说明植物叶片细胞膜的受损程度[14]。图2表明,在处理3~6d期间,干旱处理的EL值从37.1%显著增加至82.8%。高温处理0~6 d,L-93叶片EL值上升缓慢;处理6 d后叶片EL值升高速度明显加快。高温干旱胁迫下叶片EL值升高速度明显高于其他处理,并在处理6d后趋于稳定。处理第9 d,高温干旱处理与干旱处理下L-93叶片EL值无显著差异。
结果表明,受不同胁迫影响,L93叶片EL值与对照相比均呈明显的上升趋势;不同处理间L-93叶片EL值上升幅度存在显著;高温胁迫对L-93叶片细胞膜稳定性造成的影响最小。
2.3丙二醛含量
丙二醛(MDA)含量的变化是判断植物细胞膜脂过氧化程度的重要指标。如图3所示,干旱处理0~3 d期间,L-93 MDA含量与对照相比没有显著差异;处理3~9 d,L-93叶片MDA含量由2.7 mmol/mg·FW上升至16.2 mmol/mg·FW,与对照相比差异显著。受高温胁迫影响,L-93叶片MDA含量出现明显上升趋势的时间较晚;胁迫6~9 d,L-93 MDA含量由2.7 mmol/mg·FW上升至15.5 mmol/mg·FW。在高温干旱复合胁迫下,L-93叶片中MDA上升趋势显著,由0 d条件下的2.6 mmol/mg·FW上升至9 d的50.8 mmol/mg·FW。
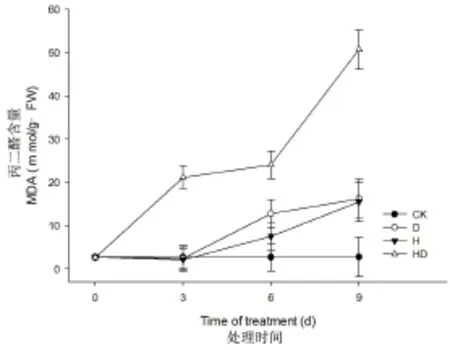
图3 不同胁迫对丙二醛(MDA)含量的影响(CK:对照;D:干旱;H:高温;HD:高温+干旱)Fig.3 MDAwas affected by drought(D),heat(H) and combined stresses(HD)in leaves of‘L-93’

图4 不同胁迫对超氧化物歧化酶(SOD)活性的影响(CK:对照;D:干旱;H:高温;HD:高温+干旱)Fig.4 SOD activity in‘L-93'in response to drought (D),heat(H)and combined stresses(HD)
结果表明,受高温或干旱胁迫影响,L-93叶片中MDA含量的变化没有显著差异(P>0.05)。高温干旱双重胁迫下,MDA含量上升幅度显著高于其他处理。
2.4叶片抗氧化酶活性
如图4所示,受胁迫影响,不同处理L-93叶片中SOD活性呈明显的先上升后下降的趋势。处理0~3 d,L-93叶片SOD活性由高到低依次是高温干旱复合胁迫、干旱胁迫、高温胁迫和对照处理,不同处理间L-93叶片SOD活性存在显著差异(P<0.05)。
由图5可以看出,与对照处理相比,不同胁迫条件下L-93叶片POD活性均随处理时间的增加呈降低趋势。处理3 d,受高温干旱双重胁迫影响,L-93叶片POD活性下降幅度最大,由22.1 μmol-1.mg-1.protein下降至10.9 μmol-1.mg-1.protein。与其他处理相比存在显著差异(P<0.05)。处理0~6 d,高温胁迫和干旱胁迫处理的L-93叶片POD活性变化趋势一致,处理间差异不显著(P>0.05)。处理9 d,L-93受双重胁迫与高温胁迫影响,其叶片POD活性差异不显著。
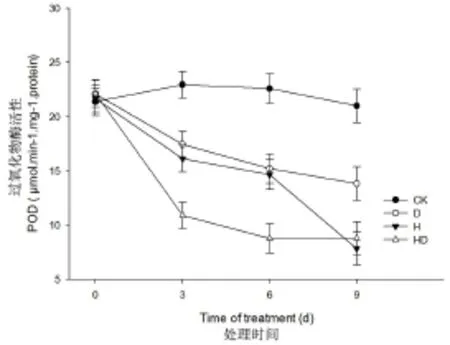
图5 不同胁迫对过氧化物酶(POD)活性的影响(CK:对照;D:干旱;H:高温;HD:高温+干旱)Fig.5 POD activity in‘L-93'in response to drought (D),heat(H)and combined stresses(HD)

图6 不同胁迫对过氧化氢酶(CAT)活性的影响(CK:对照;D:干旱;H:高温;HD:高温+干旱)Fig.6 CAT activity in‘L-93'in response to drought (D),heat(H)and combined stresses(HD)
由图6可以看出,L-93叶片CAT活性随胁迫时间的延长呈逐渐降低的趋势。处理3~9 d期间,与干旱胁迫相比,高温胁迫对L-93叶片CAT活性影响不显著。双重胁迫造成的L-93叶片CAT活性下降幅度最大,与其他处理相比差异显著(P<0.05)。
图7表明,受高温胁迫影响,L-93叶片APX活性呈先上升后下降的趋势;高温处理第3 d,L-93叶片APX活性与对照相比没有显著差异(P>0.05)。L-93叶片APX活性受干旱胁迫影响呈持续降低的趋势;干旱处理3~9 d,APX活性显著低于对照处理。L-93受双重胁迫影响,叶片APX活性下降幅度最大,由0 d条件下的19.6μmol-1.mg-1.protein降低至9 d的5.1 μmol-1.mg-1.protein。处理9 d条件下,叶片APX活性由高到低依次是对照、高温处理、干旱处理、双重胁迫处理,处理间差异显著(P<0.05)。
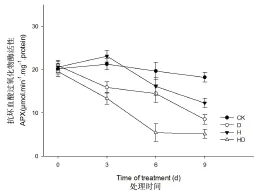
图7 不同胁迫对抗坏血酸过氧化物酶(APX)活性的影响(CK:对照;D:干旱;H:高温;HD:高温+干旱)Fig.7APX activity in‘L-93'in response to drought(D),heat(H)and combined stresses(HD)
3 讨论
叶片组织内水分状况的稳定有利于维持植物体内正常生理生化反应的运行[15]。Yiwei等[13]对冷季型草坪草耐热性与抗旱性的研究认为,高温与干旱会引起植物叶片短时间内蒸腾作用加强,在造成细胞脱水的同时对叶片表面起到一定的降温保护作用;而持续的高温和干旱会导致膜脂过氧化反应的发生。本研究结果表明,在高温、干旱以及双重胁迫影响下,L-93叶片RWC较对照均显著降低。L-93受单一干旱胁迫影响,叶片RWC下降幅度显著高于高温处理。L-93叶片水分对干旱胁迫的响应更敏感。高温处理下的L-93能较长时间保证叶片相对含水量的稳定,延缓了胁迫对其它生理结构造成伤害。
植物细胞膜系统的稳定性对于维持逆境下的细胞结构与功能的完整性有着重要的作用[14]。研究表明,植物叶片EL值的变化可以反映细胞膜受损的程度[16,17]。在高温干旱胁迫下,L-93叶片EL值急剧上升,说明植株细胞膜透性在高温与干旱的双重影响下稳定性遭到严重损坏,而在单一高温或干旱胁迫的影响下,L-93叶片EL值升高幅度减小,单一胁迫对其细胞膜透性的影响要显著弱于双重胁迫。匍匐翦股颖L-93叶片相对电导率的变化趋势与MDA含量的变化较为一致。
植物遭受逆境胁迫时,体内活性氧的积累会造成细胞伤害甚至死亡[18]。逆境下植物维持体内抗氧化酶活性的能力是影响其生存的重要因素之一[19]。SOD在植物体内的主要作用是催化活性氧分解形成H2O2与O2[11,20]。逆境胁迫下,植物组织中活性氧含量的上升会诱导SOD活性增强。本研究结果表明,0~3 d的各胁迫对叶片SOD活性起到了显著诱导作用。在高温干旱双重胁迫条件下,SOD活性变化最明显。分析认为,双重胁迫下L-93叶片SOD活性的变化可能与叶片中活性氧含量的上升有关。处理3~9 d,受干旱胁迫与双重胁迫影响,L-93叶片SOD活性的快速下降与植物光合作用减弱或酶降解有关。
POD主要用来催化H2O2与酚类的反应,同时与CAT共同作用催化H2O2形成水,从而有效减少活性氧的积累[21,22]。CAT在植物体内的主要作用是清除H2O2,防止植株衰老[23]。本研究结果表明,L-93叶片POD与CAT活性对高温与干旱胁迫的响应较为敏感;处理开始后,两种酶的活性快速下降。APX作为植物叶绿体抗坏血酸-谷胱甘肽(AsA-GSH)循环的关键酶,可以有效清除叶绿体内的H2O2[12]。处理9 d条件下,L-93叶片APX活性与对照相比下降明显。POD、CAT与APX活性的下降会引起细胞中H2O2含量的上升,从而造成叶绿素含量降低与细胞脂质过氧化,严重时会导致植物细胞死亡。
丙二醛(MDA)是膜脂过氧化的最终产物,其含量可以用于衡量草坪草所受逆境胁迫的程度[24]。大量的MDA积累会造成膜系统损伤,加深逆境对植株造成的伤害[16]。在不同胁迫的影响下,L-93叶片内MDA含量均迅速上升;处理3~9 d期间,各处理L-93叶片中SOD、POD、CAT与APX活性呈显著下降趋势,分析认为过氧化物清除系统的功能损伤是造成MDA含量增加的主要原因。由于相对较高水平的RWC与抗氧化酶活性,L-93叶片MDA含量受单一高温或干旱胁迫影响上升幅度小于双重胁迫。
综上所述,高温、干旱与双重胁迫会造成匍匐翦股颖L-93叶片中抗氧化酶活性的降低与过氧化物含量的上升。由于叶片RWC的迅速降低,在双重胁迫条件下,匍匐翦股颖L-93叶片中MDA与EL值的上升幅度显著高于单一胁迫造成的影响。
[1]刘霞,彭燕.翦股颖属草坪草适应性研究进展[J].安徽农业科学,2006,34(12):2708-2710,2741
[2]韩烈保,杨碚,邓菊芬.草坪草种及其品种[M].北京:中国林业出版社,1999
[3]许崇梅.中国剪股颖族植物及一些近缘属的系统学研究[D].济南:山东师范大学,2007
[4]钟理,杨春燕,李辰琼,等.贵州野生匍匐翦股颖抗旱耐热性评价[J].草地学报,2010,18(6):902-906
[5]刘刊,耿士均,商海燕,等.草坪草抗性研究进展[J].草业科学,2012,29(7):1058-1064
[6]韩瑞宏,李志丹,高桂娟,等.优良草坪草匍匐翦股颖研究进展[J].广东农业科学,2011(15):39-42
[7]万里强,石永红,李向林,等.高温干旱胁迫下三个多年生黑麦草品种叶绿体和线粒体超微结构的变化[J].草业学报,2009,18(1):25-31
[8]刘晓军,洪光宇,袁志诚,等.干热胁迫下两种苇状羊茅对不同水肥处理的响应机理[J].草业学报,2011,20(1):46-54
[9]Zhu G,Zhong H,ZhangA.Plant physiology experiment[M].Beijing:Peking University Press,1990
[10]李合生.植物生理学[M].北京:高等教育出版社,2002
[11]马伟荣,童军茂,单春会.超氧化物歧化酶(SOD)的特征及在植物抗逆性方面的研究进展[J].食品工业,2013,34(9):154-158
[12]孙卫红,王伟青,孟庆伟.植物抗坏血酸过氧化物酶的作用机制、酶学及分子特性[J].植物生理学通讯,2005,41(2):143-147
[13]Yiwei Jiang B H.Drought and heat stress injury to two cool-season turfgrasses in relation to antioxidant metabolism and lipid peroxidation1[J].Crop Science,2001,41:436-442
[14]Bajji M,Kinet J M,Lutts S.The use of the electrolyte leakage method for assessing cell membrane stability as a water stress tolerance test in durum wheat[J].Plant Growth Regulation,2002,36(1):61-70
[15]Stephen E,Mcann BH.Evaluation of drought tolerance and avoidance traits for six creeping bentgrass cultivars[J]. Hort Science,2008,43(2):519-24
[16]卢少云,郭振飞.草坪草逆境生理研究进展[J].草业学报,2003,12(4):7-13
[17]Blum A,Ebercon A.Cell membrane stability as a measure of drought and heat tolerance in wheat[J].Crop Science,1981,21(1):43-7
[18]田敏,饶龙兵,李纪元.植物细胞中的活性氧及其生理作用[J].植物生理学通讯,2005,41(2):235-241
[19]何学利.植物体内的保护酶系统[J].现代农业科技,2010,10:37-38
[20]GiannopolitisCN,RiesSK.SuperoxidedismutasesIOccurrenceinhigherplants[J].Plantphysiology,1977,59(2):309-14
[21]Change B,MaehlyA.Assay of catalases and peroxidase[J].Methods Enzymol,1955,2:764-75
[22]丁薪源,曹建康.果蔬过氧化物酶酶学特性研究进展[J].食品科技,2012,37(10):62-66
[23]南芝润,范月仙.植物过氧化氢酶的研究进展[J].安徽农学通报,2008,14(5):27-29
[24]Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annu Rev Plant Biol,2004,55:373-99
Effect of Drought and Heat Stress onAntioxidant Metabolism of Agrostis stolonifera L.
QU Ya-nan1,YANG Zhi-min2*
1.Nanjing Agricultural University,College of Horticulture,Nanjing 210095,China
2.Nanjing Agricultural University,College of Agro-grass Science,Nanjing 210095,China
The experiment was designed to investigate drought,heat and combined stresses(9 days,short term)on cool season turf grass Agrostis stolonifera‘L-93'by analyzing leaf relative water content(RWC),malondialdehyde(MDA), electrolyte leakage(EL)and activity of four anti-oxidant enzymes.Transient increases in superoxide dismutase(SOD)and decreases in catalase(CAT),peroxidase(POD)and ascrobate peroxidase(APX)occurred in drought,heat and combined stress.It took the shortest time for the drought-heat combined stress to cause the damage on creeping bentgrass with quick increase in both malondialdehyde content and the electrolyte leakage.
Anti-oxidant enzymes;creeping bentgrass;combined stresses;heat-drought
S688.4
A
1000-2324(2014)04-0489-06
2013-02-11
2013-04-20
曲亚楠(1988-),男,硕士研究生,主要从事草坪草抗逆生理研究.E-mail:rocatics@126.com
*通讯作者:Author for correspondence.Email:nauyzm@njau.edu.cn

