范德瓦尔斯气体的气压公式
蓝风华
(武警工程大学理学院,陕西 西安 710086)
大学物理教科书中,一般都给出了理想气体恒温气压公式[1]

其中,M为气体摩尔质量,T为热力学温度,p0为地面高度h=0处的压强.
实际上大气温度是随地面高度而变化的,同时理想气体与大气实际气体也有出入,因此用式(1)计算出的压强只能是近似结果.为了得到比较接近实际的结果,不妨将大气近似为范德瓦尔斯气体,用多方过程取代等温过程,这样推导出的气压公式会更接近实际.
1 范德瓦尔斯气体的多方过程
设1mol范德瓦尔斯气体的压强为p,体积为V,温度为T,其状态方程为

其中,R为普适气体常数;a、b为范德瓦尔斯修正量.
由热力学第一定律
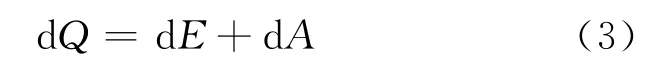
其中,

式中,C为摩尔热容;CV为等体摩尔热容,它们都是温度的函数.通常实际问题中,由于温度变化不大,C、CV变化很小,因而近似视作常量.
式(3)即为再利
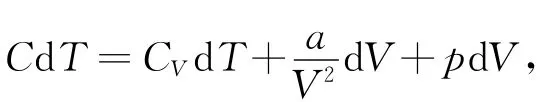
用式(2)可得

对上式积分并整理,可得范德瓦尔斯气体的多方过程的T、V关系为

利用式(2)还可得到多方过程的p、V关系,即

若令

则式(4)、(5)可分别写成
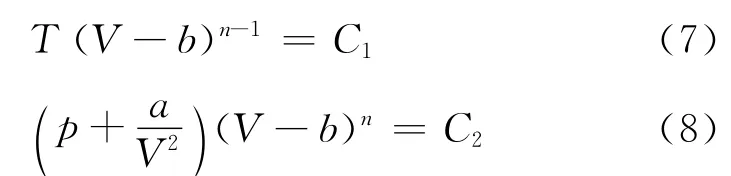
通常称n为多方指数.
2 范德瓦尔斯气体的气压公式推导
如图1所示,设在高度h处有一薄层空气,其底面积为S,厚度为dh,上下两面的气体压强分别为p+dp和p,该处空气密度为ρ,根据力学平衡条件
即
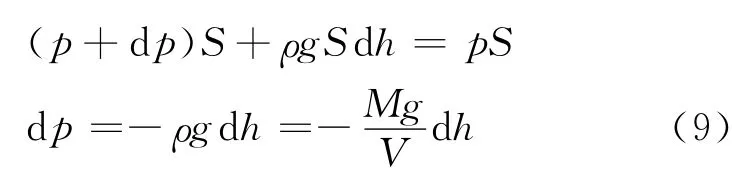
其中,V为摩尔体积,M为摩尔质量

图1 空气层受力图示
若将大气近似为范德瓦尔斯气体,则由式(8)中的p代入式(9),可得
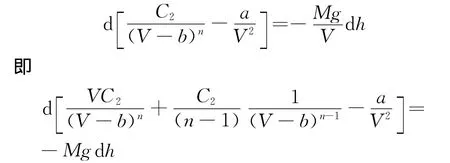
利用式(8)和式(2),上式还可得

再利用式(7)消去V,可得

设地面高度为零时,温度为T0,摩尔体积为V0;地面高度为h时,温度为T,摩尔体积为V,对式(10)两边积分,并利用式(7),可得

式(11)反映了温度随高度变化的函数关系.
由式(2)及式(7)可得范德瓦尔斯气体处于多方过程的气压公式为
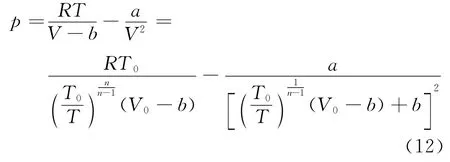
式(12)反映了压强随温度T即随高度h变化的函数关系.
3 讨论
1)若将大气视为理想气体,则a=0、b=0,式(11)变为
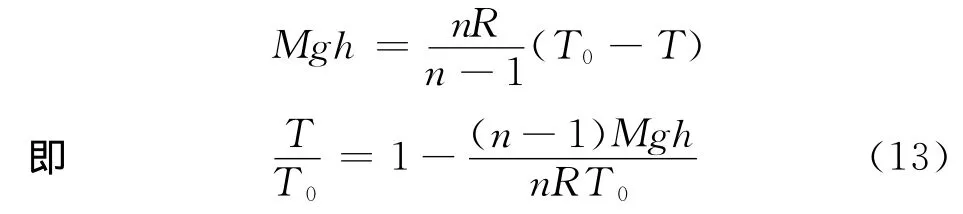
将式(13)代入式(12)可得

它与文献[2]的结果一致.即在同一高度下,压强随多方指数的增加而减少.
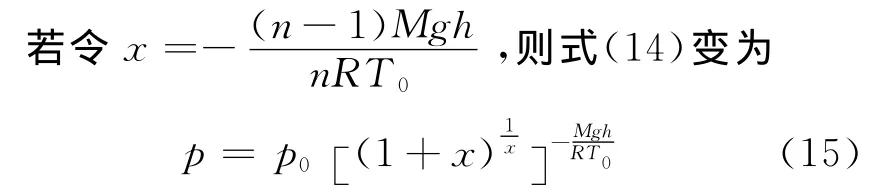
当n→1,即x→0时,式(15)变为
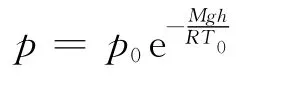
这正是理想气体的恒温气压公式.
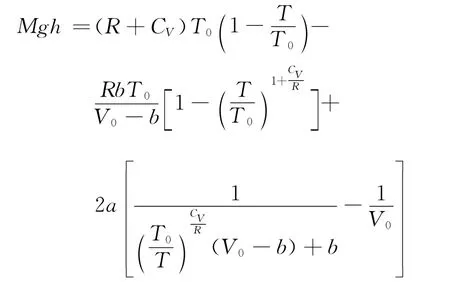
式(12)变为

它与文献[3]结果一致.
若将大气视作理想气体绝热模型,则式(14)变为
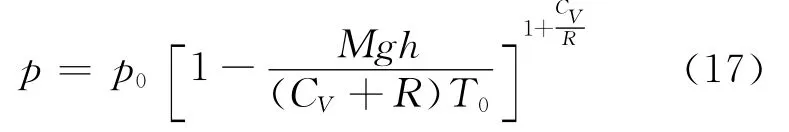
对于范德瓦尔斯气体与理想气体的绝热过程的气压公式的比较,文献[3]做了详细的阐述,本文就不一一赘述.
总之,范德瓦尔斯气体处于多方过程的气压公式,确实是对理想气体气压公式的一种很好的修正.
[1]张三慧.大学物理:第二册[M].2版.北京:清华大学出版社,1999:14.
[2]魏国柱,顾永伟,杜安.对气体等温气压公式的修正[J].大学物理,2006,25(17):28.
[3]穆良柱,史寒朵.重力场中的范德瓦尔斯气体[J].大学物理,2011,30(10:):5-6.

