shRNA沉默CtBP2基因对前列腺癌细胞的增殖作用
刘 妍徐 勇 高 超张志宏
shRNA沉默CtBP2基因对前列腺癌细胞的增殖作用
刘 妍1徐 勇2△高 超1张志宏2
目的 探讨RNA干扰技术沉默羧基末端结合蛋白(CtBP)2基因表达对前列腺癌PC3细胞增殖能力的影响。方法实验分为空白对照组、转染空质粒组、转染shRNA组。设计并合成针对CtBP2的3条特异性短发卡RNA(shRNA)模板,构建CtBP2-shRNA重组质粒,转染PC3细胞。通过RT-PCR检测CtBP2 mRNA的表达水平;采用Western blot法检测CtBP2蛋白表达的水平,运用MTT法检测沉默CtBP2对PC3细胞体外增殖的抑制作用。结果将CtBP2-shRNA转染前列腺癌PC3细胞后,CtBP2 mRNA以及蛋白的表达水平均明显下降。沉默CtBP2表达后,MTT结果显示转染shRNA组的PC3细胞较空白对照组、转染空质粒组细胞增殖能力明显减弱,差异有统计学意义(P<0.01)。结论CtBP2-shRNA可抑制CtBP2在前列腺癌细胞中的表达并抑制肿瘤细胞生长,提示CtBP2可作为前列腺癌基因治疗的一个新靶点。
前列腺肿瘤;细胞系,肿瘤;RNA干扰;细胞增殖;羧基末端结合蛋白
前列腺癌(prostate cancer,PCa)是危害男性健康最常见的恶性肿瘤[1]。我国PCa的发病率近年也呈逐年增长的趋势[2]。RNA干扰(RNA inference,RNAi)是一种在转录水平及转录后阻断基因表达的新技术,由双链RNA诱发的导致同源mRNA高效特异性降解。RNA干扰技术的建立和发展,为PCa尤其是晚期PCa提供了全新的治疗策略。羧基末端结合蛋白(C-terminal-binding protein,CtBP)基因在进化上保守,能与多种转录因子相互作用,参与多个肿瘤相关基因的转录调控,发挥转录辅助抑制因子的功能,与肿瘤的发生发展密切相关[3-4]。最近,全基因组关联研究(Genome Wide Association Studies, GWAS)已经发现导致PCa危险因素的CtBP2敏感性位点,证实CtBP2在PCa组织中的表达明显高于正常前列腺组织[5]。本研究通过在PC3细胞中转染短发夹RNA(short hairpin RNA,shRNA),以阻断细胞中CtBP2的表达,从而观察CtBP2基因沉默后对PC3细胞增殖能力的影响,以期为PCa患者寻找新的靶向治疗基因。
1 材料与方法
1.1 细胞株 人PCa PC3细胞系由本研究室冻存。
1.2 主要试剂 从http:∕www.ncbi.nlm.nih.gov的GenBank中获得人CtBP2和β-actin基因序列,应用Primer Primier 5.0软件设计引物,由Invitrogen公司合成,各引物序列,见表1。shRNA质粒购自GeneCopoeia公司;胎牛血清购自Hyclone公司;BCA蛋白定量试剂盒购自Pierce公司;RNA提取试剂Trizol和转染试剂Lipofectamine2000和反转录试剂盒购自Invitrogen公司;PCR试剂盒购自TaKaRa公司;质粒提取试剂盒购自康为世纪;ECL发光试剂盒购自Millpore公司;血清白蛋白(BSA)购自Newprobe公司;MTT细胞增殖检测试剂盒购自博士德公司。一抗羊抗人CtBP2多克隆抗体和二抗驴抗羊IgG-HRP均购自Santa Cruz公司;二甲基亚砜(DMSO)、丙烯酰胺及N,N-二甲基双丙烯酰胺、焦碳酸二乙酯(DEPC)均购自Sigma公司。
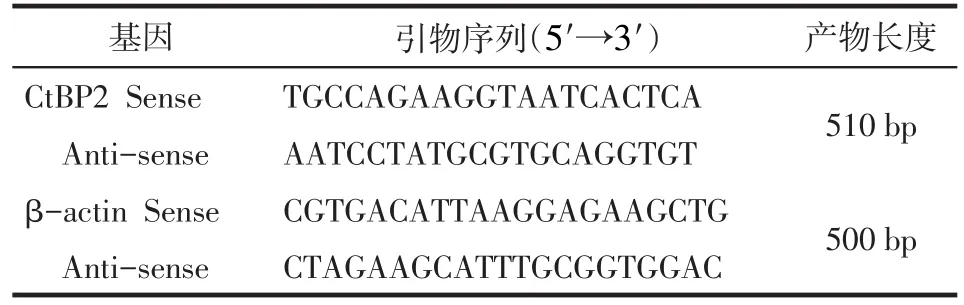
Tab.1 Primers for PCR表1 PCR反应引物
1.3 重组质粒pUC-U6-shRNA-CtBP2 从GenBank中Ct-BP2 mRNA(NM001290215)上寻找符合特征的靶序列,合成分别针对其靶编码区(838-857位点、1303-1322位点、341-360位点)碱基序列的两条DNA寡核苷酸链(分别为CtBP2-shRNA-1,-2,-3)。合成的2条互补寡核苷酸链在退火缓冲液作用下退火,形成具有9个核苷酸环的shRNA,经BamHⅠ、EcoRⅠ限制性内切酶线性化,在T4 DNA连接酶的作用下,通过其茎上的19 nt反义寡核苷酸与CtBP2 mRNA上的靶序列结合,诱导CtBP2 mRNA的酶切降解,形成pUC-U6-shRNA-CtBP2重组质粒,携带增强型绿色荧光蛋白(EGFP)报告基因及氨苄青霉素、嘌呤霉素抗性基因、含U6启动子及BamHⅠ、EcoRⅠ酶切位点。CtBP2-shRNA-1序列为5′-CTGCCACATCCTCAACCTG-3′,CtBP2-shRNA-2序列为5′-CCTCGACGTGCATGAGTCA-3′,CtBP2-shRNA-3序列为5′-ACGCAGACTCCTGCAAGTT-3′。
1.4 筛选沉默最佳shRNA序列 根据GeneCopoeia公司提供的shRNA使用说明书,通过浓度梯度实验确定最适筛选浓度,筛选出干扰效果最佳的质粒CtBP2-shRNA-1。
1.5 细胞培养及转染 PC3细胞接种于含10%胎牛血清的RPMI1640培养液培养,37℃、5%CO2孵箱中培养。实验分空白对照组、转染空质粒组、转染 shRNA组,按照 Lipofectamine 2000转染试剂说明进行转染,分别在转染后12、24 和48 h检测各组细胞的转染效率,分析不同组间细胞生长情况。
1.6 RT-PCR法检测各组细胞mRNA表达 空白对照组、转染空质粒组、转染shRNA组转染到PC3细胞48 h后,提取总RNA,测定总RNA浓度按反转录试剂盒说明书逆转录为cDNA,反应条件:94℃预变性3 min;94℃30 s;56℃30 s,循环24次;72℃60 s;72℃总延伸10 min。以上PCR产物经琼脂糖凝胶电泳,凝胶成像分析仪上观察结果并成像,依据标准曲线计算目的基因和内参基因mRNA量,每个样品目的基因与内参基因的比值,即为校正后的相对含量,实验重复3次。
1.7 Western blot法检测各组细胞蛋白表达 空白对照组、转染空质粒组、转染shRNA组转染到PC3细胞72 h后,提取总蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度,10% SDS-PAGE电泳,转膜,封闭后,加入1∶500稀释的一抗在4℃孵育过夜,洗膜后加入1∶5 000稀释的二抗孵育,洗膜,应用免疫印迹化学发光试剂(ECL)显示蛋白质条带,暗室曝光,用Quantity One软件进行条带灰度分析。
1.8 MTT法检测各组细胞增殖能力的变化 在EP管内将各组细胞悬液充分打匀,按每孔3 000个细胞接种于96孔培养板,每组设6个复孔,24 h后换液。于转染后24、48、72 h,每孔加入MTT试剂10 μL,于37℃5%CO2条件下继续孵育4 h。吸取各孔上清,加入DMSO 150 μL∕孔,室温下置水平摇床摇10 min以充分溶解MTT结晶。在酶联免疫测定仪上选择波长570 nm,空白孔调零,测定各孔OD值,计算细胞生长抑制率。
1.9 统计学方法 采用SPSS19.0统计软件进行统计分析,实验数据用±s表示,组间比较采用方差分析和LSD-t检验,检验水准α=0.05。
2 结果
2.1 3组干扰质粒干扰CtBP2后其mRNA的表达 以转染空质粒组为标准,β-actin为内参,转染shRNA组其mRNA表达水平,见图1,证实CtBP2-shRNA-1干扰质粒在mRNA水平上抑制CtBP2基因表达的效果最为显著。
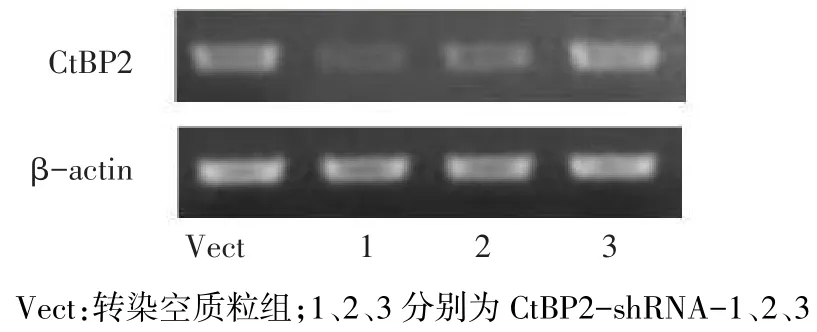
Fig.1 Silence effect of CtBP2-shRNA图1 干扰质粒对CtBP2 mRNA的沉默效果
2.2 CtBP2-shRNA-1干扰CtBP2后其mRNA和蛋白的表达 空白对照组与转染空质粒组PC3细胞中CtBP2 mRNA及蛋白表达差异无统计学意义,但均高于转染shRNA组(P<0.05),见表2,图2。
2.3 转染 shRNA组对 PC3细胞生长的抑制作用 转染shRNA组在24、48、72 h后,PC3细胞生长明显慢于空白对照组以及转染空质粒组(P<0.05),空白对照组与转染空质粒组PC3细胞的增殖率差异无统计学意义,见表3。

Fig.2 Western blot detect PC3 cells after transfection CtBP2 protein expression图2 Western blot检测转染后PC3细胞中CtBP2蛋白表达
Tab.2 Transcription and Expression levels of CtBP2 mRNA and protein in PC3 cells表2 PC3细胞中CtBP2 mRNA及蛋白的表达情况(n=3,±s)
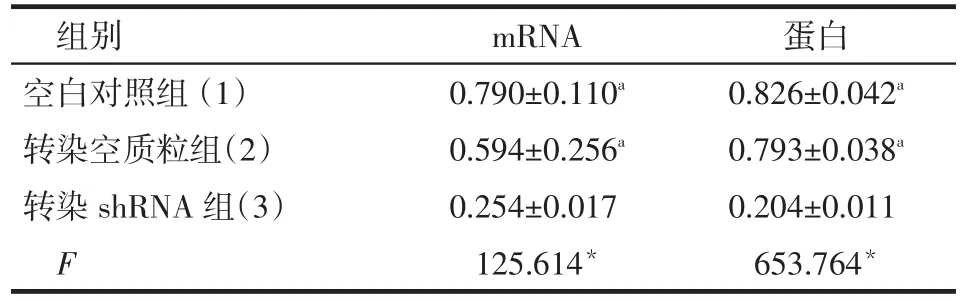
Tab.2 Transcription and Expression levels of CtBP2 mRNA and protein in PC3 cells表2 PC3细胞中CtBP2 mRNA及蛋白的表达情况(n=3,±s)
*P<0.05;a与(3)组比较,P<0.05
组别空白对照组(1)转染空质粒组(2)转染shRNA组(3)F mRNA 0.790±0.110a0.594±0.256a0.254±0.017 125.614*蛋白0.826±0.042a0.793±0.038a0.204±0.011 653.764*
Tab.3 Comparison of PC3 cell proliferation in different groups表3 各处理组不同时间PC3细胞增殖率比较(n=3,OD值,±s)

Tab.3 Comparison of PC3 cell proliferation in different groups表3 各处理组不同时间PC3细胞增殖率比较(n=3,OD值,±s)
*P<0.05;a与(3)组比较,P<0.05
组别空白对照组(1)转染空质粒组(2)转染shRNA组(3)F 24 h 0.143±0.005a0.144±0.005a0.133±0.003 11.447*48 h 0.254±0.020a0.274±0.017a0.152±0.017 77.578*72 h 0.472±0.029a0.483±0.005a0.242±0.007 372.698*
3 讨论
PCa的发生与发展受多个基因的调控,分子生物学的发展在肿瘤的早期诊断、监控和预后判断上为临床提供了重要依据[6]。近年来,RNA干扰技术在多种肿瘤的基因治疗中被证实具有强大的基因沉默作用[7]。因此,本实验应用RNA干扰技术研究特异性shRNA对PCa细胞增殖能力的影响。
CtBP基因作为辅阻遏物与多种转录因子联系而参与到很多生物过程中,如细胞分化、凋亡、发育和肿瘤发生[8]。Kovi等[9]报道,CtBP2能通过转录因子基本kruppel样因子与Bik启动子结合而替代阅读框,通过与CtBP2结合从而清除CtBP2∕BKIF对 Bik启动子的抑制,促进由非P53依赖的凋亡途径使细胞凋亡。Tsilidis等[5]研究表明,CtBP2中单核苷酸多态性(SNP)位点与PCa的发病风险密切相关,CtBP2的表达与磷脂酰肌醇激酶3通路的活性相关,它主要是由上游的胰岛素样生长因子调控的。然而,Waters等[10]对多种族人群的研究发现,CtBP2中的SNP位点与PCa的发病风险无明显相关性。因此,本研究进一步观察CtBP2在PCa中的作用机制,采用RNA干扰技术沉默CtBP2基因的表达,以期为前列腺癌基因治疗寻找新靶点。
本研究通过3组干扰质粒干扰CtBP2基因,将CtBP2-shRNA转染进PCa PC3细胞系中,可有效抑制CtBP2在细胞内的表达,证实CtBP2-shRNA-1干扰质粒在mRNA水平上抑制CtBP2基因的表达效果最为显著,从而对CtBP2基因实施基因沉默。通过PCR和Western Blot的结果表明,转染CtBP2-shRNA组的PC3细胞CtBP2 mRNA和蛋白表达水平明显受到抑制;转染CtBP2-shRNA组使CtBP2表达降低后,PC3细胞的生长较空白对照组及转染空质粒组受到了明显的抑制;空白对照组及转染空质粒组差异无统计学意义,提示空白对照组和转染空质粒组的PC3细胞毒性轻微。MTT实验证明Ct-BP2表达降低能够显著抑制PCa细胞增殖,证明Ct-BP2在PCa细胞沉默后对PCa细胞的影响对PCa肿瘤的形成和发展具有重要作用。由此可以说明CtBP2的表达与PC3细胞的生长具有相关性。因此推测CtBP2很可能成为一个新的PCa预测指标。
本研究设计合成的靶向CtBP2基因的shRNA成功转染PC3细胞,沉默CtBP2基因的表达,并且抑制PC3细胞的生长,说明CtBP2与PC3细胞的生长具有相关性。抑制CtBP2的表达可能成为基因治疗PCa的方法之一,从而为临床治疗提供了实验基础,RNA干扰方法可能成为肿瘤基因治疗的一条新途径。
[1]赵朋,于斌,刘德祥,等.Bcl-2、Ki-67在前列腺癌组织中的表达及临床意义[J].天津医药,2013,41(10):926-928.
[2]叶定伟.前列腺癌的流行病学及中国的发病趋势[J].中华外科杂志,2006,44(6):362-364.
[3]Wang R,Asangani IA,Chakravarthi BVSK,et al.Role of transcriptional corepressor CtBP1 in prostate cancer progression[J].Neoplasia,2012,14(10):905-914.
[4]黄承信,曾思恩,肖胜军.CtBP与肿瘤相关的研究[J].当代医学, 2011,17(35):38-41.
[5]Tsilidis KK,Travis RC,Appleby PN,et al.Interactions between genome-wide significant genetic variants and circulating concentra-tions of insulin-like growth factor 1,sex hormones,and binding proteins in relation to prostate cancer risk in the National Cancer Institute Breast and Prostate Cancer Cohort Consortium[J].Am J Epidemiol,2012,175(9):926-935.
[6]Davis EJ,Beebe-Dimmer JL,Yee CL,et al.Risk of second primary tumors in men diagnosed with prostate cancer[J].Cancer,2014,15 (10):11-16.
[7]Liu YB,Zhang L,Guo YX,et al.Plasmid-based survivin shRNA and GRIM-19 carried by attenuated Salmonella suppresses tumor cell growth[J].Asian Journal of Andrology,2012,14,(1):536–545.
[8]马雅婷,赵晶,杨光,等.人CTBP2与CCNH相互作用的初步研究[J].复旦学报(自然科学版),2007,46(3):396-400.
[9]Kovi RC,Paliwal S,Pande S,et al.An ARF∕CtBP2 conplex regulates BH3 only gene expression and p53 independent apoptosis[J].Cell Death Differ,2010,17(3):513-521.
[10]Waters KM,Marchand LL,Kolonel LN,et al.Generalizability of associations from prostate cancer genome-wide association studies in multiple populations[J].Cancer Epidemiol Biomarkers Prev,2009, 18(4):1285-1289.
(2014-02-27收稿 2014-06-16修回)
(本文编辑 李国琪)
Study of Effect of CtBP2 Knockout through shRNA on Proliferation of Prostate Cancer Cells
LIU Yan1,XU Yong2△,GAO Chao1,ZHANG Zhihong2
1Prostate Disease Laboratory,Tianjin Institute of Urology,Tianjin 300211,China;2Urology Department,the Second Hospital of Tianjin Medical Univercity
△
E-mail:xuyong8816@sina.com
ObjectiveTo study the effects of shRNA-CtBP2 on the growth of prostate cancer PC3 cells.MethodsThere were three experimental groups in this study,which include blank control group,empty plasmid transfected group and transfected shRNA group.CtBP2 mRNA sequence is targeted by 3 pairs of designed interfering shRNA to built shRNA-Ct-BP2 recombinant plasmid then it is transfected into PC3 cells.Reverse transcriptase polymerase chain reaction(RT-PCR) and Western blot assays were used to detect the transcription and expression levels of CtBP2 mRNA and protein,respectively.PC3l proliferation was measured by MTT assay.ResultsBuilting shRNA-CtBP2 recombinant plasmid and transfecting PC3 cells were successful.Transcription and expression levels of CtBP2 mRNA and protein were significantly decreased in shRNA-CtBP2 transfected PC3 cells.After CtBP2 silencing,cell proliferation was blocked in the shRNA-CtBP2 cells compared to that of blank control group(P<0.01).ConclusionshRNA-CtBP2 could significantly inhibit CtBP2 expression,suppress the growth of PC3 cells,which suggests that CtBP2 may be a new target for PCa gene therapy.
prostatic neoplasms;cell line,tumor;RNA interference;cell proliferation;CtBP
R737.25
A
10.3969∕j.issn.0253-9896.2014.10.005
天津市应用基础及前沿技术研究计划(12JCYBJC31400);天津市科委抗癌重大专项攻关计划项目(12ZCDZSY17200)
1天津市泌尿外科研究所前列腺疾病研究室(邮编300211);2天津医科大学第二医院泌尿外科
△通讯作者 E-mail:xuyong8816@sina.com

