急性主动脉综合征患者血浆D-二聚体水平影响因素分析
郭倩玉 卢成志 夏大胜
急性主动脉综合征患者血浆D-二聚体水平影响因素分析
郭倩玉 卢成志 夏大胜
目的 探讨急性主动脉综合征患者血浆D-二聚体水平的影响因素。方法选取76例急性主动脉综合征患者,于入院当日取静脉血2 mL,采用酶联免疫荧光法检测D-二聚体水平,常规检查血肌酐等生化指标及血常规,记录患者血白细胞(WBC)、肌酐水平、主动脉CT造影结果以及住院期间休克和死亡发生情况。绘制受试者工作特征曲线(ROC曲线)评估D-二聚体对住院死亡的预测价值。结果ROC曲线D-二聚体的理想截断值为2 988.6 μg∕L FEU,敏感度为86.7%,特异度为70.5%,据此将患者分为A组[D-二聚体<2 988.6 μg∕L纤维蛋白原当量单位(FEU),45例]和B组(D-二聚体≥2 988.6 μg∕L FEU,31例)。B组发病时间和主动脉壁间血肿比例低于A组,累及升主动脉比例和住院死亡比例高于A组(均P<0.05)。2组休克发生情况差异无统计学意义。Logistic多因素回归分析结果显示,发病时间短、累及升主动脉、无主动脉壁间血肿均为D-二聚体水平≥2 988.6 μg∕L FEU的独立危险因素。结论急性主动脉综合征患者中发病时间长、未累及升主动脉、壁间血肿者血浆D-二聚体水平相对较低。
D-二聚体;急性主动脉综合征;主动脉夹层;主动脉壁间血肿
急性主动脉综合征是包括主动脉夹层、穿透性动脉硬化性溃疡、壁间血肿的一组有相似临床症状的主动脉病变。其中主动脉夹层和壁间血肿最为常见,是以急性胸痛为主要表现的危急重症,其临床表现复杂多变,病程进展迅速,病死率高,且有时起病隐匿,误诊率高,因而及早、准确的诊断具有重要临床意义。近年来研究发现,急性主动脉夹层患者血浆D-二聚体水平显著升高,诊断的敏感性在92%~99%,D-二聚体可做为一项急性主动脉综合征早期诊断的标志物[1-3]。但依然有少数患者D-二聚体无明显升高,升高患者D-二聚体水平相差也较大。D-二聚体水平的升高程度可能受病变类型等多种因素的影响,但有关方面的研究较少。本研究回顾性分析了76例急性主动脉综合征患者,探讨影响急性主动脉综合征患者血浆D-二聚体水平升高的相关因素。
1 对象与方法
1.1 研究对象 选择2012年2月1日—2013年12月20日收住我院诊断为急性主动脉综合征患者76例,其中男59例,女17例,年龄22~89岁,平均(56.9±12.7)岁。患者通过胸、腹主动脉CT造影确诊,排除慢性主动脉夹层、外伤性主动脉夹层、主动脉瘤未合并夹层者。其中急性主动脉夹层62例,主动脉壁间血肿13例,主动脉弓溃疡1例。
1.2 方法 患者于入院当日静脉取血2 mL,置入抗凝管中,3 000 r∕min离心15 min,分离血浆用于检测。检验仪器使用VIDAS全自动荧光免疫分析仪,试剂盒为法国生物梅里埃公司生产的D-二聚体排除试验试剂盒,检验方法为酶联免疫荧光法,操作步骤严格按试剂盒要求完成。常规完成血肌酐等生化指标及血常规检查,记录患者血白细胞(WBC)、肌酐水平、主动脉CT造影结果以及住院期间休克和死亡发生情况。
1.3 统计学方法 采用SPSS 17.0软件进行统计学处理,连续变量符合正态分布者以±s表示,2组间比较采用t检验。非正态分布的计量资料以M(P25,P75)表示,2组间比较采用Mann-Whitney U检验。分类变量组间比较采用χ2检验。绘制受试者工作特征曲线(ROC曲线)评估D-二聚体对住院死亡的预测价值。采用Logistic回归分析D-二聚体水平的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 D-二聚体预测住院死亡的ROC曲线分析 76例急性主动脉综合征患者中住院死亡15例,以住院死亡为阳性事件,绘制ROC曲线,AUC为0.841± 0.052(P<0.001),95%可信区间(95%CI)为0.739~0.943。平衡敏感度和特异度的D-二聚体理想值为2 988.6 μg∕L纤维蛋白原当量单位(FEU),敏感度为86.7%,特异度为70.5%。见图1。D-二聚体<2 988.6 μg∕L FEU者45例(A组),D-二聚体≥2 988.6 μg∕L FEU者31例(B组)。
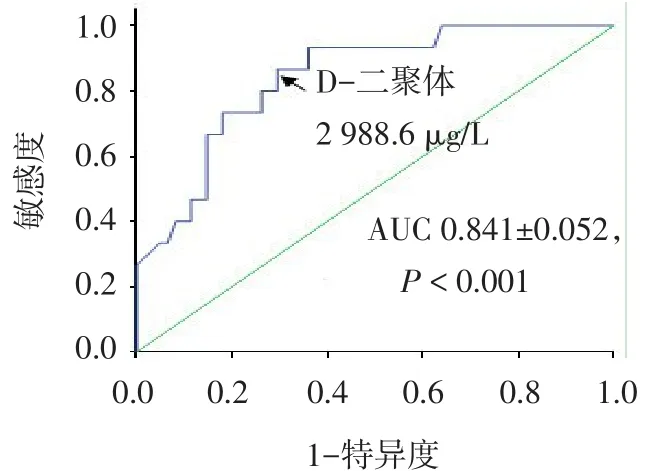
Fig.1 Receiver-operating characteristic curves for D-dimer to predict hospital mortality图1 D-二聚体预测住院死亡的ROC曲线分析
2.2 2组基线资料比较 2组患者年龄、性别、合并冠心病、高血压、血肌酐水平差异均无统计学意义。B组WBC、D-二聚体水平均高于A组(均P< 0.05),见表1。

Tab.1 Comparision of baseline data between the two groups表1 2组患者基线资料比较
2.3 2组主动脉CT造影及住院期间休克和死亡发生情况比较 B组发病时间和主动脉壁间血肿比例低于A组,累及升主动脉比例和住院死亡比例高于A组(均P<0.05)。2组休克发生情况差异无统计学意义。见表2。
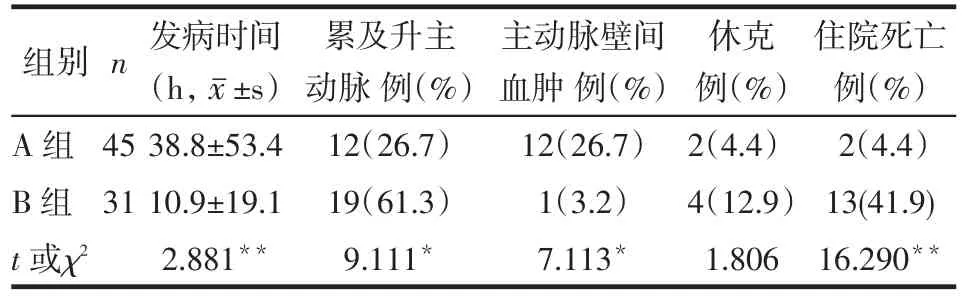
Tab.2 Comparision of aortic contrast-inhanced CT, incidence of shock and Hospital mortality between the two groups表2 2组主动脉CT造影及住院期间休克和死亡发生情况比较
2.4 影响血浆D-二聚体水平的Logistic多因素回归分析 以发病时间、是否累及升主动脉、有无主动脉壁间血肿(赋值均为是=1,否=0)为自变量,血浆D-二聚体水平是否≥2 988.6 μg∕L FEU(是=1,否=0)为因变量,进行Logistic回归分析,结果见表3。显示,发病时间短、累及升主动脉、无主动脉壁间血肿均为D-二聚体水平≥2 988.6 μg∕L FEU的独立危险因素。
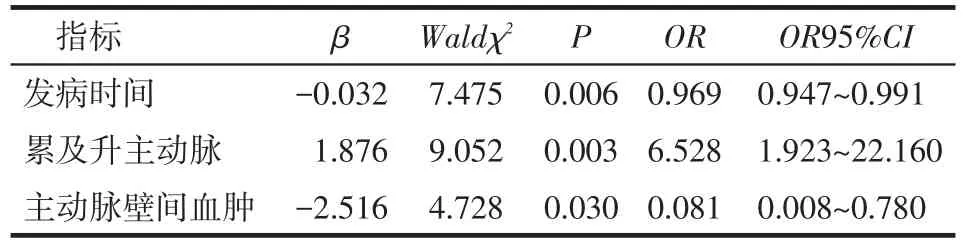
Tab.3 Logistic regression analysis of related factors of the levels of plasma D-dimer in patients with acute aortic syndrome表3 影响主动脉夹层患者D-二聚体水平的Logistic多因素回归分析
3 讨论
目前尚未研究出便利的血清学标志物用于诊断急性主动脉综合征,影像学方法为确定诊断急性主动脉综合征的最重要手段,其中CT血管造影(CTA)由于敏感性和特异性高且无创而应用最为广泛,但也存在诸多客观条件限制其应用范围,如检查费用昂贵、检查时间长、患者一般状况不稳定时检查存在一定风险,以及很多医院尚不能实现24 h增强CT等。临床上急需一种诊断效能较高的检验指标,以帮助急诊医师对主动脉夹层急性主动脉综合征患者进行快速准确的筛选。
2003年,Weber等首次提出D-二聚体阴性能排除主动脉夹层。后有研究显示,D-二聚体水平升高诊断主动脉夹层的敏感性在92%~99%[1-2]。D-二聚体>500 μg∕L可以作为筛选疑似急性主动脉夹层进一步行影像检查的标准[3]。D-二聚体水平的升高还有助于对主动脉夹层和其他以胸痛为主要表现的疾病(如急性心肌梗死)进行鉴别诊断,主动脉夹层患者D-二聚体水平高于后者[4-5]。其原因是主动脉内膜破损和中层分离,可在破裂部位激活凝血系统;同时,血流进入假腔后相对缓慢,易形成血栓,最终导致主动脉内广泛血栓形成,进而激活纤溶系统,导致D-二聚体水平显著升高。而急性心肌梗死患者血栓相对较小,D-二聚体水平可不升高或呈略微升高[5]。主动脉夹层患者D-二聚体水平的显著升高也提示预后不良[6],本研究中D-二聚体≥2 988.6 μg∕L FEU则预示住院病死率的增加。
但也有研究显示,并非所有主动脉夹层患者D-二聚体水平均升高,且D-二聚体升高者水平相差也较大,具有离散度高的特点[7]。进一步研究发现,D-二聚体升高和主动脉夹层的病理类型、累及范围有关。夹层撕裂范围广泛患者的D-二聚体多为阳性,假腔内血栓完全形成的患者有可能D-二聚体检测呈阴性。刘晓光等[8]研究发现假腔内有血流或部分血栓形成的急性主动脉夹层患者较假腔内血栓完全形成的患者D-二聚体升高明显。本研究结果发现,累及升主动脉的患者D-二聚体水平更高,壁间血肿的患者较典型夹层患者D-二聚体升高幅度低。
主动脉壁间血肿常因动脉中层滋养动脉的破裂或者动脉斑块内出血造成。因无内膜撕裂,壁内血肿无血液流动,不直接与主动脉交通,故增厚的主动脉壁不能通过主动脉造影和增强CT发现,这是其与主动脉夹层在影像学表现上的区别[9]。壁间血肿患者可进展为典型夹层。部分壁间血肿由主动脉粥样硬化斑块溃疡引起,其临床症状与主动脉夹层难以区分,仅在影像学表现上有所区别,因此许多地方在临床上并不对两者予以明确的鉴别。Ohlmann 等[10]比较84例典型夹层患者和10例壁内血肿患者,发现壁内血肿患者D-二聚体水平较典型夹层患者低。本研究结果与此基本一致。
Suzuki等[11]研究认为D-二聚体起病6 h内即显著升高,对急性冠脉综合征有较好的鉴别诊断价值。本研究结果显示,D-二聚体≥2 988.6 μg∕L FEU者的发病时间明显低于D-二聚体<2 988.6 μg∕L FEU者,提示随着发病时间的延长,D-二聚体水平可能会下降。但仍需多点采集血样动态观察D-二聚体水平后进一步验证。
综上所述,D-二聚体水平对急性主动脉综合征的分型和预后判断具有一定程度的参考意义。对急诊就诊的疑似急性主动脉综合征患者,尤其对于无急诊CTA条件的医院,应及时进行D-二聚体检测,D-二聚体升高的患者应进行主动脉CTA检查以进一步明确诊断。需要注意的是,由于主动脉的累及范围、病变类型及发病时间不同,D-二聚体水平可能会有显著差异,甚至无明显升高。
[1]Ersel M,Aksay E,Kıyan S,et al.Can D-dimer testing help emergency department physicians to detect acute aortic dissections[J]?Anadolu Kardiyol Derg,2010,10(5):434-439.doi:10.5152∕akd.2010. 142.
[2]Fan QK,Wang WW,Zhang ZL,et al.Evaluation of D-dimer in the diagnosis of suspected aortic dissection[J].Clin Chem Lab Med, 2010,48(12):1733-1737.doi:10.1515∕CCLM.2010.337.
[3]Shimony A,Filion KB,Mottillo S,et al.Meta-analysis of usefulness of D-dimer to diagnose acute aortic dissection[J].Am J Cardiol, 2011,107:1227-1234.doi:10.1016∕j.amjcard.2010.12.027.
[4]Kazuo S,Yusuke Y,Hideharu O,et al.D-dimer is helpful for differentiating acute aortic dissection and acute pulmonary embolism from acute myocardial infarction[J].Hellenic J Cardiol,2011,52: 123-127.
[5]Guo ZG,Ma QB,Zheng YA,et al.The value of D-dimer for etiological diagnosis of mortal chest pain:an analysis of 438 cases[J].Zhonghua Wei Zhong Bing Ji Jiu Yi Xue,2013,25(11):655-659.[郭治国,马青变,郑亚安,等.D-二聚体在致命性胸痛病因诊断中的作用:附438例病例分析[J].中华危重病急救医学杂志,2013,25 (11):655-659.]
[6]Tian L,Fan XH,Zhu J.Plasma D-dimer and in-hospital mortality in patients with Stanford type A acute aortic dissection[J].Blood Coagul Fibrinolysis,2014,25:161-166.doi:10.1097∕MBC.0000000000000013.
[7]Paparella D,Malvindi PG,Scrascia G,et al.D-dimers are not always elevated in patients with acute aortic dissection[J].J Cardiovasc Med(Hagerstown),2009,10(2):212-214.doi:10.2459∕JCM. 0b013e32831c849e.
[8]Liu XG,Jing J,Yuan C,et al.Analysis of D-dimer in different types and stages of aortic dissection[J].J Clin cardiol(China),2007, 23(5):340-342.[刘晓光,井景,袁超,等.D二聚体在不同类型和病期主动脉夹层患者中的检测结果分析[J].临床心血管病杂志,2007,23(5):340-342.]
[9]Bossone E,Suzuki T,Eagle KA,et al.Diagnosis of acute aortic syndromes:imaging and beyond[J].Herz,2013,38(3):269-276.doi: 10.1007∕s00059-012-3710-1.
[10]Ohlmann P,Faure A,Morel O,et al.Lower circulating Sta-Liatest D-Di levels in patients with aortic intramural hematoma compared with classical aortic dissection[J].Crit Care Med,2009,37(3):899-901.doi:10.1097∕CCM.0b013e31819b829f.
[11]Suzuki T,Distante A,Zizza A,et al.Diagnosis of acute aortic dissection by D-dimer:the International Registry of Acute Aortic Dissection Substudy on Biomarkers(IRAD-Bio)experience[J].Circulation, 2009,119(20):2702-2707.doi:10.1161∕CIRCULATIONAHA.108.8 33004.
(2013-12-01收稿 2014-05-29修回)
(本文编辑 陈丽洁)
Analysis of Factors That Affect Plasma D-Dimmer Level in Acute Aortic Syndrome
GUO Qianyu,LU Chengzhi,XIA Dasheng
Department of Cardiology,Tianjin First Center Hospital,Tianjin 300192,China
ObjectiveTo explore the factors that could affect plasma level of D-dimmer test in acute aortic syndrome.MethodsBlood samples(2 mL)from acute aortic syndrome patients(n=76)obtained immediately after admission to detect D-dimmer using ELISA.Blood routine test and biochemical indicators tests including creatinine were also performed. White blood cell(WBC),serum value of creatinine,aortic contrast-enhanced CT,incidence of Shock and death were all recorded.The receiver-operating characteristic curve(ROC)was established to assess the potency of D-dimmer to predict hospital mortality.ResultsAccording to ROC analysis,the optimal cut-off value of D-dimmer to predict hospital mortality was>2 988.6 μg∕L(FEU),with 86.7%sensitivity and 70.5%specificity.The patients were divided into group A(D-dimmer<2 988.6 μg∕L FEU,n=45)and group B(D-dimmer≥2 988.6 μg∕L FEU,n=31).Onset timing was longer in group A than that in group B(P<0.01).Involvement of ascending aorta was less common in group A than in group B(P<0.05). Aortic intramural hematoma was less common in group A than in group B(P<0.05).Logistic analysis demonstrated that short time of onset,involvement of ascending aorta,non-aortic intramural hematoma were all independent factors of higher D-dimmer(≥2 988.6 μg∕L FEU).ConclusionPatients with long time of onset,without involvement of ascending aorta, with intramural hematoma are liable to have lower values of plasma D-dimmer.
D dimmer;acute aortic syndrome;aortic dissection;aortic intramural hematoma
R543.1
A
10.3969∕j.issn.0253-9896.2014.10.013
天津市第一中心医院心内科(邮编300192)

