耐阴观叶植物对室内甲醛敏感监测能力研究
鲁敏,郭天佑,闫红梅,刘顺腾,赵学明
(山东建筑大学艺术学院,山东济南250101)
耐阴观叶植物对室内甲醛敏感监测能力研究
鲁敏,郭天佑,闫红梅,刘顺腾,赵学明
(山东建筑大学艺术学院,山东济南250101)
甲醛是室内“三大隐形杀手”之一,并已成为室内头号化学污染物。如何安全、有效、持久的监测室内甲醛污染,已经成为亟待解决的重大课题。植物监测作为1种简洁、经济、准确、持续高效、环境友好型的方法,已逐渐成为室内甲醛污染监测的重要技术手段。研究运用密闭熏气法对8种室内耐阴观叶植物进行不同浓度的甲醛胁迫试验,对其甲醛污染监测能力的强弱进行综合评价。结果表明:在2、4和8 mg/m3甲醛浓度胁迫下,甲醛浓度与植物种类两因素之间及其协同作用,对植物叶绿素、丙二醛(MDA)、过氧化物酶(POD)变化的影响均能达到极显著水平;就两因素相比较而言,甲醛浓度对植物叶绿素、MDA、POD变化的影响更显著;综合不同甲醛浓度下8种植物的叶绿素、MDA、POD变化,对室内甲醛污染监测能力较强的植物有:玻璃海棠(X2)、凤仙花(X1);监测能力中等的植物有:吸毒草(X7)、天竺葵(X3)、薄荷(X4)、吊竹梅(X8);监测能力较弱的植物有:吊兰(X5)、绿萝(X6)。
室内甲醛;植物监测;耐阴观叶植物;监测能力
0 引言
随着室内装修装饰的大量涌现,室内化学污染物超标现象日趋严重,现代人类已经继第一污染期—煤烟型污染和第二污染期—光化学烟雾污染后,进入了以室内化学污染为标志的第三污染期。甲醛是室内“三大隐形杀手”之一,已成为室内头号化学污染物[1]。世界卫生组织研究表明:甲醛是“病态建筑综合症”(SBS,Sick Building Syndrome)的罪魁祸首,可以对人体多个器官、系统构成威胁,严重危害人类的健康和生命安全。如何安全、有效、持久的监测室内甲醛污染,已经成为亟待解决的重大课题。目前,国内外针对甲醛污染的监测技术开展了许多相关研究,其中植物监测作为1种简洁、经济、准确、持续高效、环境友好型的方法,已逐渐成为室内甲醛污染监测的重要技术手段,也是室内生态环境建设研究的核心内容和热点之一[2]。
尽管植物监测在室内甲醛污染的监测中发挥着至关重要的作用,但国内外所进行的研究多以植物净化室内甲醛污染为主,更侧重于植物净化性能及高吸收植物的筛选,而关于敏感监测植物的研究相对较少[3]。因此,筛选室内甲醛污染敏感监测植物,构建室内甲醛污染植物监测配置模式,必将成为室内污染监测和室内植物景观构建的前沿和重点[4]。文章通过研究耐阴观叶植物受室内不同浓度甲醛污染胁迫下的生理指标特性变化,综合评价室内耐阴观叶植物对甲醛污染监测能力的强弱,从而为人们选择室内甲醛污染敏感监测植物提供指导和理论基础。
1 材料与方法
1.1 试验材料
试验于2012年6—9月在山东建筑大学市政与环境工程学院进行,选用的8种常见室内耐阴观叶植物为:凤仙花(Impatiens balsamina)、玻璃海棠(Begonia semperflorens)、天竺葵(Pelargonium hortorum)、薄荷(Mentha haplocalyx)、吊兰(Chlorophytum comosum)、绿萝(Scindapsus aureum)、吸毒草(Melissa officinalis)、吊竹梅(Zebrina pendula)(见表1)。要求植物生长状态良好且株型较一致,花盆材质、大小完全一致,盆土性质与用量大致相同;试验前擦拭植物叶片晾干,将其盆土用聚乙烯薄膜包扎。

表1 植物选择和编号
1.2 试验方法
以Wolverton的实验装置为参照[5];定制80 cm ×80 cm×80 cm的玻璃熏气箱;熏气箱的顶盖与箱体互相分离,以便能够灵活拉动。熏气箱材质为普通玻璃,厚度在8 mm左右。箱体各连接处用玻璃胶密封,并涂少许凡士林试剂;放入实验植物和试剂后马上用海绵胶带密封顶盖与箱体接口,防止漏气。熏气箱内预留小风扇,加快污染物挥发速度;放置干湿温度计,观测舱内温度和湿度变化。
设置2、4、8 mg/m3等3个甲醛浓度梯度,将8种实验植物随机区组,分别用模拟舱进行甲醛熏气处理,24 h后测定植物叶绿素含量、丙二醛(MDA)含量、过氧化物酶(POD)活性的变化,3次重复。
1.3 生理指标测定方法
叶绿素含量采用浸提法测定[6-7];MDA含量的测定采用TBA比色法[8-9];POD活性的测定采用愈创木酚法[10]。
1.4 统计分析方法
将植物种类和污染物浓度看作是影响植物生理生化指标变化的两个因素,利用SPSS13.0软件等进行统计分析、方差分析及差异显著性检验[11-14]。
2 结果与分析
2.1 不同甲醛浓度下植物叶绿素含量变化
在化学气体污染的环境中,植物叶绿素含量会呈现一定程度的降低,从而导致叶片叶面失绿变色,植物光合作用减弱,并影响到植物物质积累能力和生长发育等[15-16]。在相同污染环境中,敏感性植物体内叶绿素合成所受抑制较抗性植物更明显。因此,植物体内叶绿素含量变化越大,其抗性水平越低,敏感性及监测能力也更强[17]。在室内化学污染环境中,利用耐阴观叶植物体内叶绿素含量变化间的差异,可作为衡量植物新陈代谢变化程度的主要生理指标,能够有效反映实验植物种类的监测能力。
在不同甲醛浓度下胁迫24 h后,对8种实验植物的叶绿素含量变化进行统计分析,结果见表2。

表2 不同甲醛浓度下植物的叶绿素含量变化
由表2可知,在2 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的叶绿素含量均呈现一定程度的降低。其中以凤仙花(X1)的叶绿素含量变化最大,降低26.32%,监测能力最强;玻璃海棠(X2)叶绿素含量降低25.32%,监测能力次之;绿萝(X6)的叶绿素含量变化最小,降低16.35%,监测能力最弱。根据叶绿素含量变化情况,对植物在2 mg/m3甲醛浓度下的监测能力由强到弱排序为:凤仙花(X1)>玻璃海棠(X2)>吸毒草(X7)>天竺葵(X3)>薄荷(X4)>吊竹梅(X8)>吊兰(X5)>绿萝(X6)。在4 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的叶绿素含量均呈现一定程度的降低。其中以玻璃海棠(X2)叶绿素含量变化最大,降低52.81%,监测能力最强;凤仙花(X1)叶绿素含量降低47.87%,监测能力次之;绿萝(X6)的叶绿素变化率最小,降低36.32%,监测能力最弱。根据叶绿素含量变化情况,对植物在4 mg/m3甲醛浓度下的监测能力由强到弱排序为:玻璃海棠(X2)>凤仙花(X1)>吸毒草(X7)>天竺葵(X3)>薄荷(X4)>吊竹梅(X8)>吊兰(X5)>绿萝(X6)。在8 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的叶绿素含量均呈现一定程度的降低。其中以玻璃海棠(X2)叶绿素含量变化最大,降低70.37%,监测能力最强;凤仙花(X1)叶绿素含量降低66.44%,监测能力次之;绿萝(X6)的叶绿素含量变化最小,降低55.51%,监测能力最弱。根据叶绿素含量变化情况,对植物在8 mg/m3甲醛浓度下的监测能力由强到弱排序为:玻璃海棠(X2)>凤仙花(X1)>天竺葵(X3)>吸毒草(X7)>吊竹梅(X8)>薄荷(X4)>吊兰(X5)>绿萝(X6)。
综合不同甲醛浓度下8种实验植物的叶绿素含量变化来看:在2、4、8mg/m3甲醛浓度胁迫下,根据叶绿素含量变化对8种植物的监测能力排序有所不同。在2 mg/m3甲醛浓度下胁迫24 h后,凤仙花(X1)以1%叶绿素含量变化率略大于玻璃海棠(X2);在4、8 mg/m3甲醛浓度下胁迫24 h后,玻璃海棠(X2)的叶绿素含量变化率均显著大于凤仙花(X1)。在2、4 mg/m3甲醛浓度下胁迫24 h后,吸毒草(X7)、薄荷(X4)的叶绿素含量变化率均分别显著大于天竺葵(X3)、吊竹梅(X8);在8 mg/m3甲醛浓度下胁迫24 h后,天竺葵(X3)、吊竹梅(X8)的叶绿素含量变化率均分别以不到1%的差异略大于吸毒草(X7)、薄荷(X4)。根据叶绿素含量变化情况,其余植物在2、4、8 mg/m3甲醛浓度胁迫下的监测能力排序并无变化。
上述分析表明,在2、4、8mg/m3甲醛浓度下,植物种类对叶绿素含量变化的影响达到极显著水平。综合不同甲醛浓度下8种实验植物的叶绿素含量变化,对室内甲醛污染监测能力强的有:玻璃海棠(X2)、凤仙花(X1);对室内甲醛污染监测能力中等的有:吸毒草(X7)、天竺葵(X3)、薄荷(X4)、吊竹梅(X8);对室内甲醛污染监测能力弱的有:吊兰(X5)、绿萝(X6)。
将甲醛浓度和植物种类看作是影响叶绿素含量变化的两个因素,利用SPSS13.0软件进行双因素方差分析,结果见表3。

表3 叶绿素含量变化的双因素方差分析
由表3可知,植物种类与甲醛浓度两因素之间及其协同作用,对8种实验植物叶绿素含量变化的影响均能达到极显著水平;甲醛浓度与植物种类的F值比较为8882.598>149.031,表明实验植物叶绿素含量变化受甲醛浓度的影响更为显著。
2.2 不同甲醛浓度下植物MDA含量变化
植物在外界污染胁迫下,受其体内自由基作用影响,植物脂质层能够发生氧化反应,造成体内丙二醛(MDA)含量上升,导致蛋白质、核酸等生命大分子交联聚合,从而威胁植株细胞稳定[18-19]。在相同污染环境中,敏感性监测植物体内MDA含量升高程度较抗性植物更明显。因此,植物体内MDA含量变化差异越大,则其抗性水平越低,敏感性及监测能力也更强。研究室内化学污染环境中耐阴观叶植物体内MDA含量上升程度间的差异,常常可反映不同机体内脂质层过氧化的程度,间接反映出细胞损伤的程度,是反映植物监测能力的重要指标[4]。
在不同甲醛浓度下胁迫24 h后,对8种实验植物的丙二醛(MDA)含量变化进行统计分析,结果见表4。

表4 不同甲醛浓度下植物的MDA含量变化
由表4可知,在2 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的MDA含量均呈现一定程度的升高。其中以玻璃海棠(X2)的MDA含量变化最大,升高72.19%,监测能力最强;凤仙花(X1)MDA含量升高69.97%,监测能力次之;绿萝(X6)MDA含量变化最小,升高26.80%,监测能力最弱。根据MDA含量变化情况,对植物在2 mg/m3甲醛浓度下的监测能力由强到弱排序为:玻璃海棠(X2)>凤仙花(X1)>吸毒草(X7)>薄荷(X4)>天竺葵(X3)>吊竹梅(X8)>吊兰(X5)>绿萝(X6)。在4 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的MDA含量均呈现一定程度的升高。其中以玻璃海棠(X2)的MDA含量变化最大,升高145.84%,监测能力最强;凤仙花(X1)MDA含量升高133.87%,监测能力次之;绿萝(X6)的MDA含量变化最小,升高36.99%,监测能力最弱。根据MDA含量变化情况,对植物在4 mg/m3甲醛浓度下的监测能力由强到弱排序为:玻璃海棠(X2)>凤仙花(X1)>吸毒草(X7)>薄荷(X4)>吊竹梅(X8)>天竺葵(X3)>吊兰(X5)>绿萝(X6)。在8 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的MDA含量均呈现一定程度的升高。其中以玻璃海棠(X2)的MDA含量变化最大,升高235.50%,监测能力最强;凤仙花(X1)MDA含量升高222.61%,监测能力次之;绿萝(X6)的MDA含量变化最小,升高72.66%,监测能力最弱。根据MDA含量变化情况,对植物在8 mg/m3甲醛浓度下的监测能力由强到弱排序为:玻璃海棠(X2)>凤仙花(X1)>吸毒草(X7)>薄荷(X4)>吊兰(X5)>天竺葵(X3)>吊竹梅(X8)>绿萝(X6)。
综合不同甲醛浓度下8种实验植物的MDA含量变化来看:在2、4、8mg/m3甲醛浓度胁迫下,根据MDA含量变化对8种植物的监测能力排序有所不同。在2、8mg/m3甲醛浓度下胁迫24 h后,天竺葵(X3)的MDA含量变化率均显著大于吊竹梅(X8);在4 mg/m3甲醛浓度下胁迫24 h后,吊竹梅(X8)的MDA含量变化率以不到1%的差异略大于天竺葵(X3)。在2、4 mg/m3甲醛浓度下胁迫24 h后,吊兰(X5)的MDA含量变化率均分别显著小于吊竹梅(X8)、天竺葵(X3);在8 mg/m3甲醛浓度下胁迫24 h后,吊兰(X5)的MDA含量变化率分别大于天竺葵(X3)、吊竹梅(X8)。根据MDA含量变化情况,其余植物在2、4、8 mg/m3甲醛浓度胁迫下的监测能力排序并无变化。
上述分析表明,在2、4、8mg/m3甲醛浓度下,植物种类对MDA含量变化的影响达到极显著水平。综合不同甲醛浓度下8种实验植物的MDA含量变化,对室内甲醛污染监测能力强的有:玻璃海棠(X2)、凤仙花(X1)、吸毒草(X7);对室内甲醛污染监测能力中等的有:天竺葵(X3)、薄荷(X4)、吊竹梅(X8);对室内甲醛污染监测能力弱的有:吊兰(X5)、绿萝(X6)。
将甲醛浓度和植物种类看作是影响MDA含量变化的两个因素,利用SPSS13.0软件进行双因素方差分析,结果见表5。

表5 MDA含量变化的双因素方差分析
由表5可知,植物种类与甲醛浓度两因素之间及其协同作用,对8种实验植物MDA含量变化的影响均能达到极显著水平;甲醛浓度与植物种类的F值比较为968.013>134.714,表明实验植物MDA含量变化受甲醛浓度的影响更为显著。
2.3 不同甲醛浓度下POD活性变化
在被污染环境中植物细胞会出现轻微失水,且过氧化物酶(POD)活性会呈现一定程度的升高,导致植物组织木质化程度升高,叶片出现干枯、萎焉等症状[20-22]。在相同污染环境中,敏感性植物体内POD活性升高程度较抗性植物更明显。因此,植物体内POD活性变化越大,则其抗性水平越低,敏感性及监测能力也更强。在室内化学污染环境中,植物体内POD活性变化程度之间的差异,可作为衡量植物组织不同老化程度的重要生理指标,能够有效反映植物种类的监测能力[23]。
在不同甲醛浓度下胁迫24 h后,对8种实验植物的过氧化物酶(POD)活性变化进行统计分析,结果见表6。
由表6可知,在2 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的POD活性均呈现一定程度的升高。其中以玻璃海棠(X2)的POD活性变化最大,升高77.93%,监测能力最强;凤仙花(X1)POD活性升高76.65%,监测能力次之;吊兰(X5)POD活性变化最小,升高25.90%,监测能力最弱。根据POD活性变化情况,对植物在2/mg·m3甲醛浓度下的监测能力由强到弱排序为:玻璃海棠(X2)>凤仙花(X1)>吸毒草(X7)>天竺葵(X3)>吊竹梅(X8)>薄荷(X4)>绿萝(X6)>吊兰(X5)。在4 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的POD活性均呈现一定程度的升高。其中以玻璃海棠(X2)的POD活性变化最大,升高132.47%,监测能力最强;凤仙花(X1)POD活性升高130.48%,监测能力次之;吊兰(X5)POD活性变化最小,升高57.11%,监测能力最弱。根据POD活性变化情况,对植物在4mg/m3甲醛浓度下的监测能力由强到弱排序为:玻璃海棠(X2)>凤仙花(X1)>吸毒草(X7)>薄荷(X4)>天竺葵(X3)>吊竹梅(X8)>绿萝(X6)>吊兰(X5)。在8 mg/m3甲醛浓度下胁迫24 h后,8种实验植物的POD活性均呈现一定程度的升高。其中以玻璃海棠(X2)的POD活性变化最大,升高247.59%,监测能力最强;凤仙花(X1)POD活性升高239.68%,监测能力次之;绿萝(X6)POD活性变化最小,升高94.30%,监测能力最弱。根据POD活性变化情况,对植物在8 mg/m3甲醛浓度下的监测能力由强到弱排序为:玻璃海棠(X2)>凤仙花(X1)>吸毒草(X7)>天竺葵(X3)>薄荷(X4)>吊竹梅(X8)>吊兰(X5)>绿萝(X6)。

表6 不同甲醛浓度下植物的POD活性变化
综合不同甲醛浓度下8种实验植物的POD活性变化来看:在2、4、8 mg/m3甲醛浓度胁迫下,根据POD活性变化对8种植物的监测能力排序有所不同。在2、8 mg/m3甲醛浓度下胁迫24 h后,天竺葵(X3)的POD活性变化率均大于薄荷(X4)、吊竹梅(X8);在4 mg/m3甲醛浓度下胁迫24 h后,天竺葵(X3)的POD活性变化率略小于薄荷(X4),高于吊竹梅(X8)。在2 mg/m3甲醛浓度下胁迫24 h后,吊竹梅(X8)的POD活性变化率大于薄荷(X4);在4、8 mg/m3甲醛浓度下胁迫24 h后,薄荷(X4)的POD活性变化率均大于吊竹梅(X8)。在2、4 mg/m3甲醛浓度下胁迫24 h后,绿萝(X6)的POD活性变化率均略大于吊兰(X5);在8 mg/m3甲醛浓度下胁迫24 h后,吊兰(X5)的POD活性变化率略大于绿萝(X6)。根据POD活性变化情况,其余植物在2、4、8 mg/m3甲醛浓度胁迫下的监测能力排序并无变化。
上述分析表明,在2、4、8mg/m3甲醛浓度下,植物种类对POD活性变化的影响达到极显著水平。综合不同甲醛浓度下8种实验植物的POD活性变化,对室内甲醛污染监测能力强的有:玻璃海棠(X2)、凤仙花(X1)、吸毒草(X7);对室内甲醛污染监测能力中等的有:天竺葵(X3)、薄荷(X4)、吊竹梅(X8);对室内甲醛污染监测能力弱的有:吊兰(X5)、绿萝(X6)。
将甲醛浓度和植物种类看作是影响POD活性变化的两个因素,利用SPSS13.0软件进行双因素方差分析,结果见表7。
由表7可知,植物种类与甲醛浓度两因素之间及其协同作用,对8种实验植物POD活性变化的影响均能达到极显著水平;甲醛浓度与植物种类的F值比较为745.808>119.507,表明植物POD活性变化受甲醛浓度的影响更为显著。
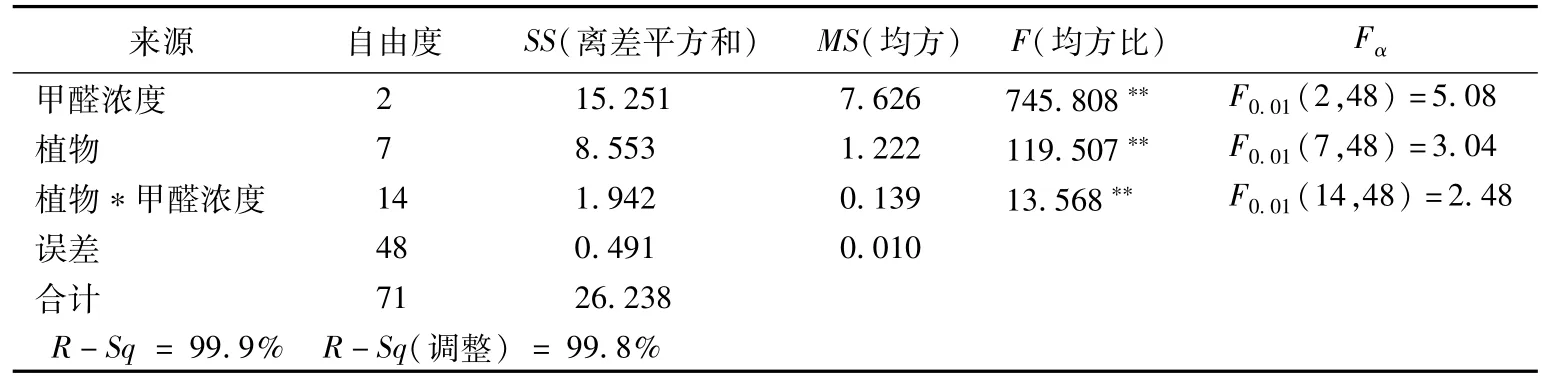
表7 POD活性变化的方差分析
3 结论
通过上述研究分析,可知:
(1)甲醛浓度与植物种类两因素之间及其协同作用,对8种植物叶绿素、MDA、POD变化的影响均能达到极显著水平;就两因素相比较而言,甲醛浓度对植物叶绿素、MDA、POD变化的影响更为显著。
(2)在2、4、8 mg/m3甲醛浓度下,植物种类对叶绿素含量变化的影响达到极显著水平。综合不同甲醛浓度下8种实验植物的叶绿素含量变化,对室内甲醛污染监测能力强的植物有:玻璃海棠(X2)、凤仙花(X1);对室内甲醛污染监测能力中等的植物有:吸毒草(X7)、天竺葵(X3)、薄荷(X4)、吊竹梅(X8);对室内甲醛污染监测能力弱的植物有:吊兰(X5)、绿萝(X6)。
(3)在2、4、8mg/m3甲醛浓度下,植物种类对MDA含量变化的影响达到极显著水平。综合不同甲醛浓度下8种实验植物的MDA含量变化,对室内甲醛污染监测能力强的植物有:玻璃海棠(X2)、凤仙花(X1)、吸毒草(X7);对室内甲醛污染监测能力中等的植物有:天竺葵(X3)、薄荷(X4)、吊竹梅(X8);对室内甲醛污染监测能力弱的植物有:吊兰(X5)、绿萝(X6)。
(4)在2、4、8 mg/m3甲醛浓度下,植物种类对POD活性变化的影响亦达到极显著水平。综合不同甲醛浓度下8种实验植物的POD活性变化,对室内甲醛污染监测能力强的植物有:玻璃海棠(X2)、凤仙花(X1)、吸毒草(X7);对室内甲醛污染监测能力中等的植物有:天竺葵(X3)、薄荷(X4)、吊竹梅(X8);对室内甲醛污染监测能力弱的植物有:吊兰(X5)、绿萝(X6)。
(5)综合2、4、8 mg/m3甲醛浓度胁迫下植物的叶绿素、MDA、POD变化,对室内甲醛污染监测能力强的植物有:玻璃海棠(X2)、凤仙花(X1);对室内甲醛污染监测能力中等的植物有:吸毒草(X7)、天竺葵(X3)、薄荷(X4)、吊竹梅(X8);对室内甲醛污染监测能力弱的植物有:吊兰(X5)、绿萝(X6)。
[1] 鲁敏,裴翡翡,刘顺腾,等.室内甲醛污染的植物生态修复技术研究进展[J].山东建筑大学学报,2011,26(6):592-597,615.
[2] 鲁敏,刘顺腾,赵洁,等.室内化学污染气体的植物监测研究进展[J].山东建筑大学学报,2013,28(1):58-62.
[3] 令狐昱慰,黎斌,李思锋,等.3种观赏植物对室内甲醛污染的净化及生长生理响应[J].西北植物学报,2011,31(4):776-782.
[4] 鲁敏,刘功生,陈强,等.9种耐荫观赏植物对室内甲醛污染生理抗性比较研究[J].山东建筑大学学报,2014,29(2):111-117.
[5] Wolverton B.C.,Wolverton J.D..Plants and soilmicroorganisms: removal of formaldehyde,xylene,and ammonia from the indoor environment[J].Journal of the Mississippi Academy of Sciences,1993,38(2):11-15.
[6] 安雪,李霞,潘会堂,等.16种室内观赏植物对甲醛净化效果及生理生化变化[J].生态环境学报,2010,19(2):379-384.
[7] 王江,张崇邦,柯世省,等.模拟酸雨和铜复合污染对白花泡桐生理特性的影响及其解毒机制[J].应用生态学报,2010,21(3):577-582.
[8] 井大炜,邢尚军,杜振宇,等.干旱胁迫对杨树幼苗生长,光合特性及活性氧代谢的影响[J].应用生态学报,2013,24(7): 1809-1816.
[9] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2006.
[10]王伟玲,王展,王晶英,等.植物过氧化物酶活性测定方法优化[J].实验室研究与探索,2010,29(4):21-23.
[11]陈佳瀛,邵勤龙,张佳慧,等.吊兰和常春藤对室内甲醛污染降解能力的研究[J].安徽农业科学,2013,41(15):6829-6831.
[12]刘栋,史宝胜,魏文欣,等.甲醛气体胁迫对3种观赏植物的形态及部分生理指标的影响[J].河北农业大学学报,2011,34(2):66-70.
[13]林丽仙,李惠华,张雪芹,等.甲醛对吊兰等植物细胞质膜相对透性和光合特性的影响[J].热带作物学报,2013,34(4):719 -726.
[14]李俊霖,李鹏,王恒蓉,等.特殊植物类群空气凤梨对大气污染物甲醛的净化[J].环境工程学报,2013,7(4):1451-1458.
[15]高厚强,张晓玲.合肥市大气污染对植物叶绿素(a、b)含量比例的影响[J].安徽农业科学,2003,31(3):367-368.
[16]鲁敏,赵学明,赵洁,等.室内苯污染胁迫下植物抗性的研究进展[J].山东建筑大学学报,2013,28(5):457-463.
[17]鲁敏,赵洁,冯兰东,等.室内苯污染的植物生态修复技术研究进展[J].山东建筑大学学报,2013,28(6):551-556.
[18]赵辉,王春彦,郝振萍,等.甲醛污染对4种观赏植物叶片叶绿素及MDA含量的影响[J].金陵科技学院学报,2009,25(2): 55-57.
[19]何勤勤,周俊辉.盆栽植物对室内甲醛空气污染的净化研究进展[J].江西农业学报,2014,(2):44-48.
[20]王佳佳,施冰,刘晓东,等.3种木本植物对室内空气净化能力的研究[J].北方园艺,2007,(11):142-143.
[21]陈段芬,李宪松,邸葆,等.甲醛对5种花卉质膜透性和保护酶活性的影响[J].华北农学报,2007,22(3):84-87.
[22]Giese M.,Bauer-Doranth U.,Langebartels C.,et al.Detoxification of formaldehyde by the spider plant(Chlorophytumcomosum L.)and by soybean(Glycine max L.)cell-suspension cultures[J].Plant Physiology,1994,104(4): 1301-1309.
[23]魏梅红,郑晶晶,饶瑶,等.甲醛对芦荟POD酶活性的影响[J].福建师范大学学报,2007,23(4):133-136.
(责任编辑:李雪蕾)
Research on sensitivemonitoring capability of shade tolerant foliage-plant to indoor formaldehyde pollution
Lu Min,Guo Tianyou,Yan Hongmei,et al.
(School of Art,Shandong Jianzhu University,Jinan 250101,China)
Formaldehyde which has been the top indoor chemical pollutant is one of the three indoor“invisible killers”.How to monitor indoor formaldehyde pollution safely,efficiently and constantly has been an urgent issue.As a simple,economical,accurate,sustainable,efficient and environmentfriendly method,plant monitoring has become an important technological means to monitor indoor formaldehyde pollution.Airtight fumigation method is used to do stressful experiment with different concentrations of formaldehyde treating eight kinds of indoor shade tolerant foliage-plants.The results show that under the stress of 2 mg/m3,4 mg/m3and 8mg/m3concentration of formaldehyde,the influences of plants,concentration and their synergistic effect on the change of chlorophyll content,MDA and POD all reach extremely significant level and the influence of concentration is comparatively more significant.From the change of chlorophyll content,MDA and POD,the plants with high monitoring capability include Begonia semperflorens(X2),Impatiens balsamina(X1);the plantswith moderatemonitoring capability include Melissa officinalis(X7),Pelargonium hortorum(X3),Menthahaplocalyx(X4),Zebrina pendula(X8);the plant with low monitoring capability include Chlorophytum comosum(X5),Scindapsus aureum(X6).
indoor formaldehyde;plant monitoring;shade tolerant foliage-plant;monitoring capability
X171.4,X173
A
1673-7644(2014)06-0504-08
2014-08-05
国家自然科学基金重点项目(20337010);住房和城乡建设部科技计划项目(2012-K6-5);山东省住房和城乡建设厅科技计划项目(2011YK046)
鲁敏(1963-),女(满族),教授,博士,主要从事室内外污染气体的植物生态修复技术、风景园林生态规划与设计、生态园林、生态城市等方面的研究.E-mail:lumin@sdjzu.edu.cn

