Hsa-miR202通过下调IL-10的表达抑制肺癌A549细胞的增殖
范小斌 林秋雄 罗燕飞
·基础研究·
Hsa-miR202通过下调IL-10的表达抑制肺癌A549细胞的增殖
范小斌①林秋雄②罗燕飞①
目的:探讨Hsa-miR202(人微小非编码RNA-202)对肺癌A549细胞增殖的影响及分子机制。方法:将Hsa-miR-202序列与ppG/miR/eGFP/Blasitidin质粒定向连接,构建靶向Hsa-miR-202基因的真核表达载体pmiR-202,运用脂质体将pmiR-202转染至A549细胞,WST-8法检测细胞增殖率,RT-PCR检测IL-10、miR-202的相对表达水平,Western blot与ELISA检测IL-10蛋白的表达水平,构建荧光素酶报告基因载体验证miR-202与IL-10的相互结合作用。结果:经DNA测序证实与设计完全一致,测序结果显示成功构建了miR-202的真核表达载体(pmiR-202),pmiR-202对A549细胞的增殖抑制率(24、48、72 h)分别为12%、38%、52%,并具有时间效应关系,较空白对照组及阴性对照组比较,差异有统计学意义(P<0.05);RT-PCR结果显示,转染pmiR-202后,miR-202的表达水平增加;过表达miR-202能下调IL-10基因及蛋白的相对表达水平,其相对水平分别为25%、0.75,IL-10活性的相对表达量为3.26±0.43 pg/mL,较空白对照组及阴性对照组比较,差异有统计学意义(P<0.05):荧光素酶活性结果显示,克隆IL-10-3'UTR的质粒与miR-202 mimics共转染293T细胞,引起荧光素活性的减低。结论:pmiR-202有效抑制A549细胞的增殖,并具有时间-效应关系,其机制可能是miR-202通过靶向结合IL-10的3'UTR从而下调其在A549细胞的表达有关。
Hsa-miR202 IL-10 肺癌 A549细胞 增殖
MicroRNA miRNA是一类长21~25个核苷酸的小分子非编码RNA,通过与特定mRNA 3'UTR结合抑制蛋白质表达参与生物的发育代谢及肿瘤的发生、发展等生命现象[1]。miRNA在正常肺组织和肺癌组织、小细胞肺癌和非小细胞肺癌(NSCLC)、肺癌和其他实体肿瘤甚至于其他疾病中的表达模式不同。这种不同不但存在于实体肿瘤中,同时也存在于患者的血浆和血清中[2]。miR-202在肺癌细胞呈低表达,具有抑癌的作用[3],因此运用过表达技术,探讨miR-202对肺癌的生物作用,对指导临床上肺癌的靶向基因治疗具有潜在的意义。
白细胞介素-10(interleukin-10,IL-10)是一种具有多向性生物活性的强免疫抑制因子,能通过自分泌或旁分泌的方式促进肿瘤生长,并能抑制细胞程序性死亡,调节宿主微环境,影响肿瘤的转移[4-5]。IL-10是肺癌细胞的自分泌因子,在肿瘤微环境中产生并释放至外周血中,具有诊断标志物的应用前景[6-7]。运用生物学软件(TargetScan 6.2)预测到MiR-202的靶基因IL-10,生物学信息提示两者之间存在可能相互调控关系,本研究旨在运用构建miR-202真核表达载体质粒,观察其对肺癌A549细胞增殖作用及分子机制,为进一步揭示肺癌的发病机制提供线索。
1 材料与方法
1.1 主要试剂
DMEM/F12培养基、Opti-MEM培养基(美国Gibco公司);脂质体LipofectamineTM2000(美国Invitrogen公司);真核表达载体质粒ppG/miR/eGFP/Blasitidin(上海吉玛公司);限制性内切酶BamHⅠ、HindⅢ、T4DNA连接酶(日本TaKaRa公司);琼脂糖凝胶回收DNA片段试剂盒、质粒小量提取试剂盒(美国Omega公司);CCK-8(Cell Count Kit-8)试剂(日本同仁化学研究所);SYBR green试剂盒、逆转录试剂盒(日本TaKaRa公司);流式细胞仪(美国BD公司);HEK293T、A549细胞株由暨南大学医学院生化教研室惠赠;多克隆IL-10抗体、单克隆抗体GAPDH(武汉博士德生物工程有限公司);ECL试剂盒(碧云天生物技术研究所)Hsa-miR-202(5'-AGAG GUAUAGGGCAUGGGAA3',MIMAT0002811)miRNA抑制剂(http://www.mirbase.org/cgi-bin/get_seq.pl?acc=MI zMAT0002811);阴性对照序列与阴性对照抑制剂购自上海锐博公司。
1.2 方法
1.2.1 Hsa-miR-202真核表达载体的构建 Hsa-mi R-202表达载体模板中的loop结构选用了TTGGCCACTG ACT以避免形成终止信号,microRNA表达载体正义链模板的5'端添加了TGCT;反义链模板的5'端添加了GTCC。Hsa-miR-202(5'-AGAGGUAUAGGGCAUGGG AA-3',MIMAT0002811),质粒构建与制备参照文献[6],质粒的鉴定测序送上海吉玛公司完成。
1.2.2 细胞培养和转染 A549细胞用含10%小牛血清的DMEM/F12培养基在37℃、5%CO2培养箱在培养,每3 d传代1次。取对数生长期的A549细胞,严格按LipofectamineTM2000转染试剂盒说明书操作进行。实验分为3组:空白对照组(不加转染试剂),pmiR-202组(含有ppG/miR-202/eGFP/Blasitidin质粒、LipofectamineTM2000),阴性对照组(negative group NC,含 LipofectamineTM2000、质粒 ppG/miR/ eGFP/Blasitidin)。
1.2.3 WST-8法检测细胞增殖抑制率 将1.0×105个/mL A549细胞接种于96孔细胞培养板,使pmiR-202终浓度分别为1.6 μg/mL,每组设5个复孔,非特异性对照组终浓度为1.6 μg/mL。置37℃、5% CO2培养24、48、72 h,每孔加入10 μL CCK-8试剂,继续孵育1 h,酶标仪检测吸光度(A450/655 nm)值并计算各组增殖抑制率。公式:增殖抑制率(%)=(1-ApmiR-202组/A空白对照组)×100%。
1.2.4 构建荧光素酶报告基因载体 运用生物学信息软件预测miR-202靶基因为IL-10(http://www.targetscan. org/cgi-bin/targetscan/vert_61/targetscan.cgi?species=Hu man&gid=&miR_c=miR-202-3p&miR_sc=&mir_nc=&mi rg=&sortType=&allTxs=&incl_nc=100)。提取A549细胞基因组DNA作为PCR扩增模板,调取IL-10全长的3'UTR序列,扩展引物分别添加XhoI和NotI酶切位点,XhoI和NotI双酶切PCR扩增产物,随后将扩增片段连接至psiCHECK-2载体上。连接产物转化感受态DH5a大肠杆菌,酶切鉴定正确的阳性克隆送测序。将构建好psiCHECK-2-IL-10-3'UTR与psiCHECK-2-IL-10-3'U TR-mut质粒按照以下分组进行转染:1)contrtol;2)miR-202 mimics(50 nmol/L);3)negative control or NC group,50 nmol/L;4)NI group,100 nmol/L,miRNA inhibitor;5)NCI group,50 nmol/L,a negative control for N)。RNA-Lipofectamine 2000复合物的配制严格按LipofectamineTM2000转染试剂盒说明书操作进行共转染HEK293T,最后双荧光检测。
1.2.5 RT-PCR检测IL-10的表达水平 细胞分组同1.4,用Trizol法提取RNA,Premir-202转染A549细胞,于转染后的48 h分别于荧光显微镜下观察细胞中GFP的表达;进而采取TRizol试剂提取RNA。采用M-MLV逆转录酶逆转录为cDNA。作为PCR反应的模版。miR-202 RT:5'-CTCAACTGGTGTCGTGGAGTCGGCA ATTCAGTTGAGTTCCCAT-3');miR-202F:5'-ACACTC CAGCTGGGAGAGGTATAGGGCATGG-3';miR-202R:5'-CTCAACTGGTGTCGTGGA-3');扩增片段大小72 bp。GAPDH-F:5'GGATTTGGTCGTATTGGG-3';GAPD H-R:5'GGAAGATGGTGATGGGATT-3';U6-F:5'-CT CGCTTCGGCAGCACA-3';U6-R:5'-AACGCTTCACGA ATTTGCGT-3';扩增片段大小94 bp。采用SYBRgreen掺入法进行荧光定量PCR反应,95℃5 min预变性,95℃15 s,60℃15 s,72℃32 s,共40个循环,所有的样本检测均包含一个不加模板的阴性对照,以排除假阳性的结果。计算运用2-△△Ct值来比较对照组和实验组的目的基因mRNA相对表达量的差异。
1.2.6 Western blot检测细胞IL-10的相对表达水平细胞分组同转染同本文1.2.5,培养48 h,消化收集各组细胞。按细胞裂解液(RIPA)说明书提取细胞蛋白。用BCA蛋白定量试剂盒进行蛋白定量,根据定量结果对各蛋白质样本进行校正。加入样品溶解液和样品,置沸水中煮5 min。不连续的聚丙烯酰胺凝胶电泳(10%聚丙烯酰胺分离胶和5%聚丙烯酰胺浓缩胶),电压80 V,进入分离胶后改为120 V,40 min。将凝胶上的蛋白条带转至硝酸纤维膜(NC)上,半干式转膜15V,18 min;TBST洗膜5 min,5%牛血清白蛋白封闭缓冲液室温封闭1 h,TBST洗膜3次,每次5 min。4℃过夜孵育一抗。TBST洗膜3次,每次5 min。37℃孵育二抗1 h。TBST洗膜3次,每次5 min。加入电化学(electrochemiluminescence,ECL)试剂,显影。BI-2000型图像分析软件分析IL-10和GAPDH的积分光密度,以GAPDH作为内参。
1.2.7 ELISA检测IL-10蛋白的表达水平 将本文1.2.6中提取的蛋白50 μL加入到抗体包被板条的相应孔中,37℃孵箱孵育90 min。洗板4次;加入生物素化抗体工作液,37℃孵箱孵育60 min。洗板4次,加入酶结合物工作液。37℃孵箱孵育30 min。洗板4次;加入显色剂,避光37℃孵箱孵育10~15 min;加入终止液,混匀后即刻测量OD450值。
1.3 统计学分析
采用SPSS 13.0统计软件进行统计学分析。计量资料以±s表示,用完全随机设计的单因素方差分析(one-way ANOVA)分析组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒的测序鉴定结果
重组质粒pmiR-202的测序结果与设计的引物序列完全相符,所含目的基因序列准确无误,表明成功构建了重组真核表达载体(图1)。
2.2 pmiR-202对A549细胞增殖的影响
采用1.6 μg/mL pmiR-202转染至A549细胞作用24 h、48 h、72 h后,增殖抑制率分别为12%、38%、52%,具有时间效应关系,较空白对照组及阴性对照组比较,差异有统计学意义(P<0.05)。结果说明过表达miR-202后,能有效抑制A549细胞的增殖(图2)。

图1 重组质粒测序图Figure 1 Diagrams of recombinant plasmid sequence

图2 pmiR-202对A549细胞增殖抑制的影响Figure 2 Effects of pmiR-202 on proliferation inhibition of A549 cells
2.3 miR-202与IL-10 3'UTR相互结合作用
运用miRNA靶基因预测软件TargetScan(human 6.2版本)预测到miR-202 3'UTR序列139 bp和146 bp处有miR-202结合位点。将IL-10 3'UTR全长序列(1 033 bp)克隆到pisCHI-2载体上luciferase基因的下游,构建psiCHECK-2-IL-10N-3'UTR载体,同miR-202 mimics共转染细胞。进一步分别检测突变结合位点1(505 bp)、结合位点2(869 bp)和同时突变两个结合位点(505、869 bp)确证 miR-202与IL-103'UTR的直接结合作用。共转染miR-202 mimics和psiCHECK-2-IL-10-3'UTR可以显著减少luciferase的活性(P<0.05),而突变结合位点1、2或同时突变两个结合位点,lusiferase的活性几乎不受影响,证明miR-202通过直接结合到IL-10 3'UTR上而发挥调控作用(图3)。
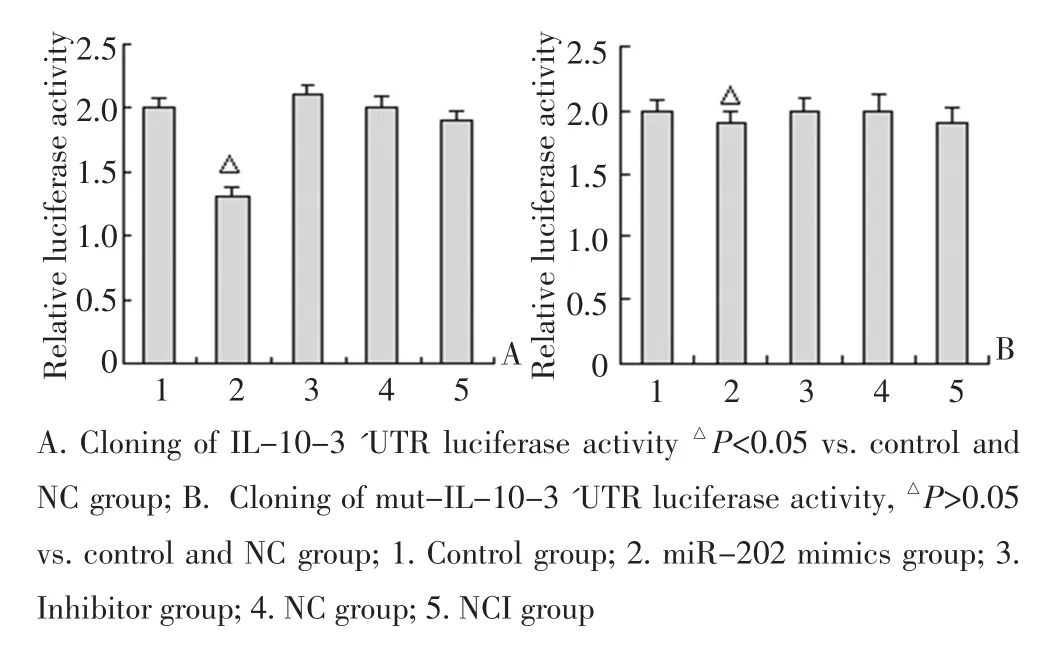
图3 荧光素酶活性的比较Figure 3 Comparison of luciferase activity
2.4 pmiR-202对miR-202、IL-10相对表达水平的影响
运用1.6 μg/mL的pmiR-202转染至A549细胞作用48 h后,RT-PCR分别检测miR-202、IL-10相对表达水平,过表达miR-202后,A549细胞内miR-202表达水平明显增加,其相对表达水平为145%,较空白对照组与阴性对照组比较差异有统计学意义(P<0.05)。结果说明构建的pmiR-202质粒有效,实现了miR-202在A549细胞内的过表达。过表达miR-202后,在A549细胞内IL-10相对表达水平显著下调,其相对表达水平为35%,较空白对照组与阴性对照组比较差异有统计学意义(P<0.05),结果说明miR-202通过直接结合到IL-10-3'UTR下调靶基因IL-10的表达水平(图4)。

图4 pmiR-202对miR-202、IL-10相对表达水平的影响Figure 4 Effects of pmiR-202 on the relative expression levels of miR-202 and IL-10
2.5 pmiR-202对IL-10蛋白相对表达水平的影响
用1.6 μg/mL的pmiR-202转染至A549细胞作用48 h后,运用Western blot检测IL-10蛋白的相对表达水平。过表达miR-202后,在A549细胞内IL-10蛋白相对表达水平显著降低,其相对表达水平为0.75,较空白对照组与阴性对照组比较差异有统计学意义(P<0.05,图5)。运用ELASA方法检测IL-10的相对活性,pmiR-202组IL-10的相对表达量为3.26±0.43 pg/mL,明显低于空白对照组(18.79±0.36 pg/mL)与阴性对照组(17.2±1.2 pg/mL)。结果说明miR-202通过直接结合到IL-10-3'UTR下调靶基因IL-10的蛋白表达水平。

图5 pmiR-202对IL-10蛋白相对表达水平的影响Figure 5 Effects of pmiR-202 on the relative protein expression levels of IL-10
3 讨论
早发现、早诊断仍是肺癌治疗的关键[8-9]。miRNA的表达具有时空特异性,在不同组织不同发育阶段中miRNA的水平有显著性差异。这种miRNAs表达模式具有分化的位相性和时序性,miRNA的表达谱不仅指miRNA的种类,也指各种miRNA的丰度,直接反映了细胞组织的分化发育状态。miRNA在不同肿瘤中具有特定的表达模式,这为肿瘤的基因诊断提供了一种新方法[10]。
研究表明Hsa-miR-202在肿瘤的形成中具有促癌与抑癌的作用。石棉作业的肺癌患者的肺癌组织miR-202呈低表达,可能抑制肺癌的发生与发展[11]。Yu等[12]利用RT-PCR分析112例非小细胞肺癌患者组织miR-202/let-7、miR-137miR-182和miR-372的表达情况,发现可以利用这些microRNA的综合表达情况来对患者进行诊断。因此,本研究选取在肺癌中具有抑癌作用的Hsa-miR-202,构建其真核表达载体质粒,运用质脂体2000转染至A549细胞,实现其在细胞中的稳定表达,充分发挥其抑癌作用。DNA测序证实与设计完全一致,测序结果显示成功构建了miR-202的真核表达载体(pmiR-202),pmiR-202对A549细胞的增殖抑制率(24、48、72 h)分别为12%、38%、52%,具有时间效应关系。
支气管肺癌的组织匀浆中IL-10水平升高,免疫组化证实IL-10源于肿瘤细胞。肺癌患者的TNM分期越晚,CD4+CD25+T和IL-10的表达水平越高[13]。CD4+CD25+T和IL-10水平随着肿瘤浸润转移程度的增加而升高,从而进一步改变宿主对肿瘤细胞的反应,使肿瘤细胞逃避机体的免疫杀伤[4,7]。本研究而转染pmiR-202后,能下调IL-10的相对表达水平空白对照组miR-202呈高达,研究结果证实了以上报道。miR-202调控NMYC的表达,并且能够抑制高扩增NYMC神经母细胞瘤的增殖[14-15]。为了进一步探讨miR-202与IL-10相互调控关系,运用生物学信息软件(Target Scan 6.2)预测到MiR-202的靶基因为IL-10,将克隆IL-10-3'UTR的质粒与miR-202 mimics共转染293T细胞,引起荧光素活性的减低。结果表明miR-202与IL-10存在相互调控关系。同时,miR-202通过直接结合到IL-10-3'UTR下调靶基因IL-10基因与蛋白的表达水平。
综上所述,pmiR-202有效抑制A549细胞的增殖,并具有时间-效应关系,其机制可能是miR-202通过靶向结合IL-10的3'UTR,从而下调其在A549细胞的表达。但是本研究仅运用了一株细胞株作为研究对象,存在一定的缺陷,今后将研究miR-202用动物实体瘤的生物学作用,为更深层次揭示miR-202在肺癌的调控机制奠定基础。
1 Nymark P,Guled M,Borze I,et al.Integrative analysis of microRNA,mRNA and aCGH data reveals asbestos-and histology-related changes in lung cancer[J].Genes Chromosomes and Cancer, 2011,50(8):585-597.
2 Mao K,Zhang PH,Zhang LG.Study on the early diagnosis of lung cancer microRNA[J].progress in cancer research and clinic, 2012,24(6):430-432.[毛 恺,张平晖,张立国.microRNA在肺癌早期诊断中的研究进展[J].肿瘤研究与临床,2012,24(6):430-432.]
3 Hristov D,Liu L,Adler JR,et al.Technique for targeting arteriovenous malformations using frameless image-guided robotic radiosurgery[J].Int J Radiat Oncol Biol Phys,2011,79(4):1232-1240.
4 Zhai JF,Du FL,Jin YR,et al.Clinical,detection and significance of [J].in lung cancer patients China regulatory T cells in peripheral blood and 2012 of IL-10,29(6):325-327.[翟晋芳,杜凤兰,绳晋雅,等.肺癌患者外周血调节性T细胞和IL-10的检测及其意义[J].中国肿瘤临床,2012,29(6):325-327.]
5 Zhang SY,Yu M,Gao J,et al.Journal of applied Cameleon calcium measurement system in the process of A549 cell apoptosis induced by H2O2in[J].China cell biology.2013(10).[张四洋,于 淼,高 建,等.Cameleon测钙系统在H2O2诱导的A549细胞凋亡过程中的应用[J].中国细胞生物学学报,2013,35(10):1453-1458.]
6 Ge HB.IL-10 in non small cell lung cancer,the prognosis of[J]. and correlation analysis of clinical pulmonary medicine magazine,a preliminary study on the expression level of MMP-9 the 2011,16 (7):1068-1070.[葛海波.非小细胞肺癌组织中IL-10,MMP-9的表达水平的初步研究及预后相关性分析[J].临床肺科杂志,2011, 16(7):1068-1070.]
7 Wang YF,Lu Q,Zhao JB,et al.The differences of[J].spectrum of modern oncology lncRNA expression in small cell lung cancer(06. 2014).[王亚芳,卢 强,赵晋波,等.小细胞肺癌组织中lncRNA表达谱的差异[J].现代肿瘤医学.2014,22(6):1231-1235.]
8 He JH,Li YG,Xie XY,et al.Construction of eukaryotic expression vector of hsa-miR-203 and its influence on the proliferation and apoptosis of K562 cells[J].Journal of clinical laboratory science, 2012,30(8):595-598.[何金花,黎毓光,谢杏仪,等.hsa-miR-203真核表达载体的构建及对K562细胞增殖与凋亡的影响[J].临床检验杂志,2012,30(8):595-598.]
9 Wang H.Research progress of[J].in the diagnosis and treatment of lung cancer MicroRNA China herald of medicine ISTIC,2011,8 (36).[王 鹤.MicroRNA在肺癌诊断和治疗方面的研究进展[J].中国医药导报ISTIC,2011,8(36).]
10 Farazi TA,Hoell JI,Morozov P,et al.MicroRNAs in human cancer [M]//MicroRNA Cancer Regulation.Springer Netherlands,2013:1-20.
11 Nymark P,Mohamed Guled,Ioana Borze Integrative analysis of microRNA,mRNA and aCGHData reveals asbestos-and histology-related changes in lung cancer genes[J].Genes Chromosomes Cancer.2011,50(8):585-597.
12 Yu SL,Chen HY,Chang GC,et al.MicroRNA signature predicts survival and relapse in lung cancer[J].Cancer Cell, 2008, 13(1):48-57.
13 Fortis C,Foppoli M,Gianotti L,et al.Increased interleukin-10 serum levels in patients with solid tumours.Cancer Lett,1996;104 (1):1-5.
14 Buechner J,Tomte E,Haug BH.Tumour-suppressor microRNAs let-7 and mir-101 target the proto-oncogene MYCN and inhibit cell proliferation in MYCN-amplified neuroblastoma[J].Br J Cancer.2011,105(2):296-303.
15 Hung JJ,Jeng WJ,Hsu WH,et al.Predictors of death,local recurrence,and distant metastasis in completely resected pathological stage-I non-small-cell lung cancer[J].J Thorac Oncol,2012,7(7):1115-1123.
(2014-05-05收稿)
(2014-10-20修回)
(本文编辑:杨红欣)

范小斌 专业方向为肿瘤临床检验。
E-mail:fanxiaobinvip@163.com
Hsa-mir-202 inhibit the proliferation of lung cancer A549 cells by reducing expression of IL-10
Xiaobin FAN1,Qiuxiong LIN2,Yanfei LOU1
1Department of Clinical Laboratory,2Medical Research Centre,Guangdong Provincial Academy of Medical Science and the People's Hospital of Guangdong Province,Guangzhou 510080,China
Objective:To study the effects of the overexpression of hsa-miR-202 on the proliferation and molecular mechanism of lung cancer A549 cells.Methods:A sequence of hsa-miR-202 with ppG/miR/eGFP/Blasitidin pasmid was directionally connected and a eukaryotic expression vector pmiR-202 of the target hsa-miR-202 gene was constructed.pmiR-202 was transtected to A549 cell with Lipofectamine 2000.The WST assay was used to detect the cell proliferation rate,and RT-PCR was used to detect the relative gene expression levels.Western blot analysis was used to detect the IL-10 protein expression levels.The interaction between miR-202 and IL-10 was examined using a luciferase reporter assay.Results:The design from the DNA sequencing results shows that a eukaryotic expression vector of miR-202 was successfully constructed.The proliferation inhibition rates of A549 cells by Pmir-202 were 12%, 38%,and 52%.The differences in the treatment group compared with the blank control and negative control groups were statistically significant.The RT-PCR results showed that the relative expression levels of miR-202 increased after transfection with pmiR-202.Overexpression of miR-202 can downregulate the relative gene and protein expression levels of IL-10,and the relative levels were 25%and 0.75,respectively.Compared with the blank control and the negative control groups,the difference was statistically significant(P<0.05).The fluorescent activity was reduced when transfection was performed with miR-202 mimics,and IL-10-3'UTR plasmid was cloned.Conclusion:pmiR-202 effectively inhibited the proliferation of A549 cells and exhibited a time-effect relationship with miR-202 by targeted combination with IL-10 3'UTR to downregulate IL-10 expression inA549 cells.
hsa-mir-202,IL-10,lung cancer,A549 cells,proliferation
10.3969/j.issn.1000-8179.20140643

