男性乳腺癌临床病理特征及预后分析*
刘新丽 刘芳芳 郑 屹 沈蓓蓓 付 丽
·临床研究与应用·
男性乳腺癌临床病理特征及预后分析*
刘新丽 刘芳芳 郑 屹 沈蓓蓓 付 丽
目的:探讨男性乳腺癌临床病理特征、分子亚型特征及预后的特点。方法:收集天津医科大学肿瘤医院135例的男性乳腺癌患者和377例同期诊断为非特殊型浸润性导管癌女性患者临床病理资料,比较两组预后差异,对患者年龄、肿瘤大小、淋巴结转移、分期、免疫组织化学指标等因素与预后的关系进行统计学分析。结果:与女性乳腺癌相比,男性乳腺癌好发于乳晕区(P=0.001),具有较高的雌激素受体、孕激素受体阳性表达率(P<0.05);男性乳腺癌以Luminal A和Luminal B1型为主,其所占比例高于女性乳腺癌(P<0.05);男性乳腺癌5和10年总生存率为81.3%和68.1%、无病生存率为72.3%和50.5%,显著低于同期诊断的女性乳腺癌5、10年总生存率(91.8%、79.2%)(P=0.001)、无病生存率(82.6%、60.9%)(P=0.003)。单因素生存分析显示肿瘤大小、淋巴结转移、病理学分期、HER-2状态、分子分型是影响男性乳腺癌患者总生存和无病生存预后的因素(P<0.05),Cox多因素分析显示肿瘤大小和淋巴结转移与男性乳腺癌患者预后有关(P<0.05)。结论:男性乳腺癌较女性乳腺癌预后差,分子亚型以Luminal A和Luminal B1型为主,其所占比例高于女性乳腺癌,表明两者可能具有不同的生物学行为,早期诊断、早期治疗是改善其预后的关键。
乳腺肿瘤 男性 分子亚型 预后 总生存 无病生存
男性乳腺癌(male breast cancer,MBC)在恶性肿瘤中较少见,其发病率在所有乳腺癌中低于1.0%[1],但近年来呈逐步上升趋势[2]。男性与女性乳腺癌(female breast cance,FBC)在发病率、发病年龄、临床表现和转归方面存在差异,目前国内对男性乳腺癌的报道多为小样本的回顾性分析,缺乏对照研究。为提高对男性乳腺癌的认识,本研究收集135例男性乳腺癌患者和同期诊断的377例女性乳腺癌患者的临床病理资料,分析其临床病理特征、分子亚型特征及预后的特点。
1 材料与方法
1.1 临床资料
收集天津医科大学肿瘤医院乳腺病理研究室1995年1月至2014年5月经病理确诊的男性乳腺癌患者135例,包括119例非特殊型浸润性导管癌(invasive ductal carcinoma not otherwise specified,IDC-NOS)和16例其他组织学类型,并采用抽签法简单随机抽取同期诊断为IDC-NOS的女性患者377例作为对照,收集所有患者相关的临床病理资料。所有病例均由2位高年资病理医师复习切片并按照WHO乳腺及女性生殖器官肿瘤病理学和遗传学分类标准(2012年)[3]诊断分型,乳腺癌病理组织学分级按照Elston and Elli分级系统分为Ⅰ、Ⅱ、Ⅲ级[4]。按St.Gallen共识(2013年)乳腺癌分子分型标准[5]将本研究中乳腺癌分为Luminal A、Luminal B1、Luminal B2、HER-2过表达、Basal-like型。高水平雌激素是男性乳腺癌的风险因素,新生儿、青少年(20~30岁)、男性更年期(51~70岁)是男性乳腺发育的激素依赖性年龄高峰,在这3个年龄段中体内的内源性或外源性雌激素水平相对或绝对上升,针对上述年龄层次以50岁分层。本研究135例男性患者中位年龄为59(11~86)岁,377例女性患者中位年龄为57(29~87)岁。所有患者术前均未接受放化疗和靶向治疗。所有患者均从确诊时开始随访,随访截止日期为2014年7月。共随访1~175个月,中位随访时间为55个月。本研究经本院伦理委员会认可。
1.2 方法
采用免疫组织化学染色SP法检测雌激素受体(estrogen receptor,ER)、孕激素受体(progestogen receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)在乳腺癌组织的表达。ER、PR(浓度为1∶75)购自北京中杉金桥生物技术有限公司,HER-2(浓度为1∶600)为Thermo Fisher公司产品。实验步骤按免疫组织化学SP-9000试剂盒说明书进行,每批实验均设阳性和阴性外对照(以PBS缓冲液代替一抗),切片内的正常乳腺组织作为内对照,染色结果采用DAB显色。
结果的判定由2位高年资病理医师采用双盲法阅片。1)ER和PR:阳性细胞着色定位于细胞核,以切片中阳性细胞≥1%为阳性[6];2)HER-2:阳性细胞着色定位于细胞膜,浸润性肿瘤细胞无胞膜着色为(0);任何比率的浸润性肿瘤细胞呈弱而不完整的胞膜着色或浸润性肿瘤细胞<10%呈弱但完整的胞膜着色为(+);浸润性肿瘤细胞≥10%呈弱或不一致的、完整的胞膜着色,或浸润性肿瘤细胞≤30%呈强且完整的胞膜着色为(++);浸润性肿瘤细胞>30%呈强且完整的胞膜着色为(+++)[7]。HER-2免疫组织化学(0)和(+)为HER-2阴性,(+++)为阳性,(++)需要通过荧光原位杂交(fluoresence in situ hybridization,FISH)检测进一步确认。
1.3 统计学分析
采用SPSS 19.0统计学软件进行分析。两组年龄比较采用Student's t检验,其他因素相关性采用χ2检验。生存分析采用Kaplan-Meier法,Log rank检验比较生存差异,采用Cox比例风险模型分析影响预后的因素。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床病理特征
135例男性乳腺癌患者中128例(94.8%)均因发现乳腺肿物就诊,7例(5.2%)因乳头溢液就诊。从发现乳腺肿物至就诊的时间为0.1~480.0个月,平均21.8个月。肿瘤多位于乳晕区占54.8%(74/135),最大直径为0.4~6.0 cm,平均2.6 cm。135例男性乳腺癌患者中非特殊型浸润性导管癌119例(88.2%),其他病理类型包括浸润性乳头状癌6例(4.4%)、黏液腺癌4例(3.0%)、腺样囊性癌2例(1.5%)、分泌型癌2例(1.5%)、鳞状细胞癌伴乳头派杰氏病1例(0.7%)、髓样癌1例(0.7%)。统计学分析发现,男性乳腺癌中16例其他组织学类型剔除与否,结论一致。
本研究中,男性乳腺癌和女性乳腺癌患者的平均发病年龄分别为(59.50±11.19)岁和(57.21±14.36)岁(P>0.05)。男性乳腺癌患者与女性患者临床病理特征进行比较,结果显示男性乳腺癌好发于乳晕区,且具有较高的ER、PR阳性表达率(P<0.05);男性乳腺癌以Luminal A和Luminal B1型多见,两分子亚型所占比例均高于女性乳腺癌(P<0.05,表1)。
2.2 生存情况
135例男性乳腺癌5和10年总生存率为81.3%和68.1%、无病生存率为72.3%和50.5%,显著低于同期诊断的女性乳腺癌5和10年总生存率91.8%和79.2%(P=0.001)、无病生存率82.6%和60.9%(P=0.003),见图1。男性乳腺癌Luminal A和Luminal B1型分子亚型的生存率分析发现,两组总生存率(P=0.427)和无病生存率(P=0.284)均无显著性差异(图2)。

表1 135例男性乳腺癌和377例女性乳腺癌临床病理学特征比较Table 1 Comparison ofclinicopathologicalcharacteristicsbetween groups of 135 MBC patients and 377 FBC patients
2.3 单因素和多因素Cox比例风险模型的预后分析
将可能影响乳腺癌预后的因素包括年龄、肿瘤大小、组织学分级、淋巴结转移、pTNM分期、ER、PR、HER-2、分子分型、术后化疗、放疗和内分泌治疗进行单因素分析,结果显示肿瘤大小、淋巴结转移、pTNM分期、HER-2状态、分子分型是影响男性乳腺癌患者总生存和无病生存的预后因素(P<0.05),而患者的年龄、组织学分级、ER、PR、术后是否接受化疗、放疗和内分泌治疗对其预后无显著影响(P>0.05,表2)。

图1 男性乳腺癌和女性乳腺癌患者生存曲线Figure 1 Survival curves of MBC and FBC patients

图2 男性乳腺癌患者Luminal A和Luminal B1型的生存曲线Figure 2 Survival curves of MBC patients based on Luminal A and Luminal B1 subtypes
将影响男性乳腺癌患者总生存和无病生存单因素分析结果中有意义的因素纳入Cox比例风险模型进行多因素分析。pTNM分期与肿瘤大小及淋巴结转移因存在共线性,未对其行多因素分析。多因素分析结果显示,肿瘤大小、淋巴结转移是影响男性乳腺癌患者总生存和无病生存的独立预后因素(P<0.05,表3)。

表2 男性乳腺癌患者影响预后的单因素分析Table 2 Univariate analysis of prognosis in MBC patients
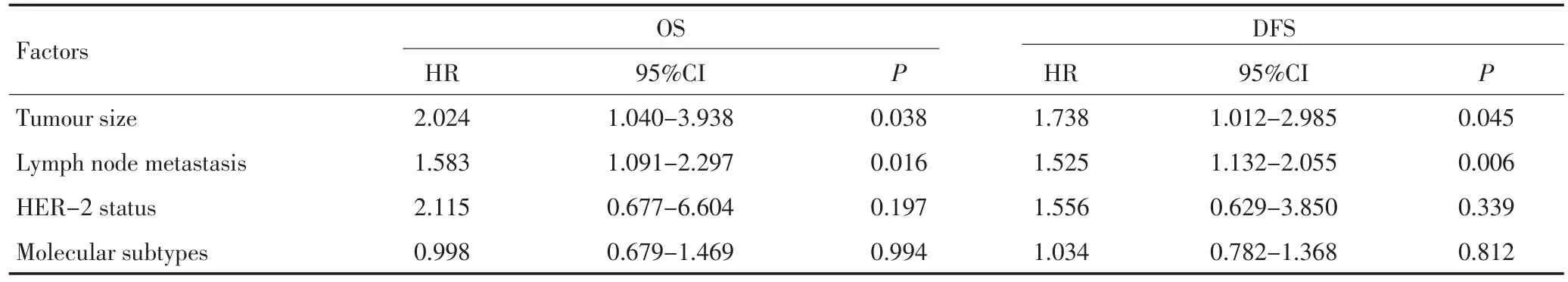
表3 男性乳腺癌患者影响总生存和无病生存的Cox多因素分析Table 3 Cox multivariate analyses of OS and DFS in MBC patients
3 讨论
男性乳腺癌患者发病率较低,在所有乳腺癌中以往报道所占比例不足1.0%[1],近年来其发病率呈现逐步增长趋势[2]。男性乳腺癌患者的发病率在不同地区存在差异,非洲较高、欧美次之、亚洲最低[8],其平均发病年龄较女性乳腺癌偏高。国外报道男性乳腺癌患者平均发病年龄为65~67岁,国内报道平均发病年龄为50~60岁,较女性乳腺癌发病年龄晚5~10年,且发病年龄频数分布不呈现双峰发病的特点[2]。本研究135例男性乳腺癌患者的平均发病年龄为59.50岁,377例女性患者的平均发病年龄为57.21岁,与文献报道基本一致。
有文献报道,男性乳腺癌具有与女性乳腺癌相似的临床病理特征,非特殊型浸润性导管癌是其最常见的组织学类型(64.0%~93.0%)、浸润性乳头状癌次之(2.6%~5.0%)[9]。本研究135例男性乳腺癌患者中非特殊型浸润性导管癌119例(88.2%)、浸润性乳头状癌6例(4.4%),与文献报道一致。73%~95%患者以乳腺无痛性肿块伴或未伴乳头溢液为首发症状就诊[10],本研究135例男性患者中128例(94.8%)均因发现乳腺无痛性肿物就诊、7例(5.2%)因乳头血性溢液就诊,此结果与文献报道相近。与女性乳腺癌不同,男性乳腺组织缺乏小叶结构,乳腺小叶癌在男性乳腺癌中少见,男性乳腺癌好发于乳晕区[11]。本研究中,男性乳腺癌乳晕区发病率高于女性乳腺癌(P<0.05),与文献报道一致。
Nilsson等[12]研究表明,男性乳腺癌患者ER、PR阳性率分别为93.0%、77.0%;女性乳腺癌ER、PR阳性率分别为76.0%、67.0%。本研究结果显示,男性乳腺癌ER、PR阳性率分别为83.7%、77.0%,女性乳腺癌ER、PR阳性率分别为70.8%、65.3%,男性乳腺癌的ER、PR阳性率均明显高于女性乳腺癌(P<0.05)。与女性乳腺癌相比,男性乳腺癌具有较高的ER、PR阳性表达率,这可能与男性雌激素水平较低有关,使雌激素与受体能够充分结合。Lundgren等[13]研究表明,男性乳腺癌ER阳性对他莫西芬治疗的反应不同于女性乳腺癌患者,因此,激素受体阳性并不能预示男性乳腺癌有较好的预后。研究表明[14],女性乳腺癌不同分子亚型中Luminal A型预后最好,Luminal B型次之,HER-2过表达型和Basal-like型预后最差。男性乳腺癌不同分子亚型是否与其预后相关尚无明确的临床研究证据。Nilsson等[15]研究表明,男性乳腺癌以Luminal A型和Luminal B型多见,且比例高于女性乳腺癌。本研究发现,男性乳腺癌以Luminal A型和Luminal B1型为主,两分子亚型均高于女性乳腺癌,且男性乳腺癌Luminal A型比例高于Luminal B1型,此结果与文献报道一致。对Luminal A型和Luminal B1型两分子亚型进行生存率分析发现,二者总生存率和无病生存率均无显著性差异(P>0.05)。因此有待于更全面、更大样本的研究来进一步阐述不同分子亚型对于男性乳腺癌预后的意义。
男性乳腺癌与女性乳腺癌预后的差异一直存在争议。文献报道[16],男性乳腺癌与女性乳腺癌的预后无明显差异。最近有研究表明[11,17],男性乳腺癌预后较女性乳腺癌差,其5年总生存率(79.6%vs.90.0%)和无病生存率(65.6%vs.74.9%)均明显低于女性乳腺癌患者。本研究结果显示,男性乳腺癌5和10年总生存率(81.3%vs.68.1%)、无病生存率(72.3%vs.50.5%),显著低于同期诊断的女性乳腺癌患者5和10年总生存率(91.8%vs.79.2%)、无病生存率(82.6%vs. 60.9%)(P<0.05)。单因素分析结果显示男性乳腺癌患者的肿瘤大小、淋巴结转移、pTNM分期、HER-2状态、分子分型显著影响其预后,多因素分析显示肿瘤大小和淋巴结转移是影响男性乳腺癌患者总生存和无病生存的独立预后因素,据此本研究认为肿瘤大小和淋巴结转移可作为预测男性乳腺癌预后不良的一个独立指标。淋巴结转移数目越多预后越差,因此早期诊断、早期治疗是改善预后的关键。
综上所述,男性乳腺癌较为少见,其总生存率和无病生存率均明显低于女性乳腺癌,目前缺乏对男性乳腺癌前瞻性随机对照研究,其治疗指南多参照女性乳腺癌。有必要进一步进行分子生物学研究,探讨男性乳腺癌的生物学行为,找到针对男性乳腺癌更佳的治疗方式,从而提高患者的生存率。
1 Contractor KB,Kaur K,Rodrigues GS,et al.Male breast cancer:is the scenario changing[J].World J Surg Oncol,2008,6:58.
2 Johansson I,Killander F,Linderholm B,et al.Molecular profiling of male breast cancer-lost in translation[J]?Int J Biochem Cell Biol, 2014,53:526-535.
3 Lakhani SR,Ellis IO,Schnitt SJ,et al.World Health Organization classification of tumours//WHO classification of tumours of the breast[M].4th ed.Lyon:IARC Press,2012:8.
4 Wei J,Cui L,Liu F,et al.E-selectin and Sialyl lewis X expression is associated with lymph node metastasis of invasive micropapillary carcinoma of the breast[J].Int J Surg Pathol,2010,18(3):193-200.
5 Goldhirsch A,Winer EP,Coates AS,et al.Personalizing the treatment of women with early breast cancer:highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J].Ann Oncol,2013,24(9):2206-2223.
6 Hammond ME,Hayes DF,Dowsett M,et al.American Society of Clinical Oncology/College of American Pathologists Guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J].Arch Pathol Lab Med, 2010,134(6):907-922.
7 Wolff AC,Hammond ME,Schwartz JN,et al.American Society of Clinical Oncology/College of American Pathologists Guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer[J].J Clin Oncol,2007,25(1):118-145.
8 Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
9 Korde LA,Zujewski JA,Kamin L,et al.Multidisciplinary meeting on male breast cancer:summary and research recommendations [J].J Clin Oncol,2010,28(12):2114-2122.
10 Ruddy KJ,Winer EP.Male breast cancer:risk factors,biology,diagnosis,treatment,and survivorship[J].Ann Oncol,2013,24(6):1434-1443.
11 Chen X,Liu X,Zhang L,et al.Poorer survival of male breast cancer compared with female breast cancer patients may be due to biological differences[J].Jpn J Clin Oncol,2013,43(10):954-963.
12 Nilsson C,Koliadi A,Johansson I,et al.High proliferation is associated with inferior outcome in male breast cancer patients[J].Mod Pathol,2013,26(1):87-94.
13 Lundgren K,Brown M,Pineda S,et al.Effects of cyclin D1 gene amplification and protein expression on time to recurrence in postmenopausal breast cancer patients treated with anastrozole or tamoxifen:a TransATAC study[J].Breast Cancer Res,2012,14(2):R57.
14 Blows FM,Driver KE,Schmidt MK,et al.Subtyping of breast cancer by immunohistochemistry to investigate a relationship between subtype and short and long term survival:a collaborative analysis of data for 10,159 cases from 12 studies[J].PLoS Med,2010,7(5):e1000279.
15 Nilsson C,Johansson I,Ahlin C,et al.Molecular subtyping of male breast cancer using altemative definitions and its prognostic impact [J].Acta Oncol,2013,52(1):102-109.
16 Miao H,Verkooijen HM,Chia KS,et al.Incidence and outcome of male breast cancer:an international population-based study[J].J Clin Oncol,2011,29(33):4381-4386.
17 Nilsson C,Holmqvist M,Bergkvist L,et al.Similarities and differences in the characteristics and primary treatment of breast cancer in men and women-a population based study(Sweden)[J].Acta Oncol,2011,50(7):1083-1088.
(2014-07-24收稿)
(2014-09-16修回)
(本文编辑:张亻 刡)
Clinicopathological features and prognostic factors of male breast cancer
Xinli LIU,Fangfang LIU,Yi ZHENG,Beibei SHEN,Li FU
Department of Breast Cancer Pathology and Research Laboratory,Tianjin Medical University Cancer Institution and Hospital,Na-tional Key Discipline of Pathology,National Clinical Research Center of Cancer,Key Laboratory of Breast Cancer Prevention and Therapy,Tianjin Medical University,Ministry of Education,Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China.
This work was supported by grants from the National Natural Science Foundation of China(No.30930038).
Objective:To investigate the clinicopathological features,molecular subtypes,and prognosis for male breast cancer (MBC).Methods:Clinical data of 135 MBC patients and 377 female breast cancer(FBC)patients with invasive ductal carcinoma not otherwise specified were collected.Differences between the prognostic outcomes of the two groups were compared,and the relationship between clinicopathological characteristics and prognostic significance was analyzed.Results:More MBC patients suffered from centrally located tumors,with mammary areola as the predilection site,than FBC patients.The two groups exhibited significant differences(p=0.001).Male patients had a higher ER frequency and positive PR rate than female patients(P<0.05).The most common molecular subtypes of MBC were Luminal A and Luminal B1,and significant differences were identified for molecular subtypes between MBC and FBC patients(P<0.05).The 5-year and 10-year overall survival rates in MBC patients were 81.3%and 68.1%,and disease-free survival rates were 72.3%and 50.5%,respectively.These values were significantly lower than those of FBC patients in the same-period diagnostic[i.e.,91.8%and 79.2%(P=0.001),and 82.6%and 60.9%(P=0.003),respectively].Kaplan-Meier survival analysis,tumor size,lymph node metastasis,pathological stage,HER-2 status,and molecular subtypes affected the prognosis of MBC patients(P<0.05).In multivariate analysis,the tumor size and lymph node metastasis were associated with a poor prognosis(P<0.05).Conclusion:MBC patients experienced a more unfavorable prognosis compared with FBC patients.The most common molecular subtypes of MBC were Luminal A and Luminal B1,which were higher in proportion in MBC patients than in FBC patients.Biological differences contributed to the poor prognosis.Therefore,early diagnosis and treatment are key to improving the prognosis.
breast neoplasm,male,molecular subtype,prognosis,overall survival,disease-free survival

10.3969/j.issn.1000-8179.20141237
天津医科大学肿瘤医院乳腺病理研究室,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,乳腺癌防治教育部重点实验室(天津市300060)
*本文课题受国家自然科学基金项目(编号:30930038)资助
付丽 fulijyb@hotmail.com
刘新丽 专业方向为乳腺癌干细胞表型的研究。
E-mail:yanyushi85@163.com

