EGCG对肝癌细胞HepG2凋亡及脂肪酸合酶表达的影响
赵 刚,李 红,史海涛,邹百仓,鲁晓岚,董 蕾
(西安交通大学医学院第二附属医院消化内科,陕西西安 710004)
表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)是从中国绿茶中提取的一种水溶性成分,也是茶多酚中最有效的活性成分[1]。EGCG具有抗菌、抗病毒、抗氧化、抗动脉硬化、抗血栓形成、抗血管增生及抗炎等作用;也有研究显示EGCG具有抑制多种肿瘤细胞增殖及诱导凋亡的作用,但其作用机制尚不完全清楚[2-4]。脂肪酸合酶(fatty acid synthase, FASN)是催化内源性长链脂肪酸合成的关键酶。大量的研究表明,多种恶性肿瘤组织中FASN水平往往异常升高,且其升高程度与肿瘤的预后呈负相关[5],提示FASN与肿瘤的发生发展关系密切,有望成为新的抗肿瘤研究的靶点。我们以人肝癌细胞株HepG2为研究对象,在前期工作的基础上,以3个梯度浓度EGCG分别处理细胞,观察其诱导细胞凋亡的作用及对凋亡相关基因Bcl-2、Bax 以及FASN表达的影响。
1材料与方法
1.1材料人肝癌细胞株HepG2购自上海生物医学工程研究中心。EGCG购自上海佳和生物科技有限公司;DMEM培养基购自GIBCO公司;胎牛血清为北京元亨生物工程有限公司产品;胰蛋白酶、TRIzol及二甲基亚砜(DMSO)购自Sigma公司;Hoechst33258购自上海君创生物科技有限公司;Annexin V/PI双染流式细胞检测试剂盒为Invitrogen公司产品;反转录试剂盒由Promega公司提供;PCR相关引物由上海英骏生物科技有限公司代为合成。常规细胞培养箱为美国Nuaire公司产品;德国LEICA DM B2 型荧光显微镜;PTC2000型PCR仪为MJ Research 公司生产;Gel DOC型全自动凝胶成像分析系统为美国Bio Rad公司产品。
1.2方法
1.2.1HepG2细胞的培养及实验分组 HepG2肝癌细胞在含100 mL/L胎牛血清、1×105U/L的青霉素和链霉素的DMEM培养基中,37 ℃、50 mL/L CO2条件下常规传代培养。设对照组(无药物干预)和实验组,其中实验组又分为80、120、160 μmol/L EGCG组。细胞分别接种于24孔板和50 mL培养瓶中培养24 h,再经药物作用48 h后常规制片、收集细胞进行流式细胞术分析或提取全基因组RNA待检。
1.2.2Hoechst33258染色及荧光显微镜观察凋亡情况 将Hoechst33258用PBS配制成5 μg/mL染液,室温下对细胞进行避光染色15 min,荧光显微镜下观察并拍照。
1.2.3流式细胞术检测凋亡 收集细胞并计数,按照Annexin V/PI双染流式细胞检测试剂盒说明进行染色后,上机检测并定量分析细胞凋亡发生率。
1.2.4半定量RT-PCR方法检测 FASN及凋亡相关基因Bcl-2及Bax的相关PCR引物序列见表1。收集细胞后用Trizol试剂提取细胞内总RNA,按照反转录试剂盒说明书制备模板cDNA。PCR条件为:94 ℃变性1 min,56 ℃退火30 s,72 ℃延伸1 min,共35个循环。对PCR产物进行琼脂糖凝胶电泳后进行成像分析。

表1 PCR引物序列
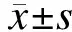
2结果
2.1荧光显微镜观察Hoechst33258染色结果肿瘤细胞经EGCG作用48 h后,Hoechst33258染色可见部分细胞核浓染呈亮蓝色,细胞核染色质凝集及边缘化,出现凋亡小体,而对照组细胞胞质及细胞核呈均质浓染的蓝色(图1)。
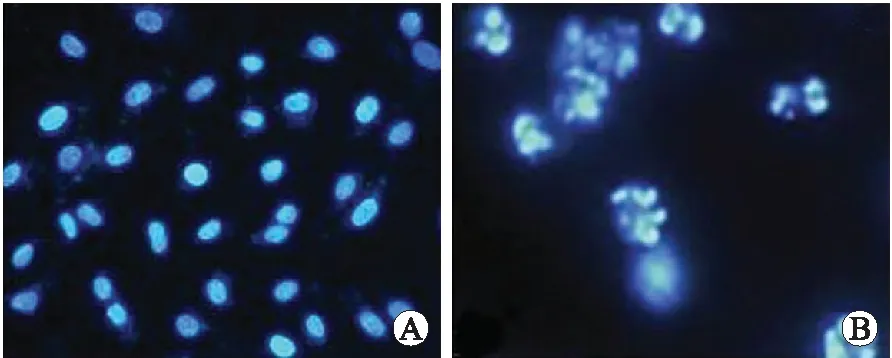
图1 荧光染色观察肿瘤细胞的凋亡情况
2.2流式细胞术检测细胞凋亡情况经EGCG作用48 h后,各实验组肿瘤细胞凋亡率随EGCG浓度增加逐渐升高,160 μmol/L组细胞凋亡率最高,达28.6%(图2)。
2.3RT-PCR检测FASN及凋亡相关基因Bcl-2、Bax的表达结果经EGCG作用48 h后,可见各实验组凋亡相关基因Bcl-2表达量明显下降,而Bax无明显变化。FASN的mRNA表达较对照组明显下降,以160 μmol/L组表达下降最为显著(图3)。

图2 流式细胞术定量检测肿瘤细胞的凋亡率Fig.2 Tumor cell apoptosis rate detected by flow cytometryA:对照组;B:120μmol/L EGCG组;C:160μmol/L EGCG组;D:统计学分析。与对照组比较,∗P<0.05,∗∗P<0.01;与80μmol/L EGCG组比较,#P<0.05,##P<0.01。

图3 各组FASN、Bcl-2及Bax基因表达情况
3讨论
细胞凋亡在肿瘤的发生发展过程中发挥着极其重要的作用,亦是抗肿瘤研究领域备受关注的生物学过程[6]。目前,已有较多实验研究表明,EGCG对多种肿瘤细胞具有增殖抑制及凋亡诱导的作用[7-8]。SAEKI[9]对人白血病U937 和OCI-AML1a细胞研究发现,EGCG可作用于JNK和p38信号传导通路,通过活化Caspase-3、Caspase-9以及MKK3/6、MKK4、ASK1和JNK1 等诱导肿瘤细胞凋亡。本实验经160 μmol/L的EGCG作用细胞48 h后,Hoechst33258荧光染色检测结果显示可显著抑制细胞增殖并促使凋亡发生;流式细胞术检测结果显示肝癌细胞凋亡率可达28.6%,显著高于对照组。这进一步证实了EGCG对人肝癌细胞的增殖抑制及凋亡诱导作用。
Bcl-2基因是迄今研究最为深入和广泛的凋亡调节基因,其基因产物通过抵抗细胞凋亡、延长细胞寿命,从而导致细胞存活时间延长并最终参与肿瘤形成。Bcl-2可直接与线粒体结合,抑制细胞色素C的释放,从而发挥抗凋亡效能。Bax 蛋白亦属于Bcl-2家族,它在功能上与Bcl-2相反,其过度表达可促进凋亡发生。Bax与Bcl-2可在细胞膜上形成Bax/Bcl-2异二聚体,而Bax/Bax同二聚体与Bax/Bcl-2异二聚体的比例则决定了细胞是否发生凋亡,一旦Bcl-2蛋白增多、Bax减少,Bcl-2/Bax比值增高,就会抑制凋亡的发生,反之亦然[10]。本研究结果显示,EGCG作用于肝癌细胞HepG2时,Bcl-2的mRNA表达有明显下调,而Bax表达几乎没有影响,从而导致Bcl-2/Bax比值显著下降,这可能是EGCG诱导肝癌细胞凋亡的机制之一。
除凋亡抵抗外,肿瘤细胞特殊的物质和能量代谢是其另一大生物学特性。FASN是催化内源性长链脂肪酸合成的关键酶,其合成产物软脂酸既是细胞膜结构的主要组分,又是细胞能量代谢的重要底物。正常情况下,人体组织优先利用从食物中摄取的脂质,内源性脂肪酸合成处于较低水平,因此FASN在正常组织及细胞中不表达或微量表达[11]。近年来的多项研究表明,FASN水平在包括乳腺癌、前列腺癌、卵巢癌及子宫内膜癌等在内的恶性肿瘤组织中异常升高,且统计学显示其表达水平与恶性肿瘤的预后呈负相关,提示FASN与肿瘤的发生发展关系密切[12-14]。肿瘤细胞可利用FASN自身合成大量脂肪酸以取代正常情况下从食物中摄取脂肪酸的需要。肿瘤组织及细胞的此种物质代谢特性提示通过抑制FASN活性从而减少内源性软脂酸的合成可能是一条重要的抗肿瘤作用途径。本研究发现,EGCG显著抑制肝癌细胞HepG2中FASN基因的表达,而这种抑制作用的具体作用机制及其与肝癌细胞凋亡之间的确切关系尚有待进一步的探讨。
参考文献:
[1] DU X, HUANG X, HUANG C, et al. Epigallocatechin-3-gallate (EGCG) enhances the therapeutic activity of a dental adhesive[J]. J Dent, 2012, 40(6):485-492.
[2] SINHA RK, PATEL RY, BOJJIREDDY N, et al. Epigallocatechin gallate (EGCG) inhibits type II phosphatidylinositol 4-kinases: a key component in pathways of phosphoinositide turnover[J]. Arch Biochem Biophys, 2011, 516(1):45-51.
[3] TUDORAN O, SORITAU O, BALACESCU O, et al. Early transcriptional pattern of angiogenesis induced by EGCG treatment in cervical tumour cells[J]. J Cell Mol Med, 2012, 16(3):520-530.
[4] 韩知峡,杨澜,张亮,等. 表没食子儿茶素没食子酸酯对微囊藻毒素LR所致肝细胞氧化损伤及细胞色素P450 2E1表达的影[J]. 中华预防医学杂志, 2010, 44(1):24-29.
[5] 陈锡林,汪谦,曹良启,等. 没食子儿茶素没食子酸酯诱导人肝癌细胞凋亡[J]. 中华医学杂志, 2008, 88(36):2524-2528.
[6] SANDOVAL C. Case 10-2011: fever, confusion, and liver failure[J]. N Engl J Med, 2011, 365(2):186-187.
[7] FARABEGOLI F, PAPI A, BARTOLINI G, et al. (-)-Epigallocatechin-3-gallate downregulates Pg-P and BCRP in a tamoxifen resistant MCF-7 cell line[J]. Phytomedicine, 2010, 17(5): 356-362.
[8] PARK JH, YOON JH, KIM SA, et al. (-)-Epigallocatechin-3-gallate inhibits invasion and migration of salivary gland adenocarcinoma cells[J]. Oncol Rep, 2010, 23(2):585-590.
[9] SAEKI K, KOBAYASHI N, INAZAWA Y, et al. Oxidation-triggered c-Jun N-terminal kinase (JNK) and p38 mitogen-activated protein (MAP) kinase pathways for apoptosis in human leukaemic cells stimulated by epigallocatechin-3-gallate (EGCG): a distinct pathway from those of chemically induced and receptor-mediated apoptosis[J]. Biochem J, 2002, 368(Pt 3): 705-720.
[10] JIANG H, XIA D, WU LJ, et al. Inhibition of Bcl-2 enhances the efficacy of epirubicin chemotherapy in PC-3 prostate Cancer cells[J]. Chin Med J (Engl), 2011, 124(23):4018-4021.
[11] LIN VC, TSAI YC, LIN JN, et al. Activation of AMPK by pterostilbene suppresses lipogenesis and cell-cycle progression in p53 positive and negative human prostate Cancer cells[J]. J Agric Food Chem, 2012, 60(25):6399-6407.
[12] VAZQUEZ-MARTIN A, FERNANDEZ-REAL JM, OLIVERAS-FERRAROS C, et al. Fatty acid synthase activity regulates HER2 extracellular domain shedding into the circulation of HER2-positive metastatic breast Cancer patients[J]. Int J Oncol, 2009, 35(6):1369-1376.
[13] SCHMIDT LJ, BALLMAN KV, TINDALL DJ. Inhibition of fatty acid synthase activity in prostate Cancer cells by dutasteride[J]. Prostate, 2007, 67(10):1111-1120.
[14] LUPU R, MENENDEZ JA. Targeting fatty acid synthase in breast and endometrial Cancer: An alternative to selective estrogen receptor modulators?[J]. Endocrinology, 2006, 147(9): 4056-4066.

