Graves病动物模型干预模式的探讨
叶 枫,伍丽萍,侯 鹏,马晓丹,高 雷,徐 利,吴晓燕,施秉银
(1.华中科技大学同济医学院附属同济医院儿科,湖北武汉 430030;2. 西安交通大学医学院第一附属医院内分泌科,陕西西安 710061)
动物模型在疾病的发病机制、治疗等领域的研究中占有不可替代的地位。经过近半个世纪的探索,目前比较公认的毒性弥漫性甲状腺肿(Graves病)动物模型是由美国加州大学提出的,用表达促甲状腺激素受体(thyrotropin receptor, TSHR)A亚单位的重组腺病毒免疫雌性BALB/c小鼠所形成[1-2]。该模型的特点主要有甲状腺肿大、血清促甲状腺激素受体抗体(TRAb)以及总甲状腺素(TT4)水平增高、甲状腺组织病理符合甲亢表现等。虽然该模型已广泛应用于Graves病的研究,而且均采用Ad-TSHR289股四头肌注射,但造模时间及免疫次数各家报道不一[3-12]。因此,本研究的目的主要是探讨Graves病动物模型的最佳干预模式。
1材料与方法
1.1重组腺病毒的构建经连接、转化、筛选得到的重组质粒pDC316-TSHR289,与重组腺病毒骨架质粒pBHGloxdel E13cre共转染293细胞,出现噬斑后冻溶细胞3次,收集上清,经鉴定正确后接种293细胞进行大量扩增,用阴离子交换柱层析纯化,经典方法测定其腺病毒感染性滴度(TCID)值,-70 ℃保存备用。
1.2动物免疫45只BALB/c小鼠分为4组:5周-对照组(7只)、5周-造模组(16只),10周-对照组(10只)、10周-造模组(12只),分别用50 μL包含有1×109颗粒的Ad-Lacz或Ad-TSHR289的PBS经股四头肌注射,每隔3周免疫1次,5周-对照组以及5周-造模组小鼠于第2次免疫后2周处死,10周-对照组及10周-造模组小鼠于第3次免疫后4周处死。
所有小鼠均采取摘眼球取血,检测血清TRAb、TT4;剥离甲状腺,做组织学检查(实验分两次进行)。
1.3小鼠血清TRAb、TT4的测定以放射免疫法(RIA)进行测定,TRAb放射免疫试剂盒购自德国Medipan公司,TT4放射免疫分析药盒购自北京原子高科核技术应用股份有限公司。
1.4甲状腺组织病理学检查小鼠处死后,分离甲状腺,40 mL/L甲醛固定,石蜡包埋切片,HE染色,光镜下观察。
1.5统计学方法应用SPSS 13.0统计软件包,组间发病率差异采用Fisher确切概率法;相关性分析采用Spearman秩相关;一致性采用Kappa检验;以P<0.05为差异有统计学意义。
2结果
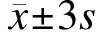
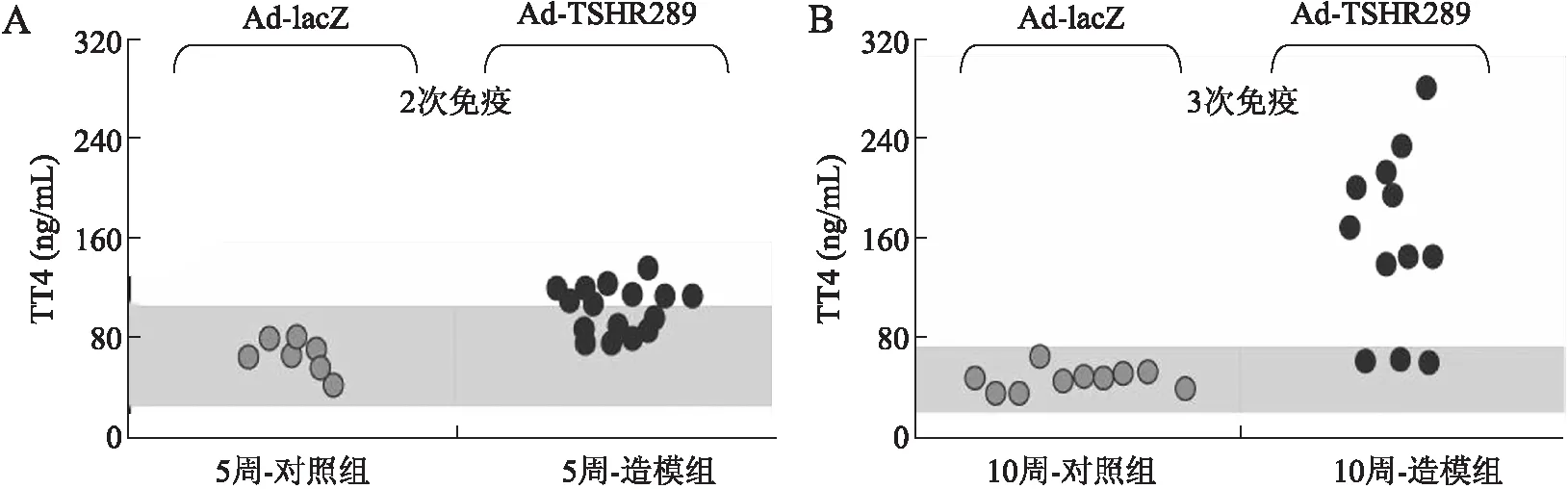
图1 5周-对照组、5周-造模组、10周-对照组、10周-造模组血清TT4水平的变化
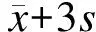
2.3甲状腺组织学检查结果对照组所有小鼠光镜下甲状腺滤泡大小较均一,细胞排列比较疏松,上皮细胞呈低立方状或扁平状,滤泡中胶质含量丰富;造模组部分小鼠肉眼下甲状腺组织明显增大,光镜下,表现为甲状腺滤泡上皮细胞增生肥大,呈立方状或高柱状,滤泡腔中胶质含量减少或缺失,部分小鼠有乳头状增生;所有小鼠甲状腺组织均未见淋巴细胞侵润;10周-造模组相对于5周-造模组甲状腺组织学改变更明显(图3)。
进一步探讨所有通过TT4判定为甲亢的小鼠是否均有甲状腺组织学改变。在10周-造模组中(图4B),所有甲亢小鼠均有甲状腺组织学改变,而甲功正常的小鼠均未见明显的甲状腺组织学改变;在5周-造模组(图4A),5只甲亢小鼠及4只甲功正常的小鼠可见甲状腺组织学改变;10周-造模组甲状腺组织学改变与TT4吻合度为100%,相对于5周-造模组的50%(8/16)明显升高。分析血清TT4水平与甲状腺组织学改变的相关性,结果表明,10周-造模组甲状腺组织学改变与血清TT4水平成明显正相关(r=0.753,P=0.005),而5周-造模组无明显相关性(r=-0.014,P=0.960)。
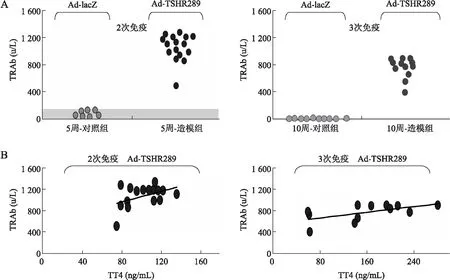
图2 血清TRAb水平(A)及5周-造模组和10周-造模组小鼠血清TT4与TRAb相关性分析(B)
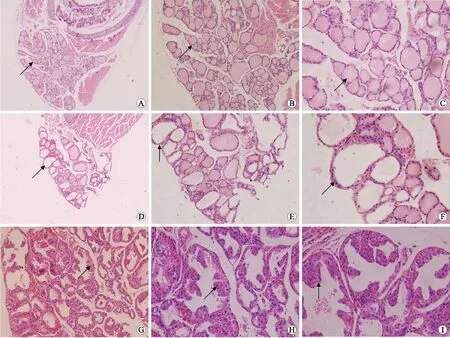
图3 正常组(A~C)、5周-甲亢组(D~F)和10周-甲亢组(G~I)小鼠甲状腺组织的光镜检查
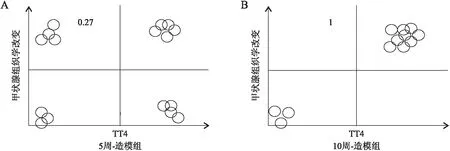
图4 5周-造模组、10周-造模组小鼠甲状腺功能及组织学改变吻合度分析
3讨论
自20世纪90年代以来,人们尝试各种方式制造Graves病动物模型,包括体内注射hTSHR cDNA、重组腺病毒表达的TSHR或应用甲状腺刺激性抗体(TSAb)转基因动物模型等。经过20年探索,目前使用最广泛的是Ad-TSHR289诱导的Graves病模型。但不同国家的研究者采取的终点时间并不一致,从2次免疫后2周到3次免疫后8周不等[3-12],大多集中在2次免疫后2周[6-9]以及3次免疫后4周[2,10-12]。本研究在我们既往实验基础上,主要探讨时间和免疫次数对该模型的影响,确定最佳造模方案,为进一步利用该模型进行相关研究奠定基础。
我们既往用Ad-TSHR289免疫雌性近交系BALB/c小鼠,于3次免疫后8周(14周造模)处死小鼠[13],结果仅有30%(3/10)的小鼠发生甲亢,而10周-造模组甲亢发病率为75%,与报道的65%~80%一致,这两次实验除造模时间不一致外,其余条件基本相同(包括小鼠品种、性别、年龄、注射部位、病毒剂量以及免疫次数等)。因此,认为造模时间对GD模型的发病率有影响。CHEN等[3]早期建模时也发现了10周-造模组发病率高于14周,并提到TT4水平在第3次免疫后有可能不增反减。我们认为出现这种结果可能与腺病毒表达时间短暂[14-15]而TT4的半衰期又较短有关。虽然腺病毒对分裂细胞和非分裂细胞均具有感染能力,但它在体内的表达时间相对较短,而且不能复制,也不能随着有丝分裂而分裂,最重要的是,它很容易诱发体内针对载体及转基因产物的免疫反应,使其不断被稀释,感染滴度也逐渐下降[14-15]。因此,在第3次免疫后随着腺病毒感染力度的下降,血清TT4水平也逐渐下降,而TT4在体内的半衰期又相对较短,腺病毒的作用一旦下降,TT4也会跟着迅速下降,所以就有可能出现TT4水平随着时间的延长不增反减的现象,导致14周-造模组发病率小于10周。
本实验5周-造模组发病率为56%,较报道的60%~61%略低。10周-造模组发病率高于5周可能意味着3次免疫比2次免疫更容易诱发甲亢。因为3次病毒注射的免疫原性较2次肯定更强,当然也不排除腺病毒在体内注射后4周达到作用高峰的可能性,如果能加一组8周-造模组(免疫3次后2周处死小鼠)也许可以更好地说明免疫次数对该模型的影响。SAITOHS[4]研究即采取3次免疫后2周处死小鼠,模型的发病率为70%,在一定程度上支持了我们的假设。而CHEN等[3]通过比较10周-造模组和4周-造模组(2次免疫后1周)发现TT4水平在第3次免疫后有可能不增反减。故推测可能免疫次数以及造模时间均对Graves病发病率有重要影响,如果增加免疫次数的作用大于延长造模时间的作用,那么发病率就会增加(10周-造模组>5周-造模组),反之,则降低(5周-造模组>14周-造模组)。
本研究还发现,TRAb在所有的5周-或10周-造模组小鼠中均明显升高,而且血清TRAb与TT4无明显相关性。这与CHEN等[2]的研究结果一致,认为TRAb对预示甲亢活动以及甲亢严重程度的意义有限。
此外,还发现10周-造模组小鼠血清TT4水平与甲状腺组织学改变成正相关,而且所有TT4升高达到甲亢判断标准的小鼠均有甲状腺组织学改变,而没有达到判断标准的无明显组织学改变,其判断甲亢的一致性为100%,较5周-造模组明显升高(50%),而且10周-造模组甲亢小鼠的甲状腺组织学改变较5周-造模组更明显。分析可能由于组织学改变无论是从正常到异常还是异常到正常均较血清学改变需要更多的时间[2],而10周-造模组免疫原性增强、造模时间延长,更能满足组织学改变的需要,这与CHEN等[2]的甲状腺组织学改变是一种“延迟现象”的理论不谋而合。这也可以解释为什么14周-造模组有1只甲功正常的小鼠甲状腺组织学有改变。但是,5周-造模组有4只甲功正常的小鼠有组织学改变,这虽然可进一步阐明5周-造模组小鼠血清TT4水平与甲状腺组织学改变缺少相关性,但是却无法利用上面的理论解释该现象,除了考虑生长刺激性免疫球蛋白可能会引起甲状腺肿[16]以及5周-造模组小鼠血清TT4稳定性差等因素外,可能还有某些我们尚未研究的因素在起作用,需要进一步探讨。
总之,本研究发现10周-造模组相对于5周-造模组具有发病率高、组织学改变与血清TT4水平吻合度高以及组织学改变更明显等优势,更适用于实验研究,另外造模时间以及免疫次数均对该模型有着较大的影响。
参考文献:
[1] 王悦,伍丽萍. Graves病动物模型研究进展[J]. 医学综述,2012, 18(10):1455-1458.
[2] CHEN CR, PICHURIN P, NAGAYAMA Y, et al. The thyrotropin receptor autoantigen in Graves disease is the culprit as well as the victim [J]. J Clin Invest, 2003, 111(12):1897-1904.
[3] CHEN CR, ALIESKY HA, GUO J, et al. Blockade of costimulation between T cells and antigen-presenting cells: an approach to suppress murine Graves' disease induced using thyrotropin receptor-expressing adenovirus [J]. Thyroid, 2006, 16(5):427-434.
[4] SAITOH O, NAGAYAMA Y. Regulation of graves’ hyperthyroidism with naturally occurring CD4+CD25+regulatory T cells in a mouse model[J]. Endocrinology, 2006, 147(5):2417-2422.
[5] UEKI I, ABIRU N, KOBAYASHI M, et al. B cell-targeted therapy with anti-CD20 monoclonal antibody in a mouse model of Graves’ hyperthyroidism[J]. Clin Exp Immunol, 2011, 163(3):309-317.
[6] NAGAYAMA Y, SAITOH O, MCLACHLAN SM, et al. TSH receptor-adenovirus-induced Graves’ hyperthyroidism is attenuated in both interferon-gamma and interleukin-4 knockout mice; implications for the Th1/Th2 paradigm[J]. Clin Exp Immunol, 2004, 138(3):417-422.
[7] SAITOH O, MIZUTORI Y, TAKAMURA N, et al. Adenovirus-mediated gene delivery of interleukin-10, but not transforming growth factor beta,ameliorates the induction of Graves’ hyperthyroidism in BALB/c mice[J]. Clin Exp Immunol, 2005, 141(3):405-411.
[8] YE F, HOU P, WU X, et al. The significance of immune-related molecule expression profiles in an animal model of Graves’ disease[J]. Autoimmunity, 2012, 45(2):143-152.
[9] UEKI I, ABIRU N, KAWAGOE K, et al. Interleukin 10 deficiency attenuates induction of anti-TSH receptor antibodies and hyperthyroidism in a mouse Graves’ model[J]. J Endocrinol, 2011, 209(3):353-357.
[10] WU L, XUN L, YANG J, et al. Induction of murine neonatal tolerance against Graves’ disease using recombinant adenovirus expressing the TSH receptor A-subunit[J]. Endocrinology, 2011, 152(3):1165-1171.
[11] YE F, SHI B, WU X, et al. Experience with lentivirus-mediated CD40 gene silencing in a mouse model of Graves’ disease[J]. J Endocrinol, 2011, 208(3):285-291.
[12] MCLACHLAN SM, ALIESKY HA, CHEN CR, et al. Exceptional hyperthyroidism and a role for both major histocompatibility class Ⅰ and class Ⅱ genes in a murine model of Graves’ disease[J]. PLoS One, 2011, 6(6):e21378.
[13] 伍丽萍,施秉银,旬利茹,等.Graves病动物模型诱导方法及持续时间的探讨[J]. 中华内科杂志,2012,51(10):793-797.
[14] ZAISS AK, MACHADO HB, HERSCHMAN HR. The influence of innate and pre-existing immunity on adenovirus therapy[J]. J Cell Biochem, 2009, 108(4):778-790.
[15] ATKINSON H, CHALMERS R. Delivering the goods: viral and non-viral gene therapy systems and the inherent limits on cargo DNA and internal sequences[J]. Genetica, 2010, 138(5):485-498.
[16] RAO PV, WATSON PF, WEETMAN AP, et al. Contrasting activities of thyrotropin receptor antibodies in experimental models of Graves’ disease induced by injection of transfected fibroblasts or deoxyribonucleic acid vaccination[J]. Endocrinology, 2003, 144(1):260-266.

