非血缘异基因造血干细胞移植后出血性膀胱炎病例分析
吴 迪,张 梅,贺鹏程,习杰英,李 静
(西安交通大学医学院第一附属医院血液科,陕西西安 710061)
造血干细胞移植(hematopoietic stem cell transplantation, HSCT)技术是根治血液恶性肿瘤的重要手段之一。出血性膀胱炎(HC)仍是HSCT后常见的并发症,在无预防措施情况下发生率高达40%~68%,给予适当的抗病毒预防后其发生率下降至0%~25%[1]。本研究对2009年至2012年在西安交通大学医学院第一附属医院血液科行非血缘异基因造血干细胞移植患者中发生迟发型出血性膀胱炎的病例进行总结。
1资料与方法
1.1一般资料2009年至2012年在西安交通大学医学院第一附属医院血液科行非血缘异基因造血干细胞移植患者8例,其中男性6例,女性2例,年龄21~32岁,病种包括急性淋巴细胞白血病5例,急性非淋巴细胞白血病3例,均进行了非血缘异基因外周血造血干细胞移植。7例HLA配型全相合,1例HLA配型2个位点不合。
1.2方法
1.2.1预处理方案均采用改良的BU/CY方案 静脉用白消安(BU)0.8 mg/kg q6 h静脉滴注,移植前连用4 d,环磷酰胺(CTX)60 mg/(kg·d)移植前静脉滴注2 d,阿糖胞苷(Ara-c)2~4 g/(m2·d)移植前静脉滴注1 d,依托泊苷(VP-16)200 mg/(m2·d)移植前静脉滴注1 d,司莫司丁(CCNU)250mg/m2移植前静脉滴注1 d。
1.2.2移植物抗宿主病的预防 经典的环孢素(CsA)、短程的甲氨蝶呤(MTX)及麦考酚吗乙酯(MMF)方案。有2例患者在标准方案的基础上加用兔抗胸腺细胞球蛋白(ATG)3 mg/(kg·d),共用3 d。
1.2.3出血性膀胱炎的预防 ①美司钠:每次用量为环磷酰胺当日量的20%,4次/d(与环磷酰胺同时应用1次,第3、6、9 h 各1次)。②水化:每日补液量约3 000 mL/m2,24 h匀速输入,并鼓励患者多饮水。密切观察尿量、颜色、pH值,准确记录24 h出入液体量,保持水、电解质平衡。③强迫利尿:间断应用呋塞米, 具体用量依患者尿量决定。④碱化尿液:5%碳酸氢钠125 mL q8 h~q6 h静滴,并依尿pH值调整用量。⑤前列腺素E:200 μg/d,-7~+30 d静脉滴注预防。
1.2.4出血性膀胱炎的诊断标准及分度 患者出现镜下或肉眼血尿,伴程度轻重不等的尿频、尿急、尿痛等尿路刺激征,排除细菌、真菌感染,即可诊断。根据血尿严重程度,将其分为4级:Ⅰ级指镜下血尿,Ⅱ级指肉眼血尿,Ⅲ级指肉眼血尿伴血凝块,Ⅳ级指肉眼血尿伴有血凝块和泌尿系统梗阻。Ⅰ、Ⅱ级为轻度,Ⅲ、Ⅳ级为重度。预处理结束的3 d内发生HC为早发型,预处理结束的3 d后发生HC为迟发型。[2]
1.2.5出血性膀胱炎的处理 立即给予大剂量补液水化,50 g/L的碳酸氢钠碱化尿液及呋塞米强迫利尿治疗,酌情加用美司钠。行尿细菌、尿真菌培养,监测血及尿巨细胞病毒(CMV)、EB病毒DNA定量,并抽取外周血检测巨细胞病毒抗体和巨细胞病毒PP65抗原,必要时行血、尿BK病毒监测。症状无改善且病毒阳性者用更昔洛韦、人免疫球蛋白抗病毒治疗,调整环孢素剂量维持环孢素质量浓度150~200 ng/mL,甲泼尼龙80~120 mg/d静脉滴注。持续血尿不缓解,堵塞尿道,给予膀胱冲洗和药物灌洗,同时止血、解痉止痛、输注红细胞、血小板等支持对症处理。
2结果
2.1HC的发病情况8例患者HC类型均为迟发型,其中轻度3例,重度5例,发生时间为+23 d~+57 d(表1)。
2.2临床转归7例HLA配型全相合患者,3例合并CMV感染,1例同时合并CMV、EB、BK病毒感染,且aGVHD Ⅱ级,经水化、碱化尿液、强迫利尿,更昔洛韦抗病毒,甲泼尼龙治疗,HC持续病程为20~45 d,症状消失,尿常规正常。
1例患者HLA配型2个位点不合,+23 d出现血尿,检测EB、CMV病毒定量阳性,BK病毒阴性,经更昔洛韦抗病毒治疗,血CMV病毒转阴,血尿EB病毒定量仍阳性,应用利妥昔单抗600 mg/周,连用4周抗EB病毒治疗,血、尿EB病毒定量转阴,但症状无减轻,排尿不畅,使用甲泼尼龙40 mg/d静滴治疗,血尿无好转。行持续膀胱冲洗和透明质酸等药物膀胱内灌注,目前为镜下血尿,血尿持续160 d。
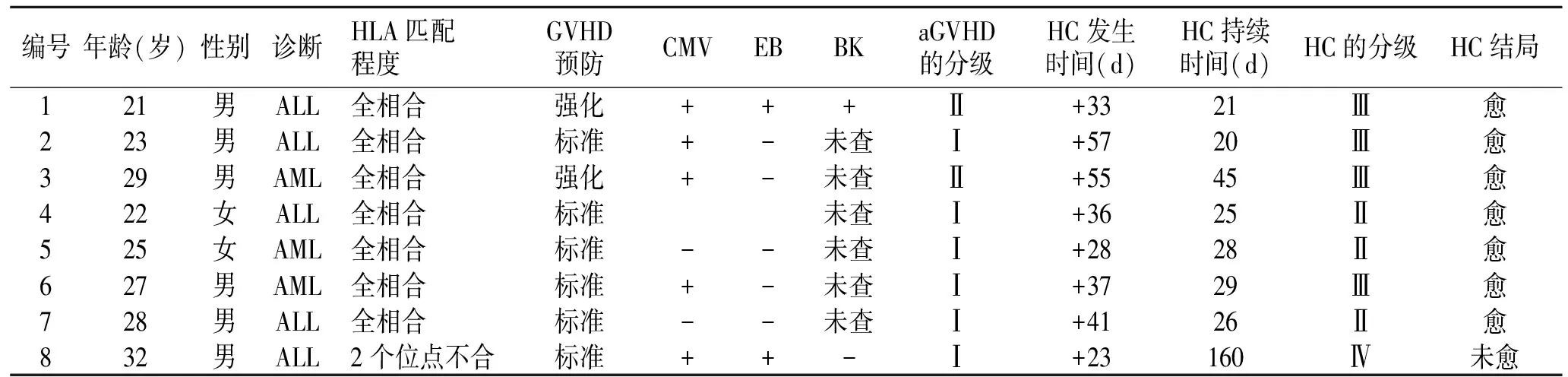
表1 8例HC患者的病例资料
标准方案为环孢素(CsA)、短程的甲氨蝶呤(MTX)及麦考酚吗乙酯(MMF)方案;强化方案为CsA+MTX+MMF+抗胸腺细胞球蛋白(ATG)。
3讨论
出血性膀胱炎是造血干细胞移植主要并发症之一。早期HC 的发生多与预处理化疗药物毒性有关,如环磷酰胺、白消安等。采用水化、碱化和美司钠等预防措施后,发病率已得到明显控制。迟发型HC的发生与多种复合因素相关,非血缘和HLA不相合是迟发型HC发病的独立危险因素。目前认为,GVHD可以破坏实质器官的内皮细胞,从而引起多个器官的损伤,而膀胱是GVHD的一个重要靶器官,受者膀胱尿路上皮细胞,尤其是表达病毒抗原的细胞更易遭到供者淋巴细胞的攻击。因此,GVHD可以直接导致HC的发生[3]。同时,为预防GVHD应用免疫抑制剂,使免疫重建延缓,从而引起腺病毒、多瘤病毒、巨细胞病毒等的感染或激活,HC发生率明显增加。故迟发型HC的发生与移植物抗宿主病及病毒感染(包括BK多瘤病毒、腺病毒、疱疹病毒或巨细胞病毒等)密切相关[4-6],其中多瘤病毒引起的骨髓移植后HC为5.7%~7.7%[7-11]。本组8例非血缘异基因造血干细胞移植发生迟发型HC的病例中,5例合并CMV感染,2例合并EB病毒感染,1例合并BK病毒感染,2例同时合并Ⅱ级aGVHD,进一步证实GVHD及病毒感染与HC的密切联系。
出血性膀胱炎的治疗应采取综合手段。轻、中度出血性膀胱炎通过常规水化、碱化等治疗后可好转;重度出血性膀胱炎在抗病毒基础上可应用小剂量激素。北京大学人民医院对250例造血干细胞移植患者发生HC的情况进行了回顾分析,结果提示免疫抑制剂的使用和免疫损伤均可能参与HC的发病[12]。小剂量激素也使一部分患者迅速达到了临床缓解,因而对临床抗病毒治疗效果不好的患者,应考虑有免疫因素的存在,抗病毒结合小剂量免疫抑制剂可达到缓解症状和缩短病程的作用。本组资料选用病例均为非血缘异基因造血干细胞移植,预处理及GVHD预防方案基本一致,8例患者发生HC时,均给予大剂量水化、碱化尿液,利尿及止血,使用抗病毒药物,其中7例患者发生HC一周内给予甲泼尼龙40~120 mg/d治疗;1例患者侧重于抗EB、CMV病毒治疗,待病毒转阴后方才加用甲泼尼龙,血尿仍无改善。因严重的血凝块出现排尿不畅给予导尿、膀胱冲洗,透明质酸药物灌注,目前病情有所控制。因此,我们认为常规治疗及抗病毒治疗效果不佳时,应尽早加用激素控制HC,膀胱冲洗和药物灌注也是有效的治疗手段。
综上所述,根据出血性膀胱炎的发病机制,及时采取正确的处理方案,对于提高患者的生存质量、降低移植相关死亡率均有积极的意义。尽管本组病例数较少,随访时间较短,但仍为出血性膀胱炎的治疗积累了一定的临床经验。
参考文献:
[1] HASSAN Z. Management of refractory hemorrhagic cystitis following hematopoietic stem cell transplantation in children[J]. Pediatr Transpl, 2011, 15(4):348-361.
[2] LEE GW, LEE JH, CHOI SJ, et al.Hemorrhagic cystitis following allogeneic hematopoietic cell transplantation[J]. Korean Med Sci, 2003, 18(2):191-195.
[3] RUSSELL SJ, VOWELS MR, VALE T. Haemorrhagic cystitis in paediatric bone marrow transplant patients: an association with infective agents, GVHD and prior cyclophosphamide[J]. Bone Marrow Transpl, 1994, 13:533-539.
[4] MANIKANDAN R, KUMAR S, DORAIRAJAN LN. Hemorrhagic cystitis: A challenge to the urologist[J]. Indian J Urol, 2010, 26(2):159-166.
[5] 马春会,朱康儿,张涛,等. 异基因造血干细胞移植后严重的出血性膀胱炎多因素分析[J]. 中华器官移植杂志, 2006, 27(6):337-340.
[6] EL-ZIMAITY M, SALIBA R, CHAN K, et al. Hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation: donor type matters[J]. Blood, 2004, 103:4674-4680.
[7] MORI Y, MIYAMOTO T, KATO K, et al. Different risk factors related to adenovirus-or BK virus-associated hemorrhagic cystitis following allogeneic stem cell transplantation[J]. Biol Blood Marrow Transpl, 2012, 18(3):458-465.
[8] DECKER DB, KARAM JA, WILCOX DT. Pediatric hemorrhagic cystitis[J]. J Pediatr Uro, 2009, 5(4):254-264.
[9] DALIANIS T, LJUNQMAN P. Full myeloablative conditioning and an unrelated HLA mismatched donor increase the risk for BK virus-positive hemorrhagic cystitis in allogeneic hematopoetic stemceU transplanted patients[J]. Anticoncer Res, 2011, 31(3):939-944.
[10] HAINES HL, LASKIN BL, GOEBEL J, et al. Blood, and not urine, BK viral load predicts renal outcome in children with hemorrhagic cystitis following hematopoietic stem cell transplantation[J]. Biol Blood Marrow Transpl, 2011, 17(10):1512-1519.
[11] GAZIEV J, PABA P, MIANO R, et al. Late-onset hemorrhagic cystitis in children after hematopoietic stem cell transplantation for thalassemia and sickle cell anemia: A prospective evaluation of polyoma (BK) virus infection and treatment with cidofovir[J]. Biol Blood Marrow Transpl, 2010, 16(5):662-671.
[12] 张红宇,黄晓军,许兰平,等. 异基因造血干细胞移植后出血性膀胱炎发生率及其危险因素分析[J]. 中华血液学杂志, 2007, 28(4):243-246.

