低分子肝素、N-乙酰半胱氨酸干预对COPD大鼠气道重塑的影响
卫小红,王军辉,Asmitanand Thakur,马爱群,张增铁
(1. 西安交通大学医学院第一附属医院呼吸内科,陕西西安 710061;2. 河北医科大学附属邢台市人民医院内科急诊科,河北邢台 054031;3.西安交通大学医学院第一附属医院心血管内科,陕西西安 7100614. 西安交通大学医学院地方病研究所,陕西西安 710061)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)反复急性发作导致的气道重塑使病情不断进展,最终引起呼吸衰竭和肺源性心脏病[1]。低分子肝素(low molecular weight heparin, LMWH)及N-乙酰半胱氨酸(N-acetylcysteine, NAC)干预对COPD气道重塑的影响引起了人们的关注。本研究通过对COPD动物模型支气管形态学和胶原纤维沉积的观察,探讨LWMH、NAC干预下COPD的气道重塑情况。
1材料与方法
1.1标本来源实验用普通级SD大鼠40只,雌雄各半,鼠龄6~8周,平均体质量(219±32)g。由西安交通大学医学院实验动物中心提供。
1.2主要试剂及仪器富露施(NAC)购自海南赞邦制药有限公司;脂多糖(LPS)购自美国SIGMA公司;自制大鼠气管插管、吸烟三通管及大鼠熏烟箱(53 cm×38 cm×31 cm);高速低温离心机购自Centifuge 5180R Eppendorf;旋涡振荡仪购自上海优浦科学仪器有限公司;大鼠灌胃器由西安交通大学医学院实验动物中心提供;Leica QWin图像信号采集与分析系统购自德国LEICA公司。
1.3方法
1.3.1COPD动物的分组、模型制备及药物干预 按照每组8只随机分5组,包括健康对照组(C组)(室内正常喂养,不予任何干预)、COPD模型组(M组)、低分子肝素干预组(L组)(对模型鼠行LMWH干预)、NAC干预组(N组)(对模型鼠行NAC干预)、低分子肝素联合NAC干预组(LN组)(对模型鼠行LMWH和NAC干预)。
①COPD模型鼠的制备。第1、8、15、21天向大鼠气管内灌注LPS。先向腹腔内注射100 g/L水合氯醛0.3 mL/100g,钳夹四肢无反应后固定,牵舌,气管插管插入后使另一端入液面下,见液平随呼吸上下运动视为插管成功,随后气管内快速灌注LPS 200 μL(1 μg/μL)后将操作台竖起、旋转数周。第2~7、9~14、16~20、22~28天将大鼠置入熏烟箱中熏4支香烟,每日1次,每次30 min。
②药物干预实验大鼠。L组:烟熏前半小时LMWH(100 U/mL)皮下注射(200 U/kg)。N组:烟熏前半小时NAC(10 mg/mL)灌胃(50 mg/只)。LN组:同时上两种方法处置。
1.3.2动物处死、标本采集及处理 ①动物处死:第28天同前方法麻醉并固定大鼠,腹部去毛及皮肤消毒后打开腹腔,以一次性10 mL注射器进行腹主动脉采血至大鼠失血而死亡。②肺组织标本采集及处理:结扎右肺中叶以外其它肺叶。以12 cm H2O压力向右肺中叶灌注中性甲醛溶液,余右肺叶分别装入冻存管,液氮处理后,-70 ℃冰箱冻存。右肺中叶经甲醛溶液固定48 h后,沿右肺中叶支气管走行垂直方向肺叶最宽处切取厚度8 mm的肺组织备用。蒸馏水浸泡2 h,700 mL乙醇保存。常规梯度乙醇脱水,浸蜡,包埋。③切片制备及染色:中性甲醛液固定标本,切片厚度5 μm,常规脱腊至水。苏木精-伊红(HE)染色、天狼猩红染色。脱水、透明、中性树胶封片。
1.3.3主要观察指标和方法 ①大鼠的一般情况:外观、活动能力、体质量的改变。②肺组织标本:肉眼及光镜下病理学改变,以图像分析系统采集图像。③支气管形态学改变:每张切片中随机选取3个内周长<1 000 μm、长径/短径≤2且较规整的小支气管横截面,依据图像分析系统测量气道外壁所围面积(outer adventitial area, Ao)和管腔内侧的面积(inner adventitial area, Ai)及内周长(inner perimeter, Pi)。管壁总面积(WAt)=Ao-Ai。以管壁内周长(Pi)进行标准化,以单位长度的管壁面积(WAt/Pi,μm2/μm)表示管壁厚度。④气道胶原沉积:在偏振光显微镜下观察天狼猩红染色后气道黏膜下胶原沉积。Ⅰ型胶原纤维排列紧密、粗大,呈强双折光黄色或橘红色(纤维直径越粗红色越明亮);Ⅲ型胶原纤维排列疏松、纤细,呈弱双折光亮绿色。在偏振光显微镜下底片成像(×100)。

2结果
2.1大鼠的一般情况及肺组织大体标本所见各实验组大鼠进入实验时体质量最高224 g,最低217 g,之间无统计学差异(P>0.05)。C组大鼠体质量增长最为迅速,余4组大鼠体质量增长缓慢,以M组体质量增长最为缓慢,但组间外观差异不明显(图1)。

图1 各组实验动物平均体质量的变化趋势
C组大鼠毛发白净润泽、光泽度高,活动能力强,饮食量正常;余4组大鼠毛发枯黄干涩,神情倦怠,活动减少,饮食量亦减少。实验中N组1只雄性大鼠第3天因NAC灌胃时误入气管致死;M组1只雄性大鼠在第23天熏烟时卡在分隔铁丝网与箱壁之间窒息死亡;LN组第26天1只雌性大鼠因灌胃时损伤咽部致不能饮水及进食后死亡。其余实验大鼠均饲养至实验终点。C组大鼠两肺表面光滑,呈淡粉色,打开胸腔后很快萎缩;M组两肺体积明显增大,颜色苍白,开胸后肺脏萎陷不明显;L组、N组和LN组大鼠肺组织呈轻度膨胀状态,颜色苍白,开胸后肺脏萎陷逊于C组。
2.2大鼠肺组织HE染色所见C组支气管黏膜上皮细胞完整,纤毛排列整齐,未见腺体增生及明显炎症细胞浸润,肺泡腔未见病理性扩大。M组支气管黏膜上皮部分脱落,皱襞增多变长,突入管腔。管壁大量炎性细胞浸润,主要为单核细胞、淋巴细胞和浆细胞;肺泡结构紊乱,壁变薄或断裂,部分呈囊状扩张,肺泡腔扩大,部分融合,支气管壁及肺血管壁增厚。L组、N组及LN组支气管少量上皮脱落,支气管黏膜皱襞及管壁炎性细胞浸润较前减轻;肺泡轻度膨大,肺泡壁变薄,部分形成大泡(图2)。
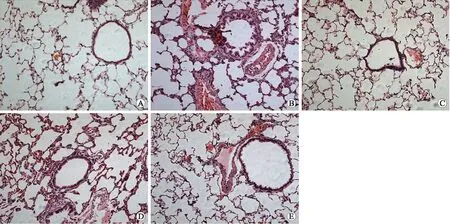
图2 各组大鼠肺组织标本的HE染色Fig.2 HE specimens of rat lung tissue under the microscope in each group (×200)A:健康对照组;B:COPD模型组;C:LM-WH干预组;D:NAC干预组;E:NAC联合LMWH干预组。
2.3大鼠支气管的形态学改变各实验组管壁厚度均大于C组(P<0.01)。L组、LN组管壁厚度小于M组(P<0.01),其中以LN组减少最为明显,N组亦有管壁厚度减少但差异无统计学意义(P>0.05)。
各实验组管壁内周长之间的比较差异无统计学意义(P>0.05,表1)。
2.4支气管黏膜下胶原纤维的沉积于偏振光显微镜下可见呈粗大黄色或橘红色的Ⅰ型胶原沉积。L组和N组与M组比较,气道胶原沉积减少,而LN组更趋减少(图3)。
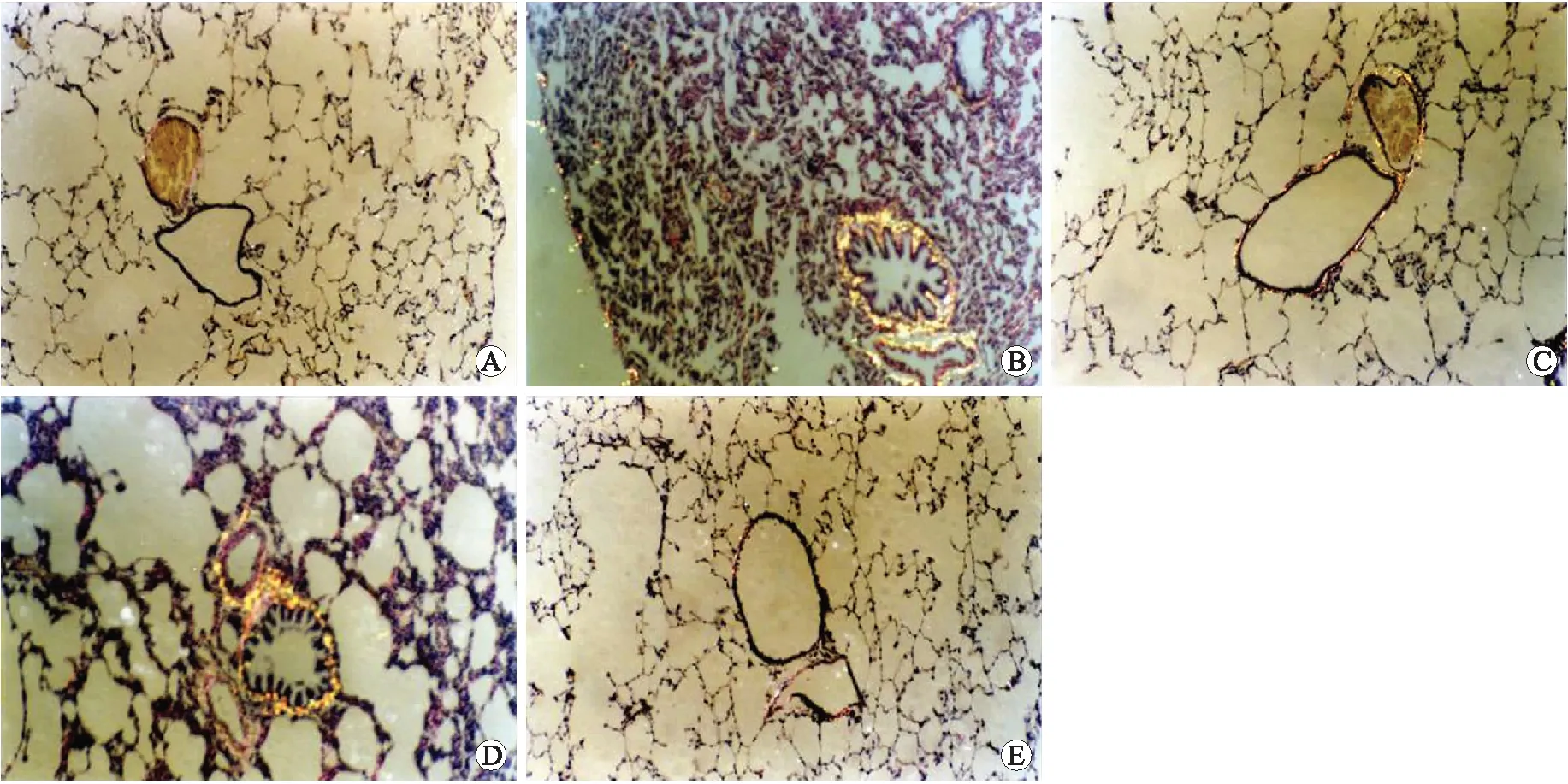
图3 各组偏振光显微镜下支气管壁胶原纤维的沉积情况Fig.3 Collagen deposition under the polarization microscope in each group (×100)A:健康对照组;B:COPD模型组;C:LM-WH干预组;D:NAC干预组;E:NAC联合LMWH干预组。
表1 各组大鼠支气管形态学测量结果的比较
与C组比较,*P<0.01;与M组比较,▲P<0.01;与L组比较,■P<0.01;与N组比较,△P<0.01。
3讨论
气道重塑是COPD病情不断进展最终引起呼吸衰竭和肺源性心脏病的主要原因。鼠与人类基因极为相似,实验操作易于操控,以熏香烟[2]及LPS灌注[3]模拟人类COPD发病的环境因素使其成为COPD动物模型的最佳选择。本实验各组大鼠排除了性别及体重对实验结果的影响,采用时间和剂量不同于他人的气管内注入LPS和熏香烟的方法,在较短的时间内成功地制备了一般情况及病理改变符合COPD的大鼠模型。
支气管肺组织的炎症、损伤、修复、重塑是COPD不断进展的病理基础,以胶原为主的细胞外基质过度沉积和小气道平滑肌层增厚作为气道重塑的主要表现,其结果导致肺功能持续和进行性损害[4]。COPD气道重塑的机制尚未阐明,一般认为与炎症[5]、氧化应激[6]、蛋白酶-抗蛋白酶失衡及细胞凋亡[7]等导致的损伤和修复有关。目前,认为对气道组织学直接评估是评估COPD气道重塑较准确的方法[8]。本研究通过HE染色观察COPD大鼠气道壁病理学改变,以图像采集分析系统检测气道壁厚度以及天狼猩红染色观察气道壁总胶原量,发现了M组大鼠气道壁炎性细胞浸润、管壁厚度和胶原沉积都超过了对照组。
LMWH除具有抗凝血、抗血栓作用外,还具有抗炎、抗脏器纤维化及抗平滑肌增生等作用,其中抑制平滑肌细胞增殖的作用是因为其抑制了人类及大鼠支气管平滑肌细胞DNA的合成,竞争性结合生长因子受体或直接与生长因子结合而抑制生长因子的调控作用而致[9-11]。NAC通过抑制NF-κB、TNF-β的激活,从而阻断炎性因子的释放而起到抗炎的作用[12],并通过参与转化生长因子( TGF-β)信号传导的负面调节,降低MMP对支气管组织ECM的降解和破坏作用,从而减轻气道壁细胞外基质重塑和预防吸烟导致的大鼠小气道管壁的增厚和通气弥散的降低[13]。本研究发现,各实验组大鼠的气道管壁厚度均大于C组,而各药物干预组大鼠管壁厚度均小于M组;同时也发现,药物干预后的各组大鼠气道胶原沉积均少于模型鼠,其中以联合用药组的减少更为显著。提示LMWH和NAC的干预可以减轻COPD气道重塑且以LMWH联合NAC更为明显,LMWH和NAC在作用机制上的差异可能使其联合应用更有意义。
综上所述,以熏香烟和脂多糖法可在较短的时间制备出满意的COPD大鼠模型。 LMWH、NAC干预尤其是联合应用可通过不同作用机制减轻COPD发病过程中气道壁厚度及气道胶原沉积,进而减轻COPD气道重塑。
参考文献:
[1] VESTBO J, HURD SS, AGUSTI AG, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary[J]. Am J Respir Crit Care Med, 2013, 187(4):347-365.
[2] MIZUTANI N, FUCHIKAMI J, TAKAHASHI M, et al. Pulmonary emphysema induced by cigarette smoke solution and lipopoly saccharide in guinea pigs [J]. Biol Pharm Bull, 2009, 32(9):1559-1564.
[3] BRASS DM, HOLLINGSWORTH JW, CINQUE M, et al. Chronic LPS inhalation causes emphysema-like changes in mouse lung that are associated with apoptosis[J]. Am J Resp Cell Mol Biol, 2008, 39(5):584-590.
[4] TAM A, SIN DD. Pathobiologic mechanisms of chronic obstructive pulmonary disease [J]. Med Clin North Am, 2012, 96(4):681-698.
[5] LAPPERRE TS, WILLEMS LN, TIMENS W, et al. Small airways dysfunction and neutrophilic inflammation in bronchial biopsies and BAL in COPD[J]. Chest, 2007, 131(1):53-59.
[6] FOSCHINO BARBARO MP, CARPAGNANO GE, SPANEVELLO A, et al.Inflammation, oxidative stress and systemic effects in mild chronic obstructive pulmonary disease[J]. Int J Immunopathol Pharmacol, 2007, 20(4):753-763.
[7] BRAJER B, BATURA-GABRYIL H, NOWIEKA A, et al. Concentration of matrix etalloproteinase-9 in serum of patients with chronic obstructive pulmonary disease and degree of airway obstruction and disease progression[J]. Physiol Pharmacol, 2008, 59(6):145-152.
[8] 莫碧文,张贞贞,韦江红,等. 脂多糖对哮喘大鼠气道炎症、气道重塑及TLR4表达的影响[J]. 中国应用生理学杂志, 2013, 29(2):153-157.
[9] WAN MX, ZHANG XW, TRKVIST L, et al. Low molecular weight heparin inhibits tumor necrosis factor alpha-induced leukocyte rolling[J]. Inflamm Res, 2001, 50(12):581-584.
[10] KUBO H, NAKAYAMA K, YANAI M, et al. Anticoagulant therapy for idiopathic pulmonary fibrosis[J]. Chest, 2005, 128(3):1475-1482.
[11] CAO G, WU JX, WU QH. Low molecular weight heparin suppresses lymphatic endothelial cell proliferation induced by vascular endothelial growth factor Cinvitro[J]. Chin Med J (Engl), 2009, 122(13):1570-1574.
[12] WANG HW, YANG W, LU JY, et al. N-acetylcysteine administration is associated with reduced activation of NF-κB and preserves lung dendritic cells function in a zymosaninduced generalized inflammation model[J]. J Clin Immunol, 2013, 33(3):649-660.
[13] LI HM, CUI DI, TONG X, et al. The effect of N-acetylcysteine and other agents on the role of matrix metalloproteinases in airway remodeling of COPD rat models[J]. Med J Chin PLA, 2002, 27(7):593-596.

