治疗前血小板和淋巴细胞比值与宫颈癌新辅助化疗疗效及预后的相关性
周文毓 陈金婵 惠 宁
治疗前血小板和淋巴细胞比值与宫颈癌新辅助化疗疗效及预后的相关性
周文毓①②陈金婵③惠 宁①
目的:评价治疗前外周血血小板和淋巴细胞比值(PLR)与ⅠB2~ⅡB期宫颈癌新辅助化疗疗效及预后的相关性。方法:回顾性分析2010年1月至2012年12月第二军医大学附属长海医院妇产科75例新辅助化疗后行根治性手术的ⅠB2~ⅡB期患者的临床病理资料,绘制ROC曲线分析PLR与新辅助化疗疗效的关系,预测新辅助化疗疗效的最佳临界(cutoff)值。建立Logistic回归模型分析影响新辅助治疗疗效的独立相关因素,采用单因素及Cox回归模型分析PLR和其他临床病理因素与3年生存率的关系。结果:PLR与新辅助化疗的疗效显著相关,预测新辅助化疗疗效的PLR最佳临界值为123.0,敏感性和特异性分别为0.885和0.522。患者PLR>123.0的3年生存率低于PLR≤123.0(59.8%vs.82.4%),但差异无统计学意义(P=0.116)。单因素分析显示脉管浸润、肿瘤直径>4 cm、淋巴结转移对患者的3年生存率有影响,多因素分析显示仅淋巴结转移是影响患者生存率的独立危险因素(RR=5.375,95%CI为1.351~21.379,P=0.017)。结论:治疗前PLR作为一种简单、经济、可重复的全身炎症反应指标,可有效预测新辅助化疗的疗效,但对预后评估无明显临床价值。
宫颈癌 新辅助化疗 血小板与淋巴细胞比值 预后
在全球范围内宫颈癌是导致妇女死亡的第二大常见肿瘤。在许多发展中国家是最常见的妇科恶性肿瘤,每年导致近23万例女性死亡,但在发达国家仅4万例左右[1]。随着宫颈癌患者的年轻化趋势,以及妇科肿瘤专家手术技能的提高,越来越多的患者倾向于手术去除病灶。新辅助化疗后临床治疗有效的患者,降低了肿瘤分期,提高了手术净切率;而对于临床反应欠佳的患者,由于延迟了治疗时间及治疗不良反应的叠加效应,反而影响了治疗的效果[2]。因此,临床上需要一种在治疗前能有效评估宫颈癌新辅助化疗疗效的参数指标,为临床医师的治疗决策提供依据。血小板与淋巴细胞比值(platelet-to-lymphocyte ratios,PLR)是非特异性系统性炎症指标之一。最近研究报道血液PLR影响如卵巢癌[3]等多种恶性肿瘤的治疗疗效及预后。但到目前为止,PLR与宫颈癌疗效及预后的相关文献鲜有报道,特别是对于新辅助化疗后行根治性手术的ⅠB2~ⅡB期宫颈癌患者,其相关性不明确。本研究的目的是评估治疗前PLR对ⅠB2~ⅡB期宫颈癌患者新辅助化疗的疗效及预后的影响,为临床治疗提高参考。
1 材料与方法
1.1 材料
回顾性分析2010年1月至2012年12月75例在第二军医大学附属长海医院妇产科行新辅助化疗+根治性手术的ⅠB2~ⅡB期局部晚期宫颈癌患者临床病例资料。入选标准:所有病例均由术前病理证实为宫颈癌;排出其他盆腔外的疾病;年龄≤75岁;肝肾功能正常(血尿素氮≤25 mg/dL、肌酐≤1.5 mg/dL、胆红素≤2 mg/dL);治疗前无肿瘤病史。
1.2 方法
1.2.1 化疗方案 TP方案:顺铂75 mg/m2+紫杉醇175 mg/m2,顺铂75 mg/m2+多西他塞100 mg/m2,卡铂60 mg/m2+多西他赛100 mg/m2,卡铂60 mg/m2+紫杉醇210 mg/m2。
1.2.2 手术治疗 研究对象均接受了广泛性全子宫切除+盆腔淋巴结清扫术(Wertheims-Meigs式)。年龄<45岁的患者术中行两侧卵巢活检,送冰冻,病理检查,若证实无肿瘤转移则保留卵巢,并行卵巢移位悬吊。
1.2.3 疗效评定 新辅助化疗3~4周后,行肿瘤临床反应评价。采用直接观察,或测量肿瘤病灶大小的方法,部分病例参照阴道B超或CT测量值来评估。根据WHO实体瘤近期评定标准:肿瘤病变完全消失为完全缓解(complete remission,CR),肿瘤病灶的最大直径缩小达50%以上为部分缓解(partial remission,PR),肿瘤最大直径缩小不足50%或增大不超过25%为稳定(stable disease,SD),肿瘤病灶最大直径增大25%以上或出现新的病灶为进展(progressive disease,PD)。以完全缓解和部分缓解为临床有效(CR+PR),稳定和进展为无效(SD+PD)。
1.2.4 术后辅助治疗 术后病理结果提示有以下复发和转移高危因素者给予术后辅助治疗:1)局部肿瘤直径(LTD)>4 cm;2)淋巴脉管浸润(LVSI);3)深间质浸润(DSI);4)淋巴结转移(LNM);5)宫旁浸润(PE);6)手术切缘阳性(PM)。病理结果提示有复发及转移的高危因素者给予放疗和或新辅助化疗方案。盆腔照射剂量为45~50 Gy,阴道切缘阳性者给予后装放疗。
1.2.5 随访 随访采用门诊定期复诊及电话2种方式,截至日期为2013年9月30日。术后前2年每3个月复查1次,2年后每6个月复查1次。复查内容包括妇科、血液细胞学及血生化检查。胸片及腹部MRI检查前3年每半年复查1次,3年后每年复查1次。
1.3 统计学分析
采用SPSS 20.0统计软件进行统计分析。应用ROC曲线分析PLR与新辅助化疗疗效关系,确定预测新辅助化疗疗效的最佳临界值。单因素疗效的分析采用χ2检验,多因素采用Logistic回归模型。单因素生存率的分析采用Log rank检验法,多因素采用Cox回归模型。P<0.05为差异具有统计学意义。
2 结果
2.1 患者的疗效及预后基本情况
所有患者均接受新辅助化疗及根治性手术。根据WHO实体瘤近期评定标准,其中CR 1例、PR 47例、SD 27例、PD 0例,临床反应率为64%(48/75)。所有患者均完成了随访,中位随访时间37.8个月。所有患者3年总生存率为85%(64/75)。
2.2 PLR预测新辅助化疗疗效的最佳临界值
治疗前PLR为检验变量,新辅助化疗疗效为状态变量,绘制ROC曲线(图1)。以敏感性与特异性之和的最大值为最佳临界值,ROC曲线预测PLR的最佳临界值为123.0,敏感性及特异性分别为0.885及0.522,曲线下面积为0.647(P=0.039)。
2.3 治疗前PLR与新辅助化疗临床疗效的关系
根据新辅助化疗疗效,将75例宫颈癌患者分为有反应和无反应两组,分析新辅助化疗疗效与治疗前血液学指标PLR、血红蛋白及血小板的相关性。结果提示,新辅助化疗疗效与PLR有关,PLR<123.0组患者的临床疗效显著高于PLR≥123.0组患者(P=0.01),而与血红蛋白及血小板计数无明显相关性(表1)。将术前血液学指标PLR、血红蛋白及血小板纳入Logistic回归模型分析,提示PLR与新辅助化疗疗效显著相关(OR=0.068,95%CI为0.016~0.292,P<0.001)。
2.4 治疗前PLR与宫颈癌预后的关系
选择年龄、临床分期、病理类型、病理分化程度、宫颈间质浸润深度、淋巴结转移、淋巴脉管受累、化疗前PLR作为影响宫颈癌患者预后的因素,行单因素Log rank检验。结果显示,3年总生存率与淋巴结转移(P<0.001)及淋巴脉管受累明显相关(P=0.009),而与其他临床病例因素无关(均P>0.05)。PLR<123.0组患者的3年生存率83.3%(25/30),较PLR≥123.0组患者的3年生存率60.0%(27/45)明显增高,但两组宫颈癌患者的生存率差异无统计学意义(P=0.116,图2)。多因素Cox回归模型分析显示,仅淋巴结转移是患者预后的独立危险因素(HR为5.375,95%CI为1.351~21.379,P=0.017),而治疗前PLR与患者的预后无显著相关性(HR为0.843,95% CI为0.506~1.404,P=0.511,表2)。

图1 预测新辅助化疗疗效的最佳PLR值的ROC曲线Figure 1 ROC curve of PLR for the efficacy of neoadjuvant chemotherapy
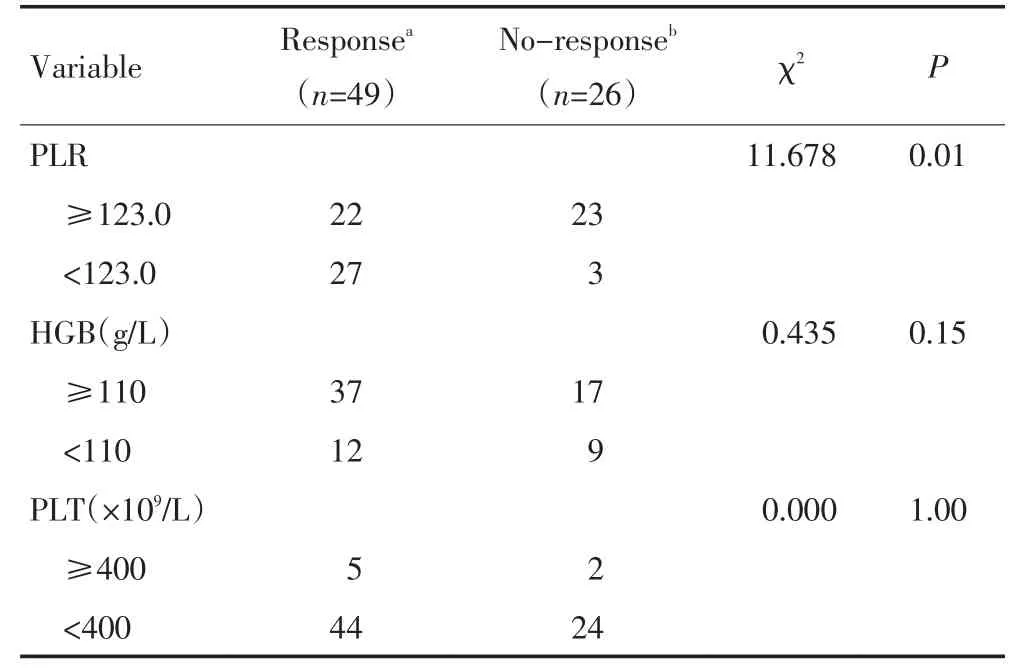
表1 治疗前血液学指标与新辅助化疗疗效的关系Table 1 Correlation between the pretreatment hematology indices with the post-treatment efficacy of neoadjuvant chemotherapy

图2 治疗前PLR值与宫颈癌生存率关系Figure 2 Relationship between PLR and survival(OS)before treatment

表2 宫颈癌患者生存率的多因素Cox回归模型分析Table 2 Cox proportional hazard model analysis of the survival rate of cervical cancer
3 讨论
宿主对恶性肿瘤细胞的反应与全身炎症改变有关,其潜在的机制尚未完全清楚,阐明两者之间的关系将有利于恶性肿瘤的治疗及预后监测。炎症反应包括由细胞因子及趋化因子引发的系统性变化,如血小板计数的增多及淋巴细胞的减少等[4]。血液系统的改变被认为是肿瘤生长、增殖和扩散的重要事件。肿瘤与宿主的炎症细胞产生直接或间接的反应,肿瘤相关的炎症反应通过上调细胞因子和炎症介质促使肿瘤的转移,抑制细胞凋亡,增加肿瘤血管生成,并破坏DNA[5]。
血小板是一项与肿瘤相关的全身炎症反应指标,恶性肿瘤常伴随血小板增多,尤其是晚期肿瘤。血小板分泌血小板源生长因子(PDGF)、PF4、TGF-β、血管上皮生长因子(VEGF)以及血小板反应蛋白-1等肿瘤生长因子[3]。VEGF被认为是肿瘤血管生成的重要中介基因[6],而高水平的TGF-β与肿瘤的不良预后相关[7]。这些生长因子刺激肿瘤的分化与黏附,从而促进肿瘤细胞的增殖与侵袭[8]。肿瘤患者血小板升高提示血小板与肿瘤的治疗疗效及预后存在着内在的联系。
同样,淋巴细胞是抗肿瘤的重要组成部分,可特异性识别而直接杀伤肿瘤细胞或释放一系列细胞因子激活免疫系统,其减少提示机体免疫机制异常、抗肿瘤免疫力下降,为肿瘤浸润转移提供有利环境[9]。肿瘤的缩小不仅与肿瘤的直接杀伤有关,而且很大程度受宿主的免疫状态的影响。在一组接受同步放化疗(CCRT)的局部晚期宫颈癌患者中,肿瘤的完全反应率与患者的基线淋巴细胞数显著相关,且淋巴细胞数越高患者的生存率越高[10]。在结直肠癌、肺癌及乳腺癌中,血液中低淋巴细胞数值可预测患者的化疗反应欠佳[11]。
血小板增多与淋巴细胞减少均与宿主的全身炎症反应程度有关,血小板与淋巴细胞比值是兼于两方面因素的一种新颖的标记物[12]。PLR的升高反映了血小板计数相对增高或淋巴细胞计数相对减少。许多研究表明,PLR与多种肿瘤的疗效及预后相关。Raungkaewmanee等[3]研究表明,治疗前PLR与上皮性卵巢癌的预后有关,高PLR组患者具有更低的生存率及无进展生存期。刘海亮等[13]研究发现,低PLR组患者的5年生存率明显高于高PLR组,且PLR是影响结直肠癌预后的独立危险因素。李健等[14]研究发现,术前PLR是判断非器官局限性肿瘤的潜在因素,高PLR组更易患非器官局限性肿瘤。Wang等[15]研究发现,高PLR数值与子宫内膜癌患者的宫颈间质浸润有关,PLR数值能在术前提前预测子宫内膜癌患者的宫颈间质浸润情况。本研究表明,治疗前PLR与新辅助化疗疗效有关(P= 0.01),PLR值越小其肿瘤的疗效越佳,可在行新辅助化疗前提前预测化疗的疗效,从而为临床治疗决策提供参考。同时,PLR<123.0组患者的3年总生存率要高于PLR≥123.0组的患者(82.4%vs.59.8%),但两组的生存率差异无统计学意义(P=0.116),且多因素分析表明PLR不是患者的独立危险因素,治疗前PLR数值对行新辅助化疗联合根治性手术的宫颈癌患者的预后价值有待进一步研究分析。
总之,治疗前外周血PLR作为临床常见的检验指标,其价格低廉、操作方便、可重复性强,且不需患者额外的抽血及知情同意,易被广大患者所接受,有望成为评价中晚期宫颈癌新辅助化疗疗效的临床参数,从而指导临床决策。PLR对该类患者的预后无显著影响,其对预后的预测价值尚待进一步研究。由于本研究是回顾性研究,样本量较少,仅谨慎得出以上结论,还需大样本前瞻性研究加以确认。
1 Poveda A,Gonzalez-Martin A.Multimodality treatment in locoregional gynecological cancer:cervical cancer treatment update[J]. Ann Oncol,2008,19(Suppl 7):vii70-76.
2 Gianni L,Pienkowski T,Im YH,et al.Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced,inflammatory,or early HER2-positive breast cancer(Neo-Sphere):a randomised multicentre,open-label,phase 2 trial[J].Lancet Oncol,2012,13(1):25-32.
3 Raungkaewmanee S,Tangjitgamol S,Manusirivithaya S,et al.Platelet to lymphocyte ratio as a prognostic factor for epithelial ovarian cancer [J].J Gynecol Oncol,2012,23(4):265-273.
4 Brahmer JR,Tykodi SS,Chow LQ,et al.Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J].N Engl J Med,2012,366(26):2455-2465.
5 Voloshin T,Voest EE,Shaked Y.The host immunological response to cancer therapy:An emerging concept in tumor biology[J].Exp Cell Res,2013,319(11):1687-1695.
6 Majeti BK,Lee JH,Simmons BH,et al.VEGF is an important mediator of tumor angiogenesis in malignant lesions in a genetically engineered mouse model of lung adenocarcinoma[J].BMC Cancer, 2013,13(1):213.
7 Unal D,Eroglu C,Kurtul N,et al.Are neutrophil/lymphocyte and platelet/lymphocyte rates in patients with non-small cell lung cancer associated with treatment response and prognosis[J]?Asian Pac J Cancer Prev,2013,14(9):5237-5242.
8 Stone RL,Nick AM,McNeish IA,et al.Paraneoplastic thrombocytosis in ovarian cancer[J].N Engl J Med,2012,366(7):610-618.
9 Kitayama J,Yasuda K,Kawai K,et al.Circulating lymphocyte number has a positive association with tumor response in neoadjuvant chemoradiotherapy for advanced rectal cancer[J].Radiat Oncol, 2010,5:47.
10 Choi CH,Kang H,Kim WY,et al.Prognostic value of baseline lymphocyte count in cervical carcinoma treated with concurrent chemoradiation[J].Int J Radiat Oncol Biol Phys,2008,71(1):199-204.
11 Milne K,Alexander C,Webb JR,et al.Absolute lymphocyte count is associated with survival in ovarian cancer independent of tumor-infiltrating lymphocytes[J].J Transl Med,2012,10:33.
12 Smith RA,Bosonnet L,Ghaneh P,et al.The platelet-lymphocyte ratio improves the predictive value of serum CA19-9 levels in determining patient selection for staging laparoscopy in suspected periampullary cancer[J].Surgery,2008,143(5):658-666.
13 Liu HL,Du XH,Sun PN,et al.Preoprative platelet-lymphocyte ratio is an independent prognostic factor for resectable colorectal cancer[J].J South Med Univ,2013,33(1):70-73.[刘海亮,杜晓辉,孙培鸣,等.术前血小板与淋巴细胞比值对结直肠癌预后的影响[J].南方医科大学学报,2013,33(1):70-73.]
14 Li J,Ye DW,Yao XD,et al.The value of preoperative platelet to lymphocyte ratio in predicting of clinical stage and progrosis in upper tract urothelial carcinoma[J].China Oncology,2013,23(6):457-461. [李 健,叶定伟,姚旭东,等.术前血小板/淋巴细胞比值判断上尿路尿路上皮癌临床分期及预后的价值[J].中国癌症杂志,2013,23(6):457-461.]
15 Wang D,Yang JX,Cao DY,et al.Preoperative neutrophil lymphocyte and platelet-lymphocyte ratios as independent predictors of cervical stromal involvement in surgically treated endometrioid adenocarcinoma[J].Onco Targets Ther,2013,6:211-216.
(2014-03-21收稿)
(2014-07-07修回)
Association of pre-treatment platelet-to-lymphocyte ratios with response to neoadjuvant chemotherapy and clinical outcomes of cervical cancer patients
Wenyu ZHOU1Jinchan CHEN2Ning HUI1
Ning HUI;E-mail:15026810306@163.com
1Department of Obstetrics and Gynecology,Changhai Hospital of the Second Military Medical University,Shanghai 200433;2Department of Obstetrics and Gynecology,Chinese People's Armed Police Forces Hospital,Yangzhou,225000;3Department of Obstetrics and Gynecology,the Chinese People's LiberationArmy No.454 Hospital,Nanjing 225000,China
Objective:To evaluate the predictive value of pretreatment platelet-to-lymphocyte ratios(PLRs)in response to neoadjuvant chemotherapy and prognostic outcome in patients with International Federation of Gynecologists and Obstetricians(FIGO)Stages IB2-IIB cervical cancer.Methods:An investigation was conducted from January 2010 to December 2012 on 75 patients with FIGO Stages IB2-IIB cervical cancer,who underwent neoadjuvant chemotherapy and radical surgery in Changhai Hospital,Shanghai.A receiver operating characteristic(ROC)curve was used to determine the best PLR cut-off value in predicting the response to neoadjuvant chemotherapy.The relationships between the pretreatment variables and the response to neoadjuvant chemotherapy were assessed in univariate and multivariate settings.The overall three-year survival rates were analyzed using the log-rank test and Cox regression model.Results:The response to neoadjuvant chemotherapy was associated with PLR.At the threshold of 123.0,the PLR was 88.5%sensitive and 52.2%specific.Multivariate analysis showed that the low independent PLR predicted the response to neoadjuvant chemotherapy well.Based on the log-rank test,the three-year survival rate was lower in patients with PLR>123.0 than those with PLR<123.0 (59.8%vs.82.4%),but no statistically significant differences were observed between them(P=0.116).Mono-factorial analysis showed that vascular invasion(a tumor that is>4 cm in diameter)and lymph node metastasis influenced the three-year survival rate.In the Cox regression model,only the lymph node metastasis was identified as an independent risk factor for poor prognosis(RR:5.375;95%CI: 1.351-21.379;P=0.017).Conclusion:Pretreatment PLR is an easily measured,reproducible,and inexpensive marker of systemic inflammation and thus shows a prognostic and independent predictive value for the response to neoadjuvant chemotherapy in cervical cancer.However,pretreatment PLR is not a clinically significant factor for the assessment of cervical cancer prognosis.
uterine cervical neoplasm,neoadjuvant chemotherapy,platelet-to-lymphocyte ratio,prognosis

10.3969/j.issn.1000-8179.20140456
①第二军医大学附属长海医院妇产科(上海市200433);②武警江苏省总队医院妇产科;③中国人民解放军第454医院妇产科
惠宁 15026810306@163.com
周文毓 硕士,住院医师。专业方向为妇科肿瘤基础及临床治疗。
E-mail:15026810306@163.com

