基于3D细胞培养系统的肺癌类干细胞的分离和鉴定*
刘芃芃 于文文 程亚楠 韩 雷 陈永孜 魏熙胤 李 慧任秀宝 于津浦
·基础研究·
基于3D细胞培养系统的肺癌类干细胞的分离和鉴定*
刘芃芃①②于文文②程亚楠①韩 雷①陈永孜③魏熙胤④李 慧②任秀宝②于津浦①②
目的:本研究建立三维细胞培养方法(3D)以分离和鉴定肺癌类干细胞,并与二维细胞培养方法(2D)比较,初步探讨该方法在评价肺癌体外增殖、凋亡、侵袭和药物反应性方面的应用。方法:将人肺腺癌细胞系A549以1×104个/孔的细胞与RPMI 1640和伊格尔基础培养基(basal medium of eagle,BME)制成细胞悬液,培养7 d,收集细胞采用流式细胞仪进行类干细胞表型检测,以及体外成球、耐药性、体内成瘤等干细胞功能鉴定,并将3D与2D细胞培养的A549细胞进行比较。结果:细胞表型检测证明3D系统培养的A549细胞中CD44和CD326阳性比例升高,CD24阳性比例下降,细胞体外成球率显著升高(28.50%±1.17%vs. 8.67%±0.80%,P<0.01)对顺铂耐药性显著提高。加药后48 h为58.17%±2.19%vs.33.27%±5.76%(P<0.01),加药后72 h为41.70%±5.81%vs.27.30%±4.25%(P<0.01),体内成瘤时间显著缩短[(20.75±0.85)d vs.(60.25±1.49)d,P<0.01]。结论:3D培养的肺癌细胞中获得更高比例的类干细胞样细胞,具有体内成瘤快、体外成克隆团率高、耐药性提高的特征。
肺癌 3D细胞培养 肿瘤干细胞
肺癌是最常见的恶性肿瘤,目前在全世界范围内发病率及病死率均位居前列[1]。尽管在分子分型和靶向治疗上取得了重大的进展,但是肺癌的5年生存率并未得到有效改善,高复发仍然是肺癌致死的主要原因[2]。近年来,肿瘤干细胞在肿瘤发生和发展中的作用受到广泛关注,研究表明,肺癌干细胞在肺癌的发生、发展、转移、浸润、复发和耐药的过程中起着重要作用[3]。干细胞具备高增殖能力、高侵袭力、多向分化、化疗抵抗和寿命长等特征,极大程度上影响了肺癌患者的预后。因此,建立特异性类干细胞培养方法对深入探讨类干细胞特征,进一步阐明肺癌的发生和发展的分子机制,寻找更有效的肺癌靶向治疗药物具有重要意义。
文献报道,在癌症研究中3D细胞培养技术可以弥补传统的2D细胞培养无法模拟细胞体内生存环境的缺陷,通过立体培养为细胞提供一个更加接近体内生存条件的微环境[4]。而且3D培养得到的细胞形态比2D的更加精确,细胞形态精确与否常常对细胞的功能产生影响[5]。为此,在前期研究基础上建立一套基于3D的肺癌类干细胞培养和分离方法,将人肺腺癌细胞系A549接种至RPMI 1640培养基和BME为基础的3D培养体系中,简单易操作。本研究欲利用3D培养人肺腺癌细胞系A549,从中分离类干细胞,观察其是否比2D的细胞系具有更强的增殖能力,更低的凋亡,更高的转移潜能以及更差的药物反应性[6-8]。
1 材料与方法
1.1 材料
1.1.1 细胞 A549肺癌细胞株购自中国科学院上海生命科学研究院细胞中心,由本实验室保存。
1.1.2 试剂 RPMI 1640培养基、0.25%Trypsin胰蛋白酶、胎牛血清购自美国Hyclone公司,BME、回收液购自美国BD公司,二甲基亚砜(DMSO)购自美国Sigma公司,Antibiotic-Antimycotic购自美国Invitrogen公司。细胞因子购自美国Sigma公司,FITC标记的CD326抗体及同亚型对照IgG2b、PE标记的CD24抗体及同亚型对照IgG1、APC标记的CD44抗体及同亚型对照IgG1等均购自美国Biolegend公司,顺铂(cisplatin,DDP)注射液购自云南生物谷灯盏花药业有限公司,MTT购自美国Sigma公司。
1.1.3 动物 Scid裸鼠,体质量17~18 g,SPF级动物,由北京维通利华实验动物技术有限公司繁育,动物证号为SYXK(京)2012-0001。本实验经科研机构委员会批准,符合国家有关实验动物管理条例。
1.2 方法
1.2.1 细胞培养 实验分为3D组和2D组2组。在2D培养组中A549细胞用含10%胎牛血清的RPMI 1640完全培养基,置于37℃、5%CO2、相对湿度90%的培养箱中培养。取对数生长期细胞悬液,以细胞1×104个/孔接种于普通96孔板中,0.25%胰酶消化、传代、到期后回收细胞。在3D培养组中以200 μL同样的浓度加到已铺好BME的96孔板里,到期后用分散酶消化BME、回收液回收细胞。诱导出的肺癌类干细胞,分别用于体内动物模型的建立以及类干细胞筛选。每组设置3个复孔为平行对照。
1.2.2 流式细胞仪检测类干细胞特异性抗体 收集两组培养3、7、11、14、20 d的细胞,分别制成细胞悬液,每管细胞调整为1×105个,分别用抗体标记物标记,进行流式细胞仪免疫表型检测,鉴定类干细胞。
1.2.3 成球实验 将2组培养7 d的细胞以5×103个/孔用无血清RPMI 1640培养基接种到6孔板中,7 d后观察细胞的成球率。
1.2.4 药物反应性实验 将3D和2D培养7 d的A549细胞制成单细胞悬液,调整细胞浓度为1×105/mL,接种于96孔板中,每孔100 μL,空白对照孔只加培养液。置于37℃、5%CO2饱和湿度培养箱中,待细胞完全贴壁,次日分别加入100 μL含顺铂的培养基,每孔总体积为200 μL。每组做3个平行孔,分别培养24、48、72 h,而后每孔加入5 mg/mL的MTT 20 μL,继续培养4 h,离心培养板,弃上清,加入DMSO 150 μL/孔,微量震荡器轻微振荡10 min,溶解结晶。在酶标仪490 nm波长下检测各孔吸光度(OD值),按下列公式计算细胞存活率。细胞存活率=实验组OD值/对照组OD值×100%。MTT实验在不同日重复3次。
1.2.5 体内动物模型建立 将2组培养7 d的细胞分别以细胞5×104个/只接种到Scid裸鼠体内,每组4只。每3天测量瘤块的A(长)和B(宽),按下列公式计算瘤块的体积。瘤块体积(V)=3.14×A2×B/6,并绘制生长曲线,X轴代表体内接种后的天数,Y轴代表测量的瘤块体积。
1.3 统计学方法
采用SPSS 17.0软件对实验数据进行统计分析。实验数据以±s表示。组间比较采用单因素方差分析或t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 3D培养细胞的表型鉴定
2.1.1 3D培养的肺癌细胞表面抗体检测 CD326、CD44阳性率升高,CD24阳性率降低为干细胞鉴定指标。结果表明,3D培养7 d的A549细胞表面CD326与CD44双阳性比例显著高于2D培养组(15.33%± 0.55%vs.1.50%±0.53%,56.13%±2.98%vs.6.23%± 0.91%,P<0.01,图1),但CD24明显低于2D培养组(1.10%±0.26%vs.67.63%±0.94%,P<0.01)。这说明经过3D培养的细胞内有大量的肺癌类干细胞存在。
2.2 3D培养细胞的功能检测
2.2.1 成球实验 干细胞可以形成单克隆微球体,直径超过70 μm被认为是1个单克隆微球体。A549细胞培养7 d后,3D培养的要比2D培养的细胞成球率高(28.50%±1.17%vs.8.67%±0.80%,P<0.05,图2),这说明3D培养出了更高比例的类干细胞样细胞。
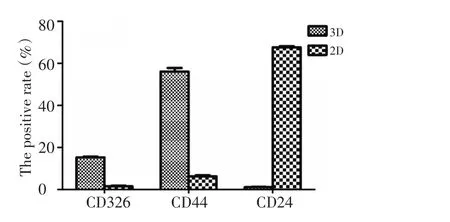
图1 比较3D和2D培养的肺癌类干细胞表面抗体阳性率Figure 1 Comparison of antibody positive rate in surface of lung cancer stem-like cells between 3D and 2D cultured
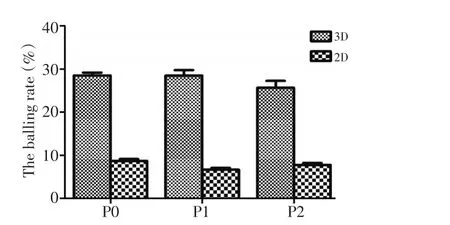
图2 比较3D与2D培养肺癌细胞7 d后的成球率Figure 2 Comparison of balling rate for lung cancer cells between 3D and 2D cultured for 7 days
2.2.2 药物反应性检测 分别提取第7天3D培养和2D培养的A549细胞接种于96孔板(5×104/mL),同时加入顺铂,MTT法比较2种培养提取的细胞生长状况。结果为2组细胞加入顺铂后,24 h细胞存活率无明显区别(75.27%±1.99%vs.79.30%±3.48%,P<0.01),但是在48 h和72 h,3D组细胞存活率均高于2D组(58.17%±2.19% vs.33.27%±5.76%,41.70%±5.81%vs.27.30%±4.25%,P<0.05,图3),表明3D培养的细胞较2D培养的细胞更具耐药性。
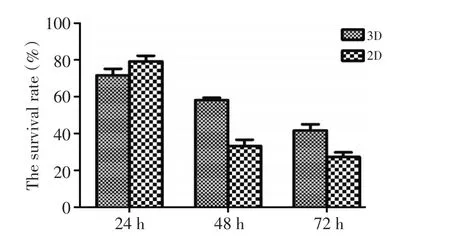
图3 比较3D与2D培养的肺癌细胞对药物的反应性Figure 3 Comparison of drug resistance in lung cancer cells between 3D and 2D cultured
2.2.3 体内成瘤实验 将2组培养出来的A549细胞以5×104个/只分别接种至Scid裸鼠体内,观察肿瘤体积,绘制肿瘤生长曲线。3D组的A549细胞接种小鼠成瘤至1 cm3的时间显著少于2D[(20.75±0.85)d vs.(60.25±1.49)d,P<0.01)],肿瘤生长速度比2D快,接种后第20天肿瘤体积明显大于2D组[(967.0±2.726)mm3vs.(346.1±2.023)mm3,P<0.05,图4]。
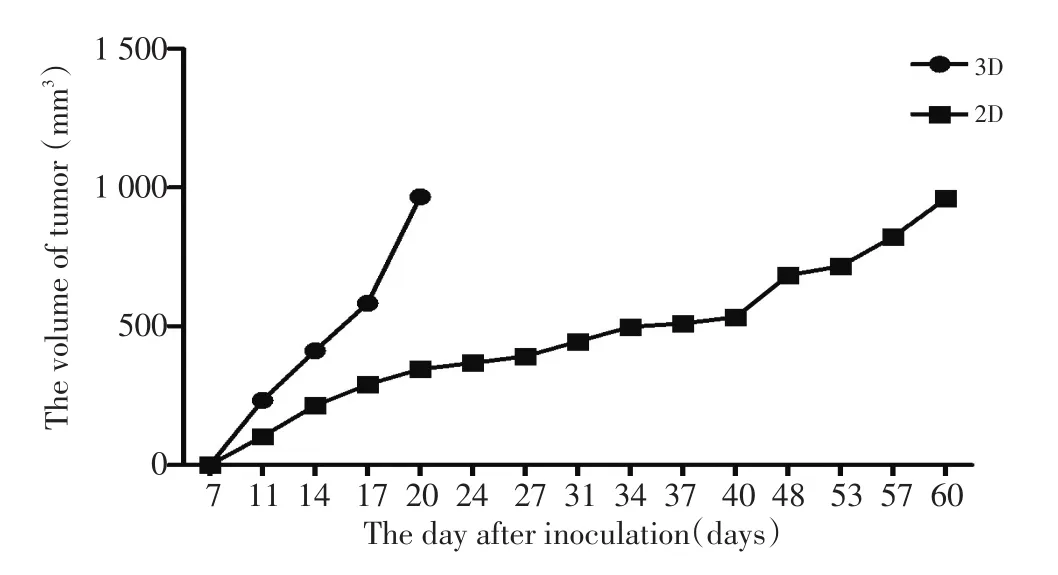
图4 比较3D与2D培养的肺癌细胞在Scid裸鼠体内的成瘤生长曲线Figure 4 Comparison of tumor growth curves in vivo between 3D and 2D cultured lung cancer cells
3 讨论
肿瘤干细胞假说认为,肿瘤干细胞具有对化疗药物的天然耐药性,并与肿瘤细胞的生长、转移和复发等密切相关。肿瘤干细胞在肿瘤细胞内数量极少但具有极强的繁殖和诱导正常细胞恶化能力,也是肿瘤获得耐药性的主要原因之一[9]。
传统的2D方法在信号转导、细胞扩增、模拟细胞体内生存环境等方面存在缺陷[10]。首先不能模拟正常组织中的化学信号或分子梯度[11],干扰细胞表面蛋白质-蛋白质相互作用的信号转导,进而影响细胞的主要代谢途径和基因表达[12]。到目前为止,在2D中尚未找到有效的方法培养出足够数量的肿瘤干细胞。
相对于2D,3D容纳了更高密度的细胞黏附和增殖空间,有利于细胞间信号传递,更能够模拟细胞体内生长环境,在细胞培养过程中,细胞形态比2D的更加接近体内生存微环境下的形态[13]。3D培养方法使细胞生长空间更大,营养物和代谢物流通顺畅,同时也无体内众多干扰因素存在,因此,更有利于肿瘤普通细胞,尤其是类干细胞自我繁殖形成克隆团,导致类干细胞比例明显增多。
为进一步验证3D培养的A549是否可以增殖出更多的肺癌类干细胞,本研究选择了3种特异性肺癌干细胞表面抗体CD326、CD44和CD24,采用流式细胞分离术以鉴定肺癌类干细胞。CD326被称为人类上皮抗原(HEA),是早期干细胞的特异性标记物之一,多表达在内皮祖细胞上[14]。CD44属于黏附分子,可介导多种细胞与细胞、细胞与细胞外基质(ECM),促进T、B细胞分化以及T细胞活化,与肿瘤的关系主要表现在促进肿瘤的发生、发展和侵袭、转移两个方面[15]。CD24是一种表达于髓核组织细胞表面的分子标记,能参与肿瘤细胞转移和分化过程,为阴性标志物[16]。结果表明3D培养的A549细胞出现了CD326、CD44阳性比例升高和CD24比例降低,并且阳性率是2D的9.22倍,这说明经过3D培养后肺癌类干细胞比例明显增加。在此基础上,本研究又进行了一系列功能学检测,发现经3D培养的A549细胞要比2D的细胞体外成球率高,对顺铂耐药性显著提高,体内成瘤时间短,这些都证明经3D培养的A549细胞具有一定的干细胞功能特征,表明3D培养有大量的肺癌类干细胞存在。
综上所述,3D培养有利于肿瘤类干细胞的生成,这为肿瘤干细胞的培养和筛选提供了一个更为有效迅速的方法,为肿瘤干细胞研究、靶向治疗药物研发和肿瘤临床治疗提供了有效手段。但本研究仅限于肺腺癌细胞系,是否适用于肺鳞癌细胞系、肺癌原代细胞、肝癌细胞系或者肝癌原代细胞,以及是否提高其干细胞比例还有待于进一步研究。
1 Lemmon MA,Schlessinger J.Cell signaling by receptor tyrosine kinases[J].Cell,2010,141(7):1117-1134.
2 Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
3 Xu Y,Hu YD.Lung cancer stem cells research.Clues from ontogeny[J].Saudi Med J,2009,30(11):1381-1389.
4 Rimann M,Graf-Hausner U.Synthetic 3D multicellular systems for drug development[J].Curr Opin Biotechnol,2012,23(5):803-809.
5 Cao Y,Li D,Shang C,et al.Three-dimensional culture of human mesenchymal stem cells in a polyethylene terephthalate matrix[J]. Biomedical Materials,2010,5(6):065013.
6 Hewitt HB,Wilson CW.A Survival Curve for mammalian leukaemia cells irradiated'in vivo(implications for the treatment of mouse leukaemia by whole-body irradiation)[J].Br J Cancer,1959,13(1):69-75.
7 Nicolis SK.Cancer stem cells and"stemness"genes in neuro-oncology[J].Neurobid Dis,2007,25(2):217-229.
8 Mimeault M,Hauke R,Mehta PP,et al.Recent advances in cancer stem/progenitor cell research:therapeutic implications for overcoming resistance to the most aggressive cancers[J].JCell Mol Med, 2007,11(5):981-1011.
9 Dean M,Fojo T,Bates S.Tumour stem cells and drug resistance[J]. Nature Reviews Cancer,2005,5(4):275-284.
10 Jordan CT.Cancer stem cell biology:from leukemia to solid tumors [J].Curr Opin Cell Biol,2004,16(6):708-712.
11 Souza GR,Molina JR,Raphael RM,et al.Three-dimensional tissue culture based on magnetic cell levitation[J].Nat Nanotechnol, 2010,5(4):291-296.
12 Mani SA,Guo W,Liao MJ,et al.The epithelial-mesenchymal transition generates cells with properties of stem cells[J].Cell,2008,133(4):704-715.
13 Cook MM,Futrega K,Osiecki M,et al.Micromarrows-three-dimensional coculture of hematopoietic stem cells and mesenchymal stromal cells[J].Tissue Eng Part C Methods,2012,18(5):319-328.
14 Lin S,Sun J,Wu J,et al.Aberrant microRNAs expression in CD133+/CD326+human lung adenocarcinoma initiating cells from A549[J].Mol Cells,2012,33(3):277-283.
15 Chen J,Wang J,Chen D,et al.Evaluation of characteristics of CD44+CD117+ovarian cancer stem cells in three dimensional basement membrane extract scaffold versus two dimensional monocultures[J].BMC Biol,2013,14(1):7.
16 Lu ZQ,Li HG,Zhang HZ,et al.Expression and significance of CD44 (+)ESA(+)CD24(-/low),stem cell markers for breast cancer,in non-small-cell lung carcinoma[J].Aizheng,2008,27(6):575-579.
(2014-03-26收稿)
(2014-06-16修回)
(本文编辑:杨红欣)

刘芃芃 硕士。专业方向为肿瘤药理学,包括利用3D培养分离干细胞研究。
E-mail:cgtwins@126.com
·读者·作者·编者·
吸烟与ER阳性乳腺癌相关
根据一项新的研究结果,青年女性吸烟者罹患常见类型乳腺癌的风险升高。研究者发现,在20岁至44岁的女性人群中,平均每天吸烟一盒,烟龄超过10年者,患ER阳性乳腺癌的风险比少吸烟或不吸烟者高出60%。(Cancer 2014年2月10日在线版)。研究者们分析了2004-2010年间美国大西雅图地区确诊为乳腺癌的年轻女性群体资料。其中778例为ER阳性乳腺癌。另纳入938名健康妇女作为对照。结果表明:曾经吸烟的年轻女性罹患乳腺癌的几率比从不吸烟者高30%。作者认为,香烟中可能存在一些物质,其作用类似雌激素,导致ER阳性乳腺癌的发生。
我国是世界上最大的烟草生产和消费国,每年因吸烟导致死亡的人数已超过100万,至2050年将突破300万,二手烟暴露也极为普遍。然而,我国公众对吸烟的严重危害普遍缺乏认识,烟民中年轻人占据的比例仍在不断攀升,部分人还抱有错误观念,以致控烟的觉悟与动力不足。因此,以坚实的科学证据昭示吸烟危害是推动控烟的关键。
——引自《全球肿瘤快讯》
Isolation and identification of lung cancer stem-like cells based on a 3D cell culture system
Pengpeng LIU1,2,Wenwen YU2,Ya'nan CHENG1,Lei HAN1,Yongzi CHEN3,Xiyin WEI4,Hui LI2,Xiubao REN2,Jinpu YU1,2
Jinpu YU;E-mail:jinpu_yu@hotmail.com
1Cancer Molecular Diagnosis Core,Tianjin Medical University Cancer Institute and Hospital National Clinical Research Center for Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin,China;2Department of Biotechnology,Key Laboratory of Cancer Immunology and Biotherapy;3Laboratory of Cancer Cell Biology;4Public Laboratory of Cancer Cell Biology,Tianjin 300060,China
This study was supported by the National Natural Science Foundation of China(No.81272221)
Objective:To highlight the developmental process of 3D cell culture technology system,which is more suitable for isolating and identifying lung cancer stem-like cells than 2D cell culture technology system,and to explore the application of 3D cell cultures in the evaluation of proliferation,apoptosis,invasion,and drug resistance of lung cancer.Methods:Cells(104/well)from the human lung adenocarcinoma cell lines A549 and RPMI 1640 were cultured in complete medium containing 10%fetal bovine serum. Cell suspension was cultured in a BME basal medium.A growth curve was drawn after 7 d of culture.The stem-like cell was identified through a mammosphere culture,drug resistance and invasion assay,and flow cytometry.Data of A549 cells cultured in 3D and 2D traditional cell culture technologies were compared.Results:Cells from the 3D cell culture had higher tumor formation rates[(20.75± 0.85)d vs.(60.25±1.49)d,P<0.01)]and tumor sphere formation(28.50%±1.17%vs.8.67%±0.80%,P<0.01)than those from the 2D cell culture.Moreover,cells from 3D cell culture were more invasive and resistant to therapy(58.17%±2.19%vs.41.70%±5.81%in 48 h,P<0.01;33.27%±5.76%vs.27.30%±4.25%in 72 h,P<0.01).Phenotype experimental results demonstrated that the CD44 and CD326 cells were double-positive,whereas the CD24 cell was negative.Conclusion:The proportion of stem-like cells in A549 cell line after 3D cell culture significantly increased compared with 2D cell culture.The 3D cell culture can promote the proliferation of lung cancer stem cells.
lung neoplasms,3D cell culture,cancer stem cells
10.3969/j.issn.1000-8179.20140494
①天津医科大学肿瘤医院肿瘤分子诊断中心,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060);②生物技术研究室,天津市肿瘤免疫与生物治疗重点实验室;③肿瘤细胞生物学实验室;④公共实验室
ƽ本文课题受国家自然科学基金项目(编号:81272221)资助
于津浦 jinpu_yu@hotmail.com

