5′-氮杂-2′-脱氧胞苷对结直肠癌细胞株HT-29和LoVo中MLH-1基因甲基化状态、mRNA及蛋白表达的影响
葛 畅,许春伟,王鲁平,方 园,张玉萍
(中国人民解放军北京军区总医院 病理科,北京 100700)
结直肠癌(colorectal cancer,CRC)作为最常见恶性肿瘤之一,其发病率仅位于肺癌和前列腺癌(女性为乳腺癌)之后,居第3位,而每年CRC病死率约占全部恶性肿瘤死亡总人数的8%,在恶性肿瘤死因中居第4位[1]。CRC的发生与发展与癌基因和抑癌基因的缺失、扩增或突变有关。有些基因在染色质水平上发生表型遗传修饰改变也会导致表达下调。表型遗传修饰最多见的是CpG岛(CpG island)的甲基化改变。错配修复基因MLH-1 定位于人类染色体3p21.3~23,含19个外显子,全长约58 kb,其开放读码框(ORF)长2 268 bp,编码含756个氨基酸的蛋白质,是错配修复系统中最为重要的基因,其功能为调节细胞周期,使之阻滞于G2期,从而在染色体分离前,纠正错配的碱基,使DNA得以正确复制[2]。该基因缺陷可导致细胞在增殖过程中的错误掺入和缺失不能修复,造成高度微卫星不稳定(MSI-H),随机突变率增高,引起一系列涉及细胞生长、分化、凋亡及癌转移的相关靶基因(如TGF-βⅡR、IGFⅡ和BAX等)继发性的突变改变,从而导致肿瘤的发生或转移[3]。研究发现,MLH-1启动子区高甲基化状态可能是此基因失活的一种重要机制[4]。本实验通过研究5′-氮杂-2′-脱氧胞苷对HT-29和LoVo细胞株作用后MLH-1基因的DNA、mRNA和蛋白水平的改变进行初步探究,探讨肿瘤发生发展过程中MLH-1基因失活的甲基化机制及药物恢复MLH-1基因表达的可能性,以期寻找CRC的肿瘤标记物及新的治疗靶点。
1 材料与方法
1.1 材料 结直肠癌细胞株HT-29和LoVo(北大医学部107实验室);DNA提取试剂盒(德国QIAGEN公司);核酸蛋白质浓度测量仪B-500(上海创萌生物科技有限公司),DNA甲基化修饰试剂盒及甲基化阳性/阴性对照(美国ZYMO公司);qPCR反应试剂ROX(TaKaRa公司);Mix(上海辉睿生物科技有限公司);Mx3000P定量PCR扩增仪(美国 Stratagene公司);引物由生工生物工程(上海)有限公司合成;5′-氮杂-2′-脱氧胞苷(美国Sigma公司),以DMSO溶剂充分溶解后配制成0.1 μmol/L的母液,分装后-80℃保存;MLH-1和内参β-actin(美国Santa Cruz公司),Western blot相关试剂(北京索莱宝科技有限公司)。
1.2 细胞培养和干预 结直肠癌细胞株HT-29和LoVo置于10%胎牛血清和100 μl/ml青霉素、链霉素的RPMI1640的培养基中常规培养,胰酶消化传代。取贴壁生长良好的的细胞以RPMI1640调整细胞密度至2×106/ml,接种于六孔培养板。干预的LoVo和HT-29细胞分别加入0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷混合培养液,每24h更换新鲜培养基,连续作用72h;以HT-29和LoVo分别加入等量DMSO溶剂培养作为对照。
1.3 Methylight方法 取对数生长期的HT-29和LoVo细胞株,胰酶消化后抽提DNA。抽提DNA按DNA提取试剂盒(德国QIAGEN公司)说明提取上述两种细胞不同浓度梯度的细胞DNA,用紫外分光光度仪(上海创萌生物科技有限公司)测DNA浓度,以DNA浓度在25ng/μl为最低浓度,使用DNA修饰试剂盒进行亚硫酸氢盐修饰,按照试剂盒说明书操作,MLH-1基因甲基化引物按文献设计[5],上游引物:5′-AACATATACAACGCATACCCACAA-3′,下游引物:5′-GTAAAGAAATATACGGTTTGCGGAAA-3′,探针:FAM 5′-CGCCGAATTCCCTAACGTACCAATCAAACC-3′ BHQ1,内参β-actin基因甲基化按文献设计[6],上游引物:5′-TGGTCATCCAGGTTTAGTAACT-3′,下游引物:5′-AACCAATAAACCTACTCCTCCCTTAA-3′,探针:FAM 5′-ACCACCACCCAACACACAATAACAAACACA-3′BHQ1。PCR反应总体系为20 μl,2×Taq PCR Master Mix 10 μl;修饰后的DNA模板2 μl;上、下游引物各1 μl(10 pmol);探针FAM 0.4 μl(10 pmol);ROX 0.3 μl。反应条件:94℃预变性5min;94℃ 30 s,56℃ 45 s,72℃ 45 s,共50个循环;72℃延伸5 min,4℃冷却5 min。经亚硫酸氢盐修饰的Human Methylated & Non-methylated DNA Set作为阳性、阴性对照,水为空白对照。
1.4 实时荧光定量PCR分析结直肠癌细胞株LoVo和HT-29中MLH-1基因mRNA的表达情况 取对数生长期的HT-29和LoVo细胞,胰酶消化后抽提细胞总RNA,逆转录合成cDNA,行实时荧光定量PCR。MLH-1基因mRNA引物由Primer Premier 5.0软件设计,上游引物:5′-TCCCGAAAGGAAATGACT-3′,下游引物:5′-TGGCTTGTGGTGCTGAGTG-3′;内参基因GAPDH上游引物:5′-GGCTGCTTTTAACTCTGG-3′,下游引物:5′-GGAGGGATCTCGCTCC-3′。20 μlPCR反应体系含10 μl SYBR Premix Ex TaqTM(2×)、上、下游引物(10 μmol/L)各1 μl、0.3 μlROX Reference Dye(50×)、4.0 μlDNA模板、3.7 μl dH2O。反应条件为95℃预变性5 min;95℃ 10 s,55℃ 40 s,72℃ 45 s,共40个循环;72℃延伸1 min,70℃延伸30 s,95℃延伸30 s。实验重复3次,取均值。扩增完毕后分析熔解曲线,采用2-△△Ct法分析MLH-1 mRNA表达。△△Ct=(Ct处理组目的基因-Ct处理组内参基因)-(Ct对照组目的基因-Ct对照组内参基因)。
1.5 Western blot分析结直肠癌细胞株HT-29和LoVo中MLH-1蛋白的表达情况 取对数生长期的HT-29和LoVo细胞,在上述两种细胞株各个浓度梯度的每管细胞中加入80 μl蛋白裂解和1 μl蛋白酶抑制剂PMSF液于冰上裂解30 min。15 000 r/min 37℃离心,10 min后取上清液提取总蛋白,BCA法蛋白定量。总蛋白100℃变性5 min后,配置浓度为12%的SDS-PAGE凝胶,进行蛋白质电泳,蛋白电泳分离后经电转移槽转移至PVDF膜。BSA室温封闭2h后,PVDF膜置于1∶200稀释的MLH-1单克隆抗体稀释液中4℃冰箱内培养过夜,TBST洗膜3次,每次10 min,再置于1∶20 000稀释的HRP标记的山羊抗兔IgG稀释液中37℃培养2 h,TBST洗膜4次,每次10 min,然后加入ECL发光液显影,采集并分析处理图像。凝胶成像系统摄像并分析各条带吸光度值,以0.5 μmol/L 5′-氮杂-2′-脱氧胞苷条带吸光度(A)值/β-actin条带吸光度(A)值为基准,设置为1。以目的基因条带吸光度(A)值/β-actin条带吸光度(A)值作为MLH-1蛋白的相对表达强度。实验重复3次,取均值。
1.6 结果判断标准 MethyLight结果判断标准[7]:同时扩增目的基因(MLH-1)和内参基因(β-actin),根据标准曲线得到两者的原始拷贝数,计算标准甲基化指数(the normalized index of methylation,NIM)其定义为:NIM=[(MLH-1 sample/MLH-1 positive)/(β-actin sample/β-actin positive)]×100,其中MLH-1 sample指样本中甲基化MLH-1基因的拷贝数,MLH-1 positive指阳性对照中甲基化MLH-1基因的拷贝数,β-actin sample和β-actin positve与上述相同。NIM≥4为甲基化,NIM<4为非甲基化。
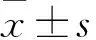
2 结果
2.1 结直肠癌细胞株HT-29和LoVo中MLH-1基因甲基化状况 将阳性对照按10的倍数稀释成1~1×10-67个浓度梯度制作标准曲线(其拷贝数为103~109/ml)。各浓度梯度反应均做复孔。MethyLight的线性范围为104~108拷贝/ml,R2为0.998。实时荧光定量PCR得出数据按MethyLight结果判断标准,在DMSO对照组、0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组中HT-29和LoVo细胞株中MLH-1基因甲基化状态都为甲基化、甲基化、未甲基化和甲基化(表1)。

表1 HT-29和LoVo细胞株中MLH-1基因甲基化状况
2.2 结直肠癌细胞株LoVo和HT-29中MLH-1基因mRNA表达状况 实时荧光定量PCR得出的数据检验扩增效率(E)通过公式E=2-1/斜率-1计算,MLH-1基因mRNA为0.963,GAPDH基因mRNA为0.977,两个基因的扩增效率相差<5%,符合用2-△△Ct法相对定量分析条件。经2-△△Ct法分析并以对照组、各不同浓度实验分组为横坐标,将测出相应的平均相对定量比值为纵坐标绘出柱状图后发现0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷作用后,HT-29细胞株中MLH-1基因的mRNA表达水平较对照组上调,并且呈时间、药物浓度依赖性(F=8.918,P=0.010),与对照组DMSO组比较1.0 μmol/L 5′-氮杂-2′-脱氧胞苷实验组和1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组有统计学差异(P<0.05);LoVo细胞株中MLH-1基因的mRNA表达水平较对照组上调,并且也呈时间、药物浓度依赖性(F=8.351,P=0.011),与对照组DMSO组比较1.0 μmol/L 5′-氮杂-2′-脱氧胞苷实验组和1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组有统计学差异(P<0.05,表2、图1)。

表2 HT-29和LoVo细胞株中MLH-1基因mRNA表达状况

2.3 结直肠癌细胞株HT-29和LoVo中MLH-1蛋白表达状况 Western blot结果运用Image J软件进行条带图像分析,获得HT-29和LoVo细胞株各条带光密度值,并计算出两种细胞在各组中的平均光密度比值,进行半定量分析及统计学分析,并以各实验分组为横坐标,将测出相应的平均光密度比值为纵坐标绘出柱状图后发现0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷作用后,HT-29细胞株中MLH-1蛋白表达水平较对照组上调,并且呈时间、药物浓度依赖性(F=225.142,P=0.000),与对照组DMSO组比较0.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组、1.0 μmol/L5′-氮杂-2′-脱氧胞苷实验组和1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组有统计学差异(P<0.05);LoVo细胞株中MLH-1蛋白表达水平较对照组上调,并且也呈时间、药物浓度依赖性(F=75.807,P=0.000),与对照组DMSO组比较1.0 μmol/L 5′-氮杂-2′-脱氧胞苷实验组和1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组有统计学差异(P<0.05,表3、图2)。

A:DMSO对照组、0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组(左→右)中HT-29细胞株MLH-1蛋白Westernblot条带图;B:DMSO对照组、0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组中HT-29细胞株MLH-1蛋白柱状图;C:DMSO对照组、0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组(左→右)中LoVo细胞株MLH-1蛋白Westernblot条带图;D:DMSO对照组、0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组中LoVo细胞株MLH-1蛋白柱状图
3 讨论
CRC是最常见的消化道恶性肿瘤之一,每年全球新发病例达123万,病死率约为发病率的1/2。我国CRC发病率虽低于西方发达国家,但近20年来CRC的发病率仍在逐渐上升,同时,其发病年龄有增高趋势。近年研究表明CRC的发病是多因素、多阶段、多基因连续累积发生的过程,除遗传学改变外,表观遗传学改变亦参与CRC的发生、发展过程。表观遗传学是指不涉及DNA序列改变,但基因表达却发生可遗传的改变,DNA甲基化、组蛋白修饰、MicroRNA等是表观遗传学的主要形式。与肿瘤发生关系最密切的是DNA甲基化修饰异常,其中包括基因组去甲基化及部分区域高度甲基化两种形式。DNA甲基化可以导致癌相关基因沉默,病变迅速进展为癌。CRC有若干高度甲基化基因,若能认识CRC中基因异常DNA甲基化,将可能获得CRC诊断的肿瘤标记物及新的治疗靶点[8-10]。

表3 HT-29和LoVo细胞株中MLH-1蛋白表达状况
本实验研究中我们采用去甲基化药物5′-氮杂-2′-脱氧胞苷处理两个结直肠癌细胞株:MSS细胞株HT-29和MSI细胞株LoVo后通过实时荧光定量PCR检测结果显示DNA水平上DMSO溶剂对照组、0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组中HT-29和LoVo细胞株中MLH-1基因甲基化状态分别都为甲基化、甲基化、未甲基化和未甲基化,表明去甲基化药物5′-氮杂-2′-脱氧胞苷能够逆转MLH-1基因甲基化状态。mRNA水平研究结果发现在应用0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷作用后,HT-29细胞株中MLH-1基因的mRNA表达水平较对照组上调,并且呈时间、药物浓度依赖性,与对照组DMSO组比较1.0 μmol/L和1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组有统计学差异;同样,LoVo细胞株中MLH-1基因的mRNA表达水平较对照组也上调,并且也呈时间、药物浓度依赖性,与对照组DMSO组比较1.0 μmol/L和1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组有统计学差异;最后通过Western blot检测结果发现在应用0.5、1.0、1.5 μmol/L 5′-氮杂-2′-脱氧胞苷作用HT-29和LoVo细胞株后,MLH-1蛋白表达水平均较对照组表达上调,并且均呈时间、药物浓度依赖性,进一步分析显示与对照组DMSO组比较,0.5 μmol/L、1.0 μmol/L 5′-氮杂-2′-脱氧胞苷和1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组有统计学差异;LoVo细胞株中1.0 μmol/L和1.5 μmol/L 5′-氮杂-2′-脱氧胞苷实验组有统计学差异。
本实验研究显示甲基化酶抑制剂5′-氮杂-2′-脱氧胞苷可通过启动子甲基化而失活的MLH-1基因的异常甲基化状态得到逆转,而使该抑癌基因恢复其转录活性,以使该基因在肿瘤的发生发展中发挥可能的抑制肿瘤的作用。肿瘤的发生发展涉及多种途径和多种基因的改变,其中表观遗传学的变化逐渐受到医学研究的重视。异常甲基化是表观遗传学研究的一个重要内容,往往是导致抑癌基因失活的主要原因。我们希望能通过对异常甲基化的进一步研究,来寻求结直肠肿瘤诊断的新标记物和治疗的新靶点。
【参考文献】
[1] SIEGEL R,MA J,ZOU Z,etal.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2] DAVIS T W,WILSON-VAN P C,MEYERS M,etal.Defective expression of the DNA mismatch repair protein,MLH1,alters G2-M cell cycle checkpoint arrest following ionizing radiation[J].Cancer Res,1998,58(4):767-778.
[3] PELTOMAKI P.Deficient DNA mismatch repair:a common etiologic factor for colon cancer[J].Hum Mol Genet,2001,10(7):735-740.
[4] CUNNINGHAM J M,CHRISTENSEN E R,TESTER D J,etal.Hypermethylation of the hMLH1 promoter in colon cancer with microsatellite instability[J].Cancer Res,1998,58(15):3455-3460.
[5] 王琳,王鲁平.结直肠纤维绒毛锯齿状腺瘤临床病理学及免疫组织化学的观察[J].中华肿瘤防治杂志,2011(12):905-909.
[6] OGINO S,KAWASAKI T,BRAHMANDAM M,etal.Precision and performance characteristics of bisulfite conversion and real-time PCR (MethyLight) for quantitative DNA methylation analysis[J].J Mol Diagn,2006,8(2):209-217.
[7] CAMPBELL D J,KOCH M A.Phenotypical and functional specialization of FOXP3+ regulatory T cells[J].Nat Rev Immunol,2011,11(2):119-130.
[8] SNOVER D C.Update on the serrated pathway to colorectal carcinoma[J].Hum Pathol,2011,42(1):1-10.
[9] DHIR M,YACHIDA S,VAN NESTE L,etal.Sessile serrated adenomas and classical adenomas:an epigenetic perspective on premalignant neoplastic lesions of the gastrointestinal tract[J].Int J Cancer,2011,129(8):1889-1898.
[10] ARBER N,SHAPIRA I,RATAN J,etal.Activation of c-K-ras mutations in human gastrointestinal tumors[J].Gastroenterology,2000,118(6):1045-1050.

