PPAR-γ激动剂吡咯列酮对卵蛋白激发气道变应性炎症的调节作用
方 萍,吴晓明,李满祥,史红阳,张永红,卢佳美
(西安交通大学:1. 医学院第二附属医院呼吸内科,陕西西安 710004;2. 生命科学学院,陕西西安 710049)
支气管哮喘是气道慢性炎症性疾病,气道高反应性和可逆性气流阻塞是其主要临床特征。哮喘患者的气道炎症具有多种炎性细胞浸润,其中以嗜酸粒细胞、肥大细胞为主。上述炎症细胞激活将会导致一系列前炎症介质和细胞因子释放,继而诱发气道高反应性、基质血管通透性增加、炎症细胞募集以及黏液高分泌。
过氧化物酶增殖激活受体(peroxisome proliferator-activated receptor-γ, PPAR)是核激素受体超家族成员之一,广泛存在于机体的各个器官和组织。目前依据编码基因的不同,主要分为3个亚型,PPAR-α、PPAR-β以及PPAR-γ。其中PPAR-γ的激活可下调介导炎症反应的多种细胞因子。在肺组织中主要表达于气道上皮细胞、平滑肌细胞、肌成纤维细胞、肺血管内皮细胞以及部分炎症细胞,例如巨噬细胞、中性粒细胞、嗜酸粒细胞、淋巴细胞以及肥大细胞[1]。既往研究提示,PPAR-γ可能参与了气道炎症的调节过程,哮喘患者的气道黏膜下组织、气道上皮细胞和平滑肌细胞PPAR-γ表达也较健康人有所增加,已有假说提出哮喘患者PPAR-γ表达增高预示着机体可能存在某种自身调节机制[2-4]。这预示PPAR-γ激动剂在防治哮喘气道变应性炎症反应方面具有一定应用前景。
本研究将采用卵蛋白(OVA)激发制备气道变应性炎症反应模型,在此基础上给予PPARγ激动剂吡格列酮(PGZ)干预,探讨其潜在的调节作用及机制。
1材料与方法
1.1动物和试剂SPF级Balb/c小鼠42只,雌性,7周龄,体重(18±2)g,购于西安交通大学医学院实验动物中心。
鸡卵清蛋白(OVA,Ⅴ级)购于Sigma-Aldrich 公司。PGZ购于日本武田制药公司。白细胞介素4(IL-4)、白细胞介素13(IL-13)、γ干扰素(IFN-γ)、白细胞介素17A(IL-17A)、嗜酸粒细胞趋化因子(eotaxin)以及巨噬细胞趋化因子-1(MCP-1)的酶联免疫吸附反应检测(ELISA)试剂盒购于美国R&D公司。血清总IgE、IgG1、IgG2a和OVA特异性IgE、IgG1、IgG2a检测试剂购自美国BD公司,OVA特异性IgE、IgG1、IgG2a检测均采用OVA包被的ELISA专用96孔板。
1.2实验分组将小鼠随机分3组,PBS对照组(A组)、哮喘模型组(B组)、PGZ干预组(C组)。
分别于第0天和第7天采用200 μL含有100 μg OVA和2 mg氢氧化铝的PBS溶液腹腔注射致敏,第14、15、16天采用2.5 g/L OVA 20 μL 经鼻给药进行攻击。干预组于第12天至第17天开始给予PGZ 200 μL(10 mg/kg)灌胃。对照组均使用PBS溶液。于最后1次攻击48 h后处死动物,取血、肺泡灌洗液(BAL)及肺组织待测。
1.3有创方法检测哮喘小鼠气道反应性采用FlexiVent(美国)有创肺功能仪检测小鼠肺功能。在最后1次攻击24 h后,行腹腔注射麻醉,行气管插管有创机械通气。采用浓度梯度的乙酰甲胆碱溶液雾化,测定给药前后小鼠肺阻力和气道阻力的变化情况。
1.4血清、BAL收集及细胞分类计数每只小鼠心脏取血约0.7 mL,4 ℃放置过夜,8 000 r/min离心15 min,血清移至另一干净Eppendorf管,-20 ℃保存待测。心脏取血后立即行气管插管支气管肺泡灌洗,分2次缓慢注入PBS液,每次1.0 mL,缓慢收集,回收率约为80%。将回收的BAL 4 000 r/min离心10 min,收集上清液-20 ℃保存待测。细胞沉渣用0.2 mL PBS液重悬,取100 μL细胞悬液进行离心甩片,室温晾干后进行Diff-quick染色,光学显微镜下进行细胞分类计数,数200个细胞,计算BAL中各类白细胞百分比。另取10 μL细胞悬液进行锥虫蓝(台盼蓝)染色,采用血细胞计数板进行细胞计数。
1.5支气管肺组织病理学检查取小鼠支气管肺组织用100 mL/L甲醛固定。HE染色观察气道炎症细胞浸润。分别由2位研究者采用半定量评分法(0~3)评价支气管周围炎症细胞的浸润情况。
1.6血清免疫球蛋白的测定检测血清总IgE和OVA特异性IgE时,血清标本分别做1∶2和1∶100倍稀释;检测血清总IgG1和OVA特异性IgG1时,血清标本分别做1∶10 000和1∶50 000稀释;检测血清总IgG2a和OVA特异性IgG2a时,血清标本分别做1∶1 000和1∶100稀释。分别用IgE、IgG1、IgG2a捕获抗体或OVA抗原包被酶标板4 ℃过夜孵育,洗板3次,30 mL/L小牛血清(BSA)室温封闭1 h,加入待测样品室温孵育2 h,洗板3次后加入抗小鼠IgE、IgG1、IgG2a的二抗室温孵育1 h,洗板6次,再加入辣根过氧化物酶(HRP)室温孵育1 h。洗板7次后加入TMB底物显色液,室温避光孵育30 min,最后加入终止液。30 min内采用紫外分光光度计在450 nm处检测吸光度A值,根据标准曲线计算待测样品浓度。总IgE和OVA特异性IgE检测时,HRP与二抗同时加入,室温避光共育1 h。
1.7BAL中细胞因子及化学因子的测定细胞因子及化学因子测定按照ELISA试剂盒说明书进行。依次进行捕获抗体包被、BSA封闭,标准品及待测样品上样,室温孵育2 h,洗板后加入二抗100 μL,室温孵育2 h,洗板5次后加入100 μL HRP室温孵育20 min,洗板7次,再加入底物工作液TMB 100 μL,室温避光反应20 min;加入100 μL终止液终止反应。在450 nm读取A值,绘制出A450 nm对应细胞因子浓度标准曲线,根据待测样品A450 nm值,计算出样品中待测指标浓度。
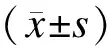
2结果
2.1PGZ抑制OVA激发哮喘小鼠气道高反应性PGZ干预组小鼠气道阻力、肺阻力在较高浓度乙酰甲胆碱雾化吸入下较哮喘模型组有所降低(P<0.05),肺顺应性较相同条件下模型组未见明显变化(P>0.05,图1)。
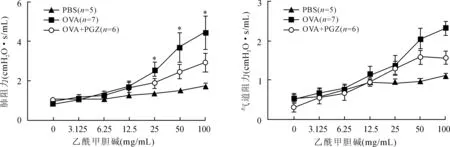
图1 PGZ对哮喘小鼠气道高反应性的影响
2.2PGZ抑制OVA激发哮喘小鼠BAL炎症细胞的增殖哮喘模型组小鼠出现了典型的哮喘特征,BAL中炎症细胞总数及嗜酸性粒细胞百分比明显增加(P<0.01)。PGZ干预组小鼠BAL细胞总数及嗜酸性粒细胞百分比较对照组有不同程度的增加,但其增加幅度均低于哮喘模型组(P<0.05,图2)。
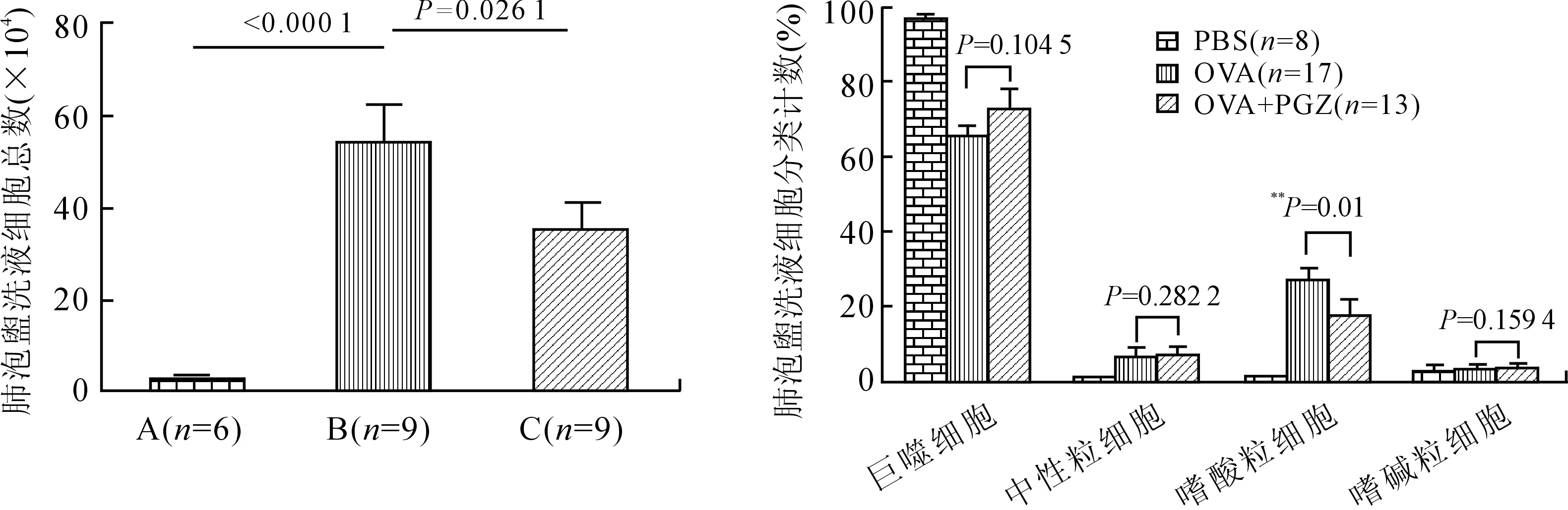
图2 PGZ对哮喘小鼠BAL细胞总数及白细胞分类计数的影响
2.3PGZ对OVA激发哮喘小鼠血清免疫球蛋白的影响哮喘模型组及PGZ干预组小鼠血清T-IgE、T-IgG1及s-IgE、sIgG1、s-IgG2a较PBS对照组均明显升高(P<0.01),而血清T-IgG2a与对照组比较未见明显变化。但PGZ干预组小鼠血清免疫球蛋白T-IgE、T-IgG1及s-IgE、sIgG1、s-IgG2a升高幅度与哮喘模型组小鼠比较未见明显差异(P>0.05,图3)。

图3 PGZ对哮喘小鼠血清免疫球蛋白的影响
2.4PGZ对OVA激发哮喘小鼠BAL中Th亚型细胞因子及化学因子的影响PGZ干预组哮喘小鼠BAL中细胞因子及化学因子IL-4、IL-13、eotaxin、IFN-γ、IL-17A均较对照组明显升高(P<0.01),但升高幅度低于哮喘模型组(P<0.05),MCP-1两组比较未见明显差异(P>0.05,图4)。
2.5PGZ对OVA激发哮喘小鼠支气管肺组织病理的影响支气管肺组织病理学检查提示,PGZ可部分抑制哮喘模型组小鼠气道炎症反应,PGZ干预组小鼠气道炎症细胞浸润程度介于对照组和哮喘模型组之间(P<0.05,图5)。

图5 PGZ对哮喘小鼠气道炎性细胞浸润的影响
3讨论
已有很多研究表明,PPAR-γ激动剂作为PPAR-γ受体的配体在许多炎症性疾病如变应性鼻炎、银屑病、心血管疾病、慢性阻塞性肺疾病中发挥着抗炎作用;但也有部分研究认为PPAR-γ激动剂在某些情况下具有促炎作用。因此,有关PPAR-γ激动剂对气道变应性炎症反应的作用及机制研究尚存在争议[5-7]。本研究采用经典的OVA激发方法制备哮喘气道变应性炎症反应模型,并分别从组织、细胞及分子水平验证模型的可靠,并给予PGZ干预,结果显示,PGZ可抑制气道高反应性和嗜酸粒细胞炎症。但血清中代表Th2免疫反应的特异性IgE和IgG1未受到明显影响。而BAL中代表Th2免疫反应的细胞因子IL-4、IL13以及化学因子eotaxin以及代表Th17反应的细胞因子IL-17A受到不同程度抑制,其中以IL-13为著。这种改变与BAL中细胞总数、嗜酸粒细胞百分比以及细胞因子、化学因子改变相平行。PGZ是噻唑烷二酮类抗糖尿病药物,它可激动PPAR-γ受体发挥相应的生物学效应。上述结果提示,PPARγ激动剂对气道变应性炎症具有一定的抑制作用。
PPARγ受体广泛表达于机体的各类组织器官与细胞,具有广泛的生物学作用。已有研究表明,它在上皮细胞、巨噬细胞、树突状细胞等多种组织细胞和免疫细胞均有表达,生物学作用涉及呼吸、消化、泌尿等多个系统[1]。我们的研究进一步验证了PPARγ激动剂在抑制Th2免疫反应的同时,对Th17免疫反应也有部分抑制作用,后者是近年备受关注的Th免疫反应的新亚型。这与PARK等[8]的研究结果一致。然而与之研究不同的是,我们的实验体系中并未发现PPARγ激动剂PGZ能够明显抑制血清免疫球蛋白IgE、IgG1的产生,分析原因可能与我们采用的ELISA检测方法的敏感性有关,但不能完全除外PPARγ激动剂PGZ主要影响T淋巴细胞和气道上皮细胞介导的免疫反应的可能,而对B淋巴细胞介导的体液免疫反应影响较为微弱。由此提示,在气道变应性炎症反应体系中,PPARγ激动剂可能主要通过抑制T细胞增殖和分化以及上皮细胞分泌发挥抗炎效应的,并且以局部作用为主,但其深入的细胞分子机制仍需进一步探讨,可能与抑制炎症反应因子NF-κB有关,有学者提出调节性T细胞介导了该作用[9-10]。
综上,PPARγ激动剂最早因其对脂代谢的调节作用被广泛应用于糖尿病的治疗,近年因其广泛抗炎作用的特点而倍受关注[11]。目前已有新一代副作用更小的PPARγ激动剂如KR62980、15d-PGJ2逐渐进入临床前研究阶段,它们具有相似的临床疗效和更小的副作用[12-13]。相信在不久的将来,这些新型的PPARγ激动剂将会在哮喘气道变应性炎症防治方面发挥重要作用。
参考文献:
[1] RYU SL, SHIM JW, KIM DS, et al. Expression of peroxisome proliferator-activated receptor (PPAR)-α and PPAR-γ in the lung tissue of obese mice and the effect of rosiglitazone on proinflammatory cytokine expressions in the lung tissue[J]. Korean J Pediatr, 2013, 56(4): 151-158.
[2] LEA S, PLUMB J, METCALFE H,et al. The effect of PPAR-γ ligands oninvitroandinvivomodels of COPD[J]. Eur Respir J, 2013, 21.
[3] PARK SJ, LEE YC. Peroxisome proliferator-activated receptor gamma as a novel therapeutic target in asthma[J]. J Asthma, 2008, 45(1):1-8.
[4] WANG W, ZHU Z, ZHU B, et al. Pioglitazone attenuates allergic inflammation and induces production of regulatory T lymphocytes[J]. Am J Rhinol Allergy, 2010, 24(6):454-458.
[5] ZOU C, QI H, LIU ZH, et al. Simvastatin activates the PPARγ-dependent pathway to prevent left ventricular hypertrophy associated with inhibition of RhoA signaling[J]. Tex Heart Inst J, 2013, 40(2):140-147.
[6] WANG W, ZHU Z, ZHU B, et al. Peroxisome proliferator-activated receptor-gamma agonist induces regulatory T cells in a murine model of allergic rhinitis[J]. Otolaryngol Head Neck Surg, 2011, 144(4):506-13.
[7] JY L, OLIVER BG, MOIR LM, et al. Differential expression of peroxisome proliferator activated receptor gamma and cyclin D1 does not affect proliferation of asthma- and non-asthma-derived airway smooth muscle cells[J]. Respirology, 2010,15(2):303-312.
[8] PARK SJ, LEE KS, KIM SR, et al. Peroxisome proliferator-activated receptor gamma agonist down-regulates IL-17 expression in a murine model of allergic airway inflammation[J]. J Immunol, 2009, 183(5):3259-3267.
[9] HASEGAWA-MORIYAMA M, KURIMOTO T, NAKAMA M, et al. Peroxisome proliferator-activated receptor-gamma agonist rosiglitazone attenuates inflammatory pain through the induction of heme oxygenase-1 in macrophages[J]. Pain, 2013, 154(8):1402-1412.
[10] WANG W, ZHU Z, ZHU B, et al. Pioglitazone attenuates allergic inflammation and induces production of regulatory T lymphocytes[J]. Am J Rhinol Allergy, 2010, 24(6):454-458.
[11] ROYCE SG, TANG ML. The effects of current therapies on airway remodeling in asthma and new possibilities for treatment and prevention[J]. Curr Mol Pharmacol, 2009, 2(2):169-181.
[12] FARNESI-DE-ASSUNÇO TS, ALVES CF, CARREGARO V, et al. PPAR-γ agonists, mainly 15d-PGJ(2), reduce eosinophil recruitment following allergen challenge[J]. Cell Immunol, 2012, 273(1):23-29.
[13] WON HY, MIN HJ, AHN JH, et al. Anti-allergic function and regulatory mechanisms of KR62980 in allergen-induced airway inflammation[J]. Biochem Pharmacol, 2010, 79(6):888-896.

