高表达FGFR4细胞株的建立及其生物活性分析
黄 静,安红丽,张 涛
(西安交通大学医学院:1. 药物研究所;2. 第一附属医院转化医学中心,陕西西安 710061)
成纤维细胞生长因子受体4(fibroblast growth factor receptor 4, FGFR4)属于FGFR家族成之一,其结构包括细胞外免疫球蛋白结构域、疏水跨膜区和细胞质含有酪氨酸激酶结构域。FGFR4有广泛的生物学功能,具有调节细胞增殖、存活、迁移和分化的能力[1-7],FGFR4信号通路的激活在肿瘤发生、发展中具有重要作用[8-9]。例如,肿瘤转移、血管生成和抗凋亡均有重要作用[10-12]。最近报道FGFR4在MDA-MB-453细胞中高表达有助于细胞耐药性的出现[13]。因此,构建高表达的FGFR4细胞,建立受体特异的细胞模型,不仅有助于研究FGFR4的生物学功能,也为以FGFR4为抗肿瘤药物筛选靶标提供了体外筛选的模型。在本实验中,以稳定的条件选择构建高表达FGFR4细胞,然后研究HEK293/FGFR4细胞周期和HEK293/pcDNA细胞以解释抑制细胞的增殖。此外,检测与增殖相关的信号通路蛋白,如ERK和p-ERK。我们用HEK293细胞系来确定FGFR4的生物学效应,表明FGFR4是细胞增殖的重要受体之一。
1材料与方法
1.1主要材料和试剂FGFR4(sc-124)和β-actin(sc-10731)购自Santa Cruz。ERK1/2(#9102)和磷酸化ERK1/2(#4370)购自Cell Signal公司,辣根过氧化物酶标记的小鼠IgG购自ZSBio公司,兔IgG购自Jackson ImmunoResearch公司,PI(碘化丙啶)、DMSO(二甲亚砜)、MTT[3-(4,5-二甲基吡啶-2-基)-2,5-二苯基溴化]均购自Sigma。
1.2引物设计和PCR产物扩增FGFR4基因扩增片段引物设计及扩增pOTB7/FGFR4质粒(Open Biosystem公司Huntsville, USA)含有FGFR4基因全序列,应用PCR技术对FGFR4基因进行扩增。FGFR4引物序列:正向引物5′-AGTAAGCTTATGCGGCTGCTGCTGGCCCT-3′,引入HindⅢ识别序列;反向引物5′-GATCTCGAGTCATGTCTGCACCCCAGACC-3′,引入XhoⅠ识别序列。PCR 反应体系:pOTB7/FGFR4 1 μg,FGFR4-f 0.2 μmol/L,FGFR4-r 0.2 μmol/L,dNTP 25 mmol/L,10×LA PCR Buffer 2.5 μL,LATaq2U,加入去离子水至总体积25 μL。扩增反应条件:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃ 延伸90 s,30个循环,72 ℃总延伸10 min。扩增产物进行琼脂糖凝胶电泳并纯化(参照胶回收试剂盒,Omega)。
1.3重组质粒的构建使用HindⅢ和XhoⅠ将FGFR4的PCR片段及表达载体pcDNA3.1(+)双酶切。酶切反应体系:FGFR4-pcDNA3.1(+)1 μg,10×K Buffer 2 μL,HindⅢ 15 U,XhoⅠ 15 U,ddH2O补至20 μL,37 ℃反应4 h。
将酶切后的产物用胶回收试剂盒进行回收得到目的基因和载体片段。用T4 DNA Ligase将FGFR4基因及载体片段酶切产物进行连接。连接反应体系:10×T4 DNA Ligase Buffer 1 μL,T4 DNA Ligase 1 U,pcDNA3.1(+)30 ng,FGFR4 100 ng, ddH2O补至10 μL,4 ℃过夜连接。
连接产物转化至感受态细胞E.coliDH5α(全式金,北京)。吸取100 μL感受态细胞转移到无菌离心管中,加入连接产物10 μL,轻弹混匀,冰中放置30 min,移至42 ℃恒温水浴中,放置90 s,快速冰浴使细胞冷却3 min,加入800 μL LB培养基,37 ℃恒温摇床,低速培养1 h复苏细菌,以800 r/min离心3 min,弃去800 μL上清液,将沉淀重悬后转移至含Ampr抗性的LB固体培养基上,三角玻璃棒将菌液涂匀。倒置平皿,37 ℃培养12~16 h。
1.4重组质粒FGFR4-pcDNA3.1(+)的提取和鉴定挑取单克隆菌落,溶于含Ampr的LB培养基的玻璃试管中,37 ℃恒温摇床过夜。提取质粒(按试剂盒步骤操作,天根),进行HindⅢ和XhoⅠ双酶切鉴定(酶切体系同1.3)。将酶切鉴定正确的质粒送杭州金斯瑞测序,对FGFR4基因序列进行验证。选择无碱基突变、缺失质粒进行下一步实验。
1.5细胞系的细胞培养、转染和稳定筛选Huh7细胞系作为FGFR4阳性对照,MDA-MB-231和MCF-7细胞系作为阴性对照。所有的细胞系在含有DMEM(Invitrogen公司)和100 mL/L FBS(类标准胎牛血清,兰州民海)、100 U/mL的青霉素G钠、100 μg/mL的硫酸链霉素的培养基中培养。应用脂质体法(LipofectamineTM2000,Invitrogen公司)将重组质粒转染HEK293细胞。过程如下:①2 μg质粒稀释于200 μL的Opti-MEM®I培养基中,室温下孵育10 min。在同一时间,7 μL的LipofectamineTM2000加入200 μL的Opti-MEM®I培养基中混匀,静置10 min。②将稀释的DNA与稀释的脂质体轻轻混合,并在室温下孵育20 min。③将DNA-脂质体均匀滴加至无抗生素的DMEM完全培养基中混匀,在CO2培养箱中孵育4~6 h,换新鲜DMEM完全培养基继续培养48 h。④将转染的HEK293细胞移入10 cm培养皿,加入含有G418(800 μg/mL)的培养基,培养3周,隔天换液,得到单克隆抗性细胞集落。⑤在含有G418(300 μg/mL)培养基中将阳性细胞克隆扩大培养、冻存、保种。
1.6细胞免疫荧光染色法我们通过细胞免疫荧光染色观察FGFR4蛋白的定位。①将筛选得到的HEK293-FGFR4和HEK293-pcDNA细胞铺板在无菌玻璃片上,培养48 h后,弃去培养基并加入40 mg/mL多聚甲醛固定15 min,用10 μL/mL Triton X-100处理3 min。②50 mg/mL BSA室温封闭细胞爬片2 h。③FGFR4(1∶100,Santa Cruz)在室温下孵育4 h,PBST洗3次,每次5 min。④将cy3标记山羊抗兔抗体(Jackson ImmunoResearch 1∶200)在室温下孵育1 h,PBST洗3次,每次5 min,DAPI(4′,6-二脒基-2-苯基吲哚0.1 μg/mL)0.1 μg/mL室温避光孵育15 min染色,荧光显微镜(Nikon Ti-u,Tokyo,Japan)观察、分析FGFR4的定位及表达。
1.8细胞周期分布分析HEK293-FGFR4和HEK293-pcDNA细胞接种到6孔板中,在DMEM完全培养基中过夜培养。当细胞汇合度达90%,胰蛋白酶消化细胞,PBS洗涤2次,750 mL/L的乙醇4 ℃固定30 min,PBS洗涤后用100 μg/mL RNAase A和碘化丙啶(PI,40 μg/mL)37 ℃孵育30 min,流式细胞仪(Becton Dickinason)分析细胞周期。
1.9蛋白样品制备和免疫印迹分析总细胞裂解物在RIPA缓冲液中[0.1 mL/mL Triton X-100、1 g/mL Na deoxychlolate、1 mg/mL SDS、150 mmol/L NaCl、10 mmol/L Tris-HCl(pH 7.4)和5 mmol/L EDTA]含有PMSF 200 μmol/L和磷酸酶抑制剂,在冰上孵育30 min,超声裂解未溶解蛋白,4 ℃、12 000 r/min离心10 min,收集蛋白上清液加入5×sample buffer,沸水浴10 min。取常规方法进行SDS-PAGE电泳及转膜,0.05 g/mL的脱脂奶粉封闭,一抗为phospho-ERK1/2(Thr202/Tyr204)(1∶1 000)、ERK1/2的抗体(1∶2 000)、FGFR4(1∶2 000)、β-actin(1∶2 000)。二抗为辣根过氧化物酶标记的小鼠IgG(1∶10 000)或兔IgG(1∶20 000),ECL发光检测。
2 结 果
2.1FGFR4的表达和定位选择FGFR4高表达细胞系Huh7,MDA-MB-231和MCF-7细胞系作为阴性对照。FGFR4蛋白在HEK293-FGFR4细胞中表达,且表达量明显高于阴性对照细胞组(图1)。同时,免疫荧光分析了HEK293-FGFR4和HEK293-pcDNA3.1细胞中的FGFR4定位(图2)。HEK293-FGFR4细胞的细胞膜的荧光强度比HEK293-pcDNA3.1细胞的亮度高,这表明FGFR4在HEK293-FGFR4细胞系中的表达高于在HEK293-pcDNA细胞系中的表达。FGFR4蛋白主要在细胞质及细胞膜上表达。

图1 免疫印迹分析FGFR4的表达量
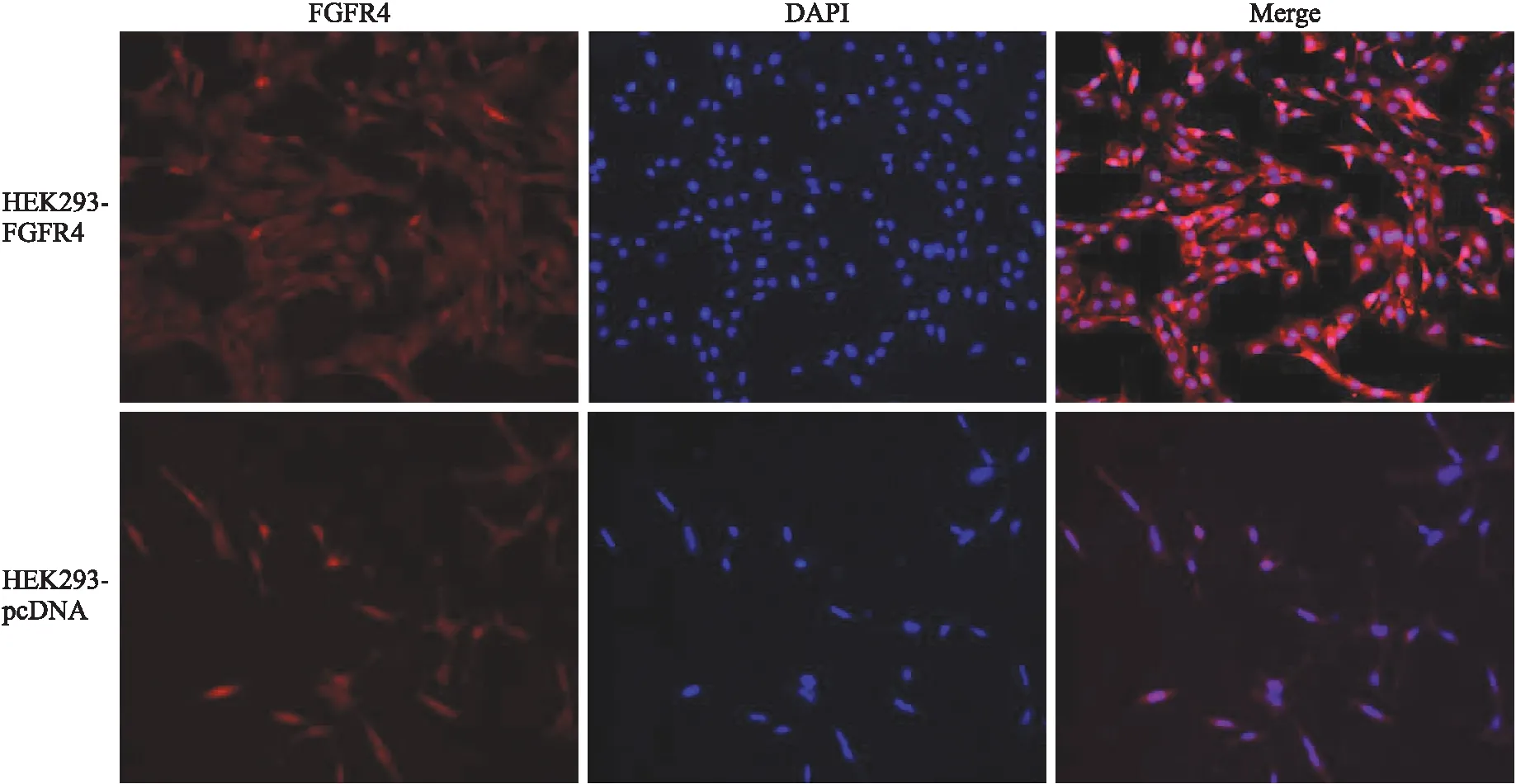
图2 免疫荧光分析FGFR4蛋白表达定位
2.2FGFR4对细胞增殖的影响在完全相同的培养条件下,HEK293-FGFR4细胞比HEK293-pcDNA细胞的增殖速度快。从第3天到第7天来看,HEK293-FGFR4细胞的增殖速度高于HEK293-pcDNA细胞,表明FGFR4能够促进细胞增殖(图3)。
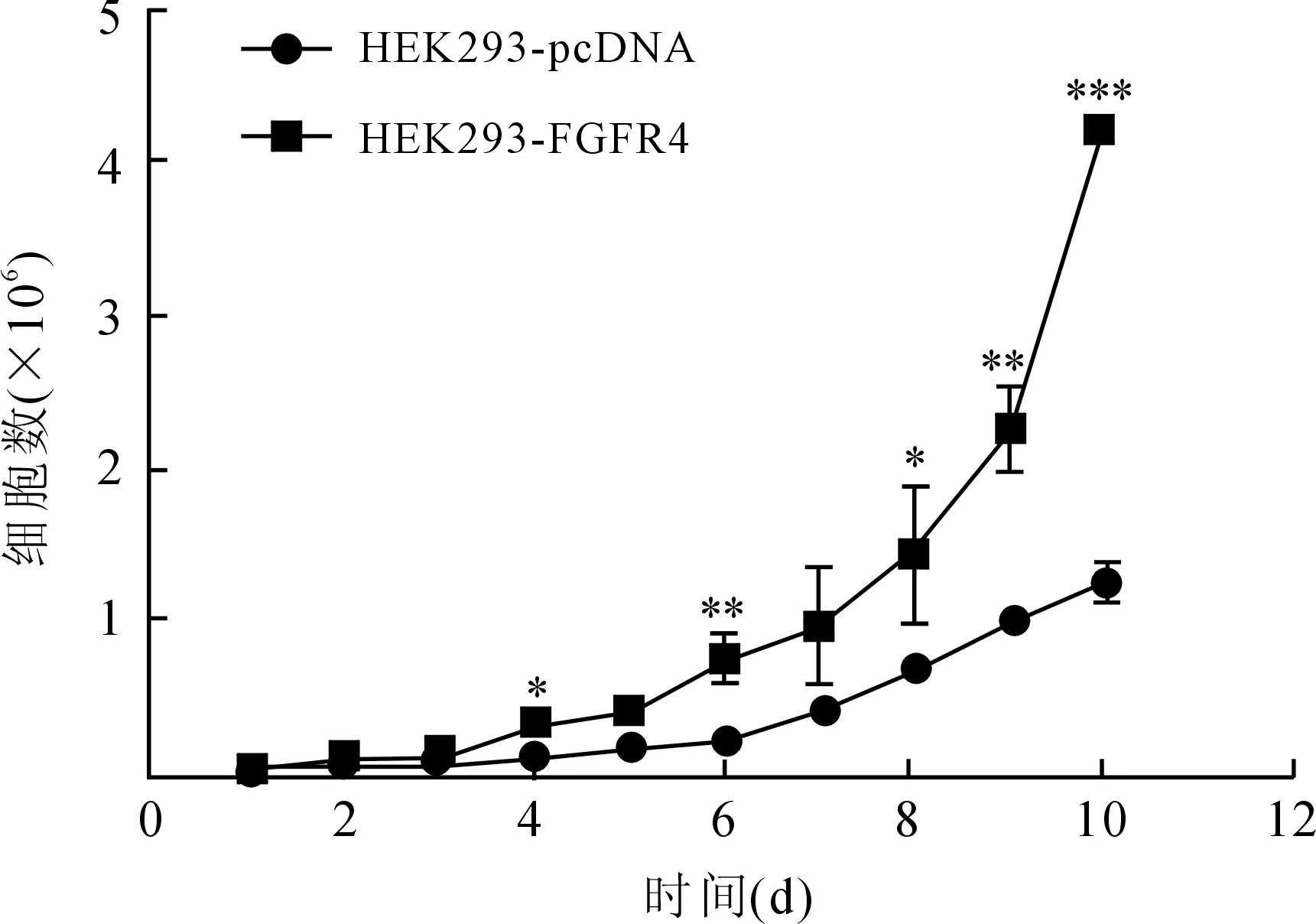
图3 细胞计数实验检测FGFR4对细胞增殖的影响
2.3FGFR4对细胞生长周期的影响建立流式细胞仪分析方法来检测FGFR4的增殖影响。我们取相同培养条件下HEK293-FGFR4和HEK293-pcDNA细胞进行周期分析,发现HEK293-FGFR4细胞G0/G1比例为56.78%,低于HEK293-pcDNA细胞G0/G1比例44.95% (图4)。证明FGFR4可降低G0/G1期比例,促进细胞增殖[14]。
2.4FGFR4对MAPK信号的影响我们初步分析FGFR4对HEK293细胞增殖影响的分子机制。ERK作为MAPK信号通路中的重要信号分子,其磷酸化导致MAPK信号通路激活,刺激靶细胞增殖。因此,通过对HEK293-FGFR4和HEK293-pcDNA细胞的p-ERK信号蛋白分析(图5),发现HEK293-FGFR4 ERK蛋白磷酸化水平高于HEK293-pcDNA细胞。这些结果与以前在肿瘤细胞中的研究结果一致[15],表明FGFR4能够提高磷酸化ERK1/2信号蛋白水平,引起MAPK通路的激活。

图4 FGFR4对HEK293细胞周期的影响

图5 Western blot分析FGFR4对MAPK信号通路的影响
3讨论
高表达的FGFRs经常发生在人类的癌细胞中,并且与预后不良相关。在本研究中,我们构建了包含FGFR4全基因的真核表达载体,并通过抗性筛选得到了高表达FGFR4蛋白的细胞株。同时,通过细胞增殖实验、细胞周期分析、免疫印迹、免疫荧光实验对HEK293-FGFR4细胞特性进行了初步研究。结果表明,我们成功构建了高表达FGFR4的重组HEK293细胞株;免疫印记及免疫荧光分析结果表明,FGFR4在细胞膜上表达且表达量高于对照阴性细胞。为了验证FGFR4是否具有生物学活性,进行了细胞增殖实验及细胞周期分析,发现HEK293-FGFR4细胞的增殖速度比HEK293-pcDNA细胞快。细胞周期分析证实FGFR4促进了细胞G0/G1期降低。根据免疫印记结果分析,HEK293-FGFR4细胞中p-ERK1/2的表达水平高于HEK293-pcDNA细胞株,而p-ERK1/2水平的升高被证明有助于细胞增殖[13]。细胞生长周期分布表明FGFR4有助于HEK293细胞中G0/G1期的抑制过程。以前的研究表明乳腺癌细胞中FGFR4能够促进G0/G1向S期的过渡[8]。研究结果表明FGFR4不仅能够促进正常的高表达的肿瘤细胞而且能够促进人工构建的非肿瘤细胞的增殖。
总之,我们成功构建了包含FGFR4基因的真核表达质粒,pcDNA-FGFR4。FGFR4基因在HEK293细胞中可有效地表达,高表达的FGFR4能够通过降低G0/G1期比例和提高p-ERK1/2水平来促进HEK293细胞的增殖。本研究不仅为研究癌症中FGFR4的功能提供了实验模型,同时建立了以FGFR4为靶标的抗肿瘤药物体外筛选模型。
参考文献:
[1] ESWARAKUMAR VP, LAX I, SCHLESSING ER. Cellular signaling by fibroblast growth factor receptors[J]. Cytokine Growth Factor Rev, 2005, 16(2):139-149.
[2] HAN KH, SHARON P, SYLVIA S, et al. Fibroblast growth factor receptor 4 regulates proliferation, anti-apoptosis and alpha-fetoprotein secretion during hepatocellular carcinoma progression and represents a potential target for therapeutic intervention[J]. J Hepatol, 2009, 50(1):118-127.
[3] EZZAT S, ZHENG L, YU SJ,et al. A soluble dominant negative fibroblast growth factor receptor 4 isoform in human MCF-7 breast cancer cells[J]. Biochem Biophys Res Commun, 2001, 287(1):60-65.
[4] WANG J, STOCKTON DW, ITTMANN M. The fibroblast growth factor receptor-4 Arg388 allele is associated with prostate cancer initiation and progression[J]. Clin Cancer Res, 2004, 10(10):6169-6178.
[5] SPINOLA M, LEONI VP, TANUMA J, et al. FGFR4 Gly388Arg polymorphism and prognosis of breast and colorectal cancer[J]. Oncol Rep, 2005, 14(2):415-419.
[6] SAHADEVAN K, DARBY S, LEUNG HY, et al. Selective over-expression of fibroblast growth factor receptors 1 and 4 in clinical prostate cancer [J]. J Pathol, 2007, 213(1):82-90.
[7] YANG Y. Association between fibroblast growth factor receptor 4 polymorphisms and risk of hepatocellular carcinoma[J]. Mol Carcinog, 2012, 51(7):515-521.
[8] KOZICZAK M, HOLBRO T, HYNES NE. Blocking of FGFR signaling inhibits breast cancer cell proliferation through downregulation of D-type cyclins[J]. Oncogene, 2004,23(20):3501-3508.
[9] MEBRATU Y, TESFAIGZI Y. How ERK1/2 activation controls cell proliferation and cell death: Is subcellular localization the answer?[J]. Cell Cycle, 2009, 8(8):1168-1175.
[10] ROIDL A, FOO P, WONG W, et al. The FGFR4 Y367C mutant is a dominant oncogene in MDA-MB453 breast cancer cells[J]. Oncogene, 2010, 29(10):1543-1552.
[11] STADLER CR, KNYAZEV P, BANGE P, et al. FGFR4 GLY388 isotype suppresses motility of MDA-MB-231 breast cancer cells by EDG-2 gene repression[J]. Cell Signal, 2006, 18(6):783-794.
[12] FITZGERALD LM, KARLINS E, KARYADI DM, et al. Association of FGFR4 genetic polymorphisms with prostate cancer risk and prognosis[J]. Prostate Cancer Prostatic Dis, 2009, 12(2):92-97.
[13] ROIDL A, BERGER HJ, KUMAR S, et al. Resistance to chemotherapy is associated with fibroblast growth factor receptor 4 up-regulation[J]. Clin Cancer Res, 2009,15(6):2058-2066.
[14] MARGADANT C, CREMERS L, SONNENBERG A, et al. MAPK uncouples cell cycle progression from cell spreading and cytoskeletal organization in cycling cells[J]. Cell Mol Life Sci, 2013, 70(2):293-307.
[15] TENHAGEN A, DIEST PJ, IVANOVA IA, et al. Fibroblast growth factor receptors in breast cancer: expression, downstream effects, and possible drug targets[J]. Endocr Relat Cancer, 2012, 19(4):115-129.

