Ghrelin对大鼠消化间期胃肠肌电活动的影响及其受体在消化道的分布特征
王 燕,董 蕾,邹百仓,史海涛,姜 炅,宋亚华
(西安交通大学医学院第二附属医院消化内科,陕西西安 710004)
Ghrelin是生长激素促分泌素受体(growth hormone secretagogue receptor, GHS-R)的内源性配体[1],主要由胃黏膜组织中的泌酸细胞分泌,在胃肠道和中枢神经系统均有分布。Ghrelin与调节消化道运动的激素胃动素在结构上具有高度相似性,其受体GHS-R与胃动素受体也有同源性,又被称为胃动素相关肽[2]。由于胃动素和消化道运动关系密切,可促进胃肠消化间期移行性复合肌电活动(migrating myoelectrical complex, IMC),加速小肠转运,ghrelin与消化道运动的关系也开始受到关注。以往研究证实ghrelin及其受体GHS-R在中枢和外周都有表达。BRON等[3]通过原位杂交等方法证实GHS-R存在于大鼠的下丘脑、延髓、心脏、胃肠道等处,DASS和XU等[4-6]利用荧光免疫组织化学方法在人、大鼠和豚鼠的胃和结肠也发现ghrelin及其受体。然而,关于GHS-R在完整消化道(包括胃、十二指肠、空肠、回肠、盲肠、近端结肠和远端结肠)的免疫组织化学研究以及表达量的比较尚未见报道。以往研究发现,ghrelin可加速胃排空,改善术后肠梗阻,促进胃和十二指肠IMC[7-10]。但是,关于ghrelin对胃肠IMC的作用及确切机制尚不清楚。本研究采用免疫组织化学及图像分析方法观察大鼠消化道GHS-R的分布特征和表达量的变化,探讨ghrelin对禁食大鼠IMC的影响及其与胃动素的关系,为阐明ghrelin的促胃肠动力作用提供理论依据,为治疗胃肠运动障碍性疾病提供新思路。
1材料与方法
1.1实验动物健康纯种Sprague-Dawley大鼠,雌雄不拘,体质量220~240 g,由西安交通大学医学院实验动物中心提供。
1.2仪器和试剂Ghrelin由美国凤凰肽公司提供;兔抗人GHS-R抗体由美国Santa Cruz公司提供;胃动素放免试剂盒由中国人民解放军总医院科技开发中心放免所提供;聚四氟乙烯薄膜包绕的AF-250A医用线缆由上海信息产业部电子第23研究所特种线缆部提供;多道生理记录仪RM-6280C由成都仪器厂提供。
1.3GHS-R在大鼠消化道的分布特征①组织制备。大鼠每组8只,给予100 g/L水合氯醛(3 mL/kg)腹腔注射麻醉,经左心室穿刺至主动脉,用生理盐水快速冲血管,用40 g/L多聚甲醛缓冲液经升主动脉灌注。分别剪取胃、十二指肠、空肠、回肠、盲肠、近端结肠和远端结肠,经多聚甲醛缓冲液后固定8 h,20~30 g/L蔗糖溶液梯度脱水,液氮速冻后,组织包埋剂包埋,恒冷冰冻切片机切片。②免疫组织化学染色。用SABC法进行GHS-R的免疫组化染色。用0.01 mol/L PBS代替第一抗体做阴性对照。用Q550CW图像采集与分析系统对各组织的灰度值进行统计分析。③实验结果的观察。神经细胞胞质呈棕黄色染色者为阳性细胞。消化道阳性细胞多成簇分布在肠肌丛和黏膜下丛,阳性细胞呈胞浆和胞膜都着色,相对分界不明显,所以采用灰度分析的方法分析两者的阳性表达。消化道阳性表达的图像分析:在高倍镜下,每只大鼠计数5张切片,每张切片随机选取5个视野,利用Q550CW型图像采集与分析系统分析,得出灰度值并进行比较。
1.4观察ghrelin对IMC的影响①埋置电极。将每根导线距末端1 cm处小心去除1 mm长度的聚四氟乙烯外膜,裸露出的银丝作为电极使用。实验大鼠禁食18 h,100 g/L水合氯醛(3 mL/kg)腹腔注射麻醉,外科无菌操作下沿腹正中线剪开腹壁肌肉以及腹膜,以24 G针头作套针穿过肠壁浆肌层,使每根导线的裸露段(约1 mm)停在浆肌层里作为记录电极。分别在大鼠的胃窦、十二指肠、空肠各埋置一对电极,每对电极距幽门的距离分别是5 mm、5 cm和15 cm。每对电极相距约2 mm,其连线与空腔脏器长轴垂直。将导线用丝线扎紧,防止电极移动脱落。在肩胛间区及右上腹之间做皮下隧道,将导线固定于体外。术后大鼠分笼单独清洁饲养,恢复1周可用于实验。②肌电活动的记录。术后第7天将已造好的大鼠动物模型禁食16 h,在清醒状态下进行实验。用大鼠固定器束缚大鼠,将银丝电极与多道生理记录仪连接,记录胃肠肌电活动。时间常数设为0.2 s,采样频率为1 kHz,低频滤波和高频滤波分别为0.8 Hz和100 Hz,信号幅度以μV记。大鼠随机分为2组,每组8只,每只大鼠先记录胃肠肌电活动1 h,其间至少记录到3个IMC,然后经尾静脉注入ghrelin 20 μg/kg。对照组给予生理盐水静脉注射。所有大鼠肌电信号通过模数转换储存于硬盘,数据经计算机分析处理。分析指标:IMC周期(min,测量从前一个IMC的结束处到下一个IMC的结束处),Ⅲ相出现的频率(次/min)、振幅(μV)、时相(min)及Ⅲ相时相占IMC周期的百分比。
1.5观察胃动素对ghrelin的影响①埋置银丝电极。具体步骤同前。②颈静脉插管。在银丝电极置入3 d后,大鼠恢复良好,可进行颈静脉插管。以100 g/L水合氯醛(3 mL/kg)腹腔注射麻醉,将大鼠四肢及头部固定于鼠台,暴露右侧颈部,去毛、消毒、铺巾,打开皮肤,逐层分离至颈静脉,将其游离,结扎远心端,在近心端剪开切口,将准备好的导管插入至上腔静脉,固定并用肝素帽封管。固定好后通过皮下隧道至颈背部穿出体外,以防鼠咬损坏。术后每天经腹腔给予青霉素钠13万单位抗感染,共注射3 d。③胃动素水平的检测。大鼠禁食16 h,将银丝电极与多道生理记录仪连接,在监测IMC的同时抽取静脉血。在IMC的Ⅰ、Ⅱ、Ⅲ相分别抽取静脉血1 mL,经颈静脉注射ghrelin(20 μg/kg),当观测到IMC运动出现变化时,在IMC的Ⅰ、Ⅱ、Ⅲ相分别抽取静脉血1 mL,每份置于含100 g/L的EDTA二钠30 μL和抑肽酶30 μL的塑料管中混匀,4 ℃离心(3 000 r/min,15 min)后,取血浆放-80 ℃保存。应用放射免疫法测定血浆胃动素水平。
1.6统计学处理免疫组化及IMC结果采用均数±标准误,血浆胃动素水平结果采用均数±标准差,数据经方差齐性及正态分布检验,IMC数据采用独立样本t检验,免疫组化数据采用多样本比较方差分析,血浆胃动素水平采用重复测量方差分析和配对t检验(SPSS 13.0 软件),以P<0.05为差异有统计学意义。
2结果
2.1GHS-R免疫阳性细胞的形态及分布特点在胃、十二指肠、空肠、回肠、盲肠、近端结肠和远端结肠均有GHS-R阳性表达,位于肠肌丛和黏膜下丛,在胞质和胞膜表达,呈淡黄色或棕黄色,胞核无表达(图1)。胃腺体均有GHS-R免疫强阳性广泛表达,在肠腺体GHS-R免疫阳性表达很少,其在平滑肌细胞和上皮细胞呈阴性表达。
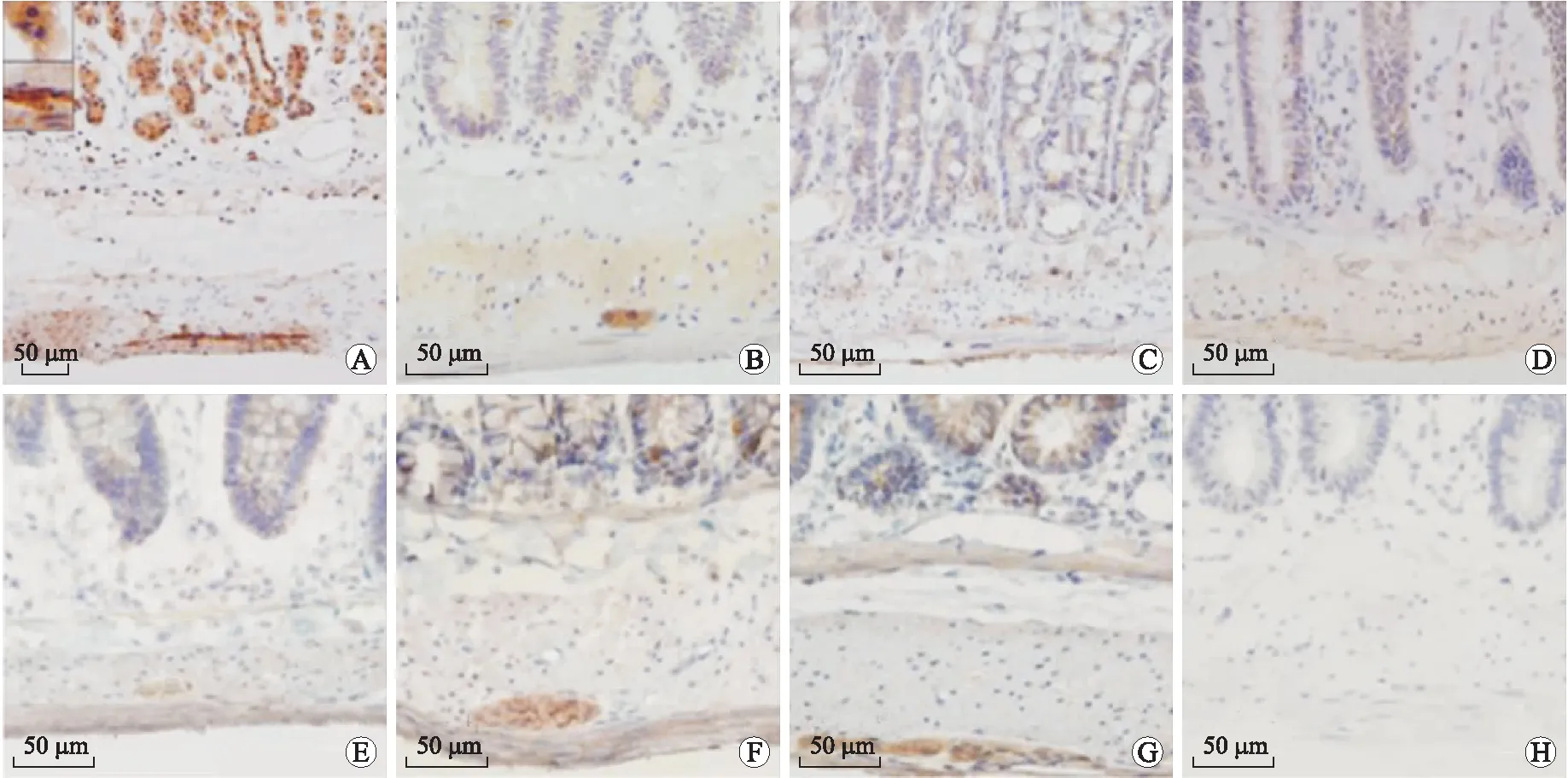
图1 GHS-R免疫阳性细胞在消化道的表达
2.2GHS-R免疫阳性细胞在消化道表达量的比较GHS-R在消化道不同部位的灰度值见图2。灰度越大,代表阳性反应越弱。GHS-R免疫阳性在胃和十二指肠最多,两者之间差异无统计学意义;在近端结肠、空肠、远端结肠、回肠、盲肠呈递减趋势,但差异无统计学意义。
2.3大鼠胃肠IMC的特征IMC可分为4个时相,第Ⅰ相为静止期,无肌电活动;第Ⅱ相有少量弱而不规则的肌电活动;第Ⅲ相有密集而较强的肌电活动和收缩波;第Ⅳ相肌电活动突然减少,是由第Ⅲ相转入新周期的过渡阶段。本次研究统计的正常大鼠胃窦IMC周期为(9.8±0.4)min,Ⅲ相持续时间为(2.6±0.2)min,占IMC周期的百分比是(26.7±2.3)%。Ⅲ相频率和振幅分别为(13.3±0.5)次/min和(133.9±13.5)μV。正常大鼠十二指肠IMC周期为(10.9±0.4)min,Ⅲ相持续时间、频率和振幅及Ⅲ相占IMC周期百分比分别为(3.3±0.2)min、(18.1±0.6)次/min、(369.5±26.2)μV和(29.9±1.1)%。正常大鼠空肠IMC周期为(12.3±0.6)min,Ⅲ相持续时间、频率和振幅及Ⅲ相占IMC周期百分比分别为(3.7±0.2)min、(19.3±0.7)次/min、(347.6±18.7)μV和(30.6±1.5)%。

图2 GHS-R在消化道不同部位灰度值的比较
2.4Ghrelin对胃肠IMC的影响注射ghrelin后,大鼠胃窦、十二指肠和空肠的肌电活动均有不同程度的增加。与对照组相比,胃窦IMC周期变短(P<0.01),Ⅲ相振幅和频率增加(P<0.01),Ⅲ相时程缩短(P<0.01),Ⅲ相占IMC周期百分比无显著变化。十二指肠的IMC周期和Ⅲ相时程显著缩短(P<0.01,P<0.05),Ⅲ相振幅和频率增加(P<0.05,P<0.01),Ⅲ相占IMC周期百分比无显著变化。空肠的IMC周期和Ⅲ相时程变短(P<0.01),Ⅲ相振幅增加(P<0.01),但Ⅲ相频率和III相占IMC周期百分比均无显著变化(图3,表1)。总体来看,ghrelin的促动力作用主要表现在缩短胃肠IMC的周期和Ⅲ相时程,增加Ⅲ相振幅,对Ⅲ相频率的影响在胃窦和十二指肠较明显,在空肠不明显,对胃肠IMC III相时程占IMC周期百分比均无明显影响。

图3 注射ghrelin后大鼠消化间期IMC的改变
2.5血浆胃动素对ghrelin的影响注射ghrelin前大鼠血浆胃动素水平随IMC发生周期性波动,IMC Ⅲ相时血浆胃动素水平较IMC Ⅰ、Ⅱ相时明显增高,有显著性差异,IMC Ⅰ、Ⅱ相之间血浆胃动素水平亦具有显著性差异,Ⅱ相高于Ⅰ相;注射ghrelin后,血浆胃动素浓度仍呈现周期性波动,即Ⅲ相最高,Ⅱ相高于Ⅰ相。然而,IMC各对应时相血浆胃动素浓度与注射前相比差异均无统计学意义(P>0.05,表2)。
3讨论
以往研究证实,ghrelin和GHS-R在中枢和外周均有表达[3-4],用荧光免疫组织化学方法在人、大鼠和豚鼠的胃和结肠肠神经丛也发现ghrelin及其受体[4-6]。但是,关于GHS-R在完整消化道的分布特征及表达量的比较尚未见报道。本研究观察了大鼠消化道GHS-R的分布特征,并对表达量进行比较。研究结果显示,大鼠的GHS-R在消化道主要分布于肠肌丛和黏膜下丛。由于GHS-R为胞膜受体,其染色以胞膜为主。然而,也有部分染色结果中出现了同时存在的胞浆着色,分析其原因为:GHS-R受体位于细胞膜,其染色主要为环形的胞膜着色带,同时GHS-R受体又是在胞质内生物合成的,其抗体可能也与胞浆内产生的一些具有同一结构(配基)的受体半成品相结合,从而引起部分胞浆着色。本研究发现,GHS-R在胃和十二指肠表达量高,表现为胞浆和胞膜表达,胞核无表达。胃腺体有GHS-R免疫强阳性表达,在肠腺体GHS-R免疫阳性表达很少,其在平滑肌细胞和上皮细胞呈阴性表达。因此,我们推测在生理条件下,胃中释放的ghrelin可能通过激活肠神经丛的GHS-R发挥作用。此外,本研究发现,大鼠GHS-R免疫阳性在胃和十二指肠呈强表达,两者之间无显著性差异,在近端结肠、空肠、远端结肠、回肠、盲肠呈递减趋势。这些特点可能与ghrelin的促胃肠运动作用密切相关,在今后的实验中可进一步研究探讨。
表1 注射ghrelin后大鼠IMC特征的参数变化
Tab.1 IMC characteristics of rats after injection of ghrelin
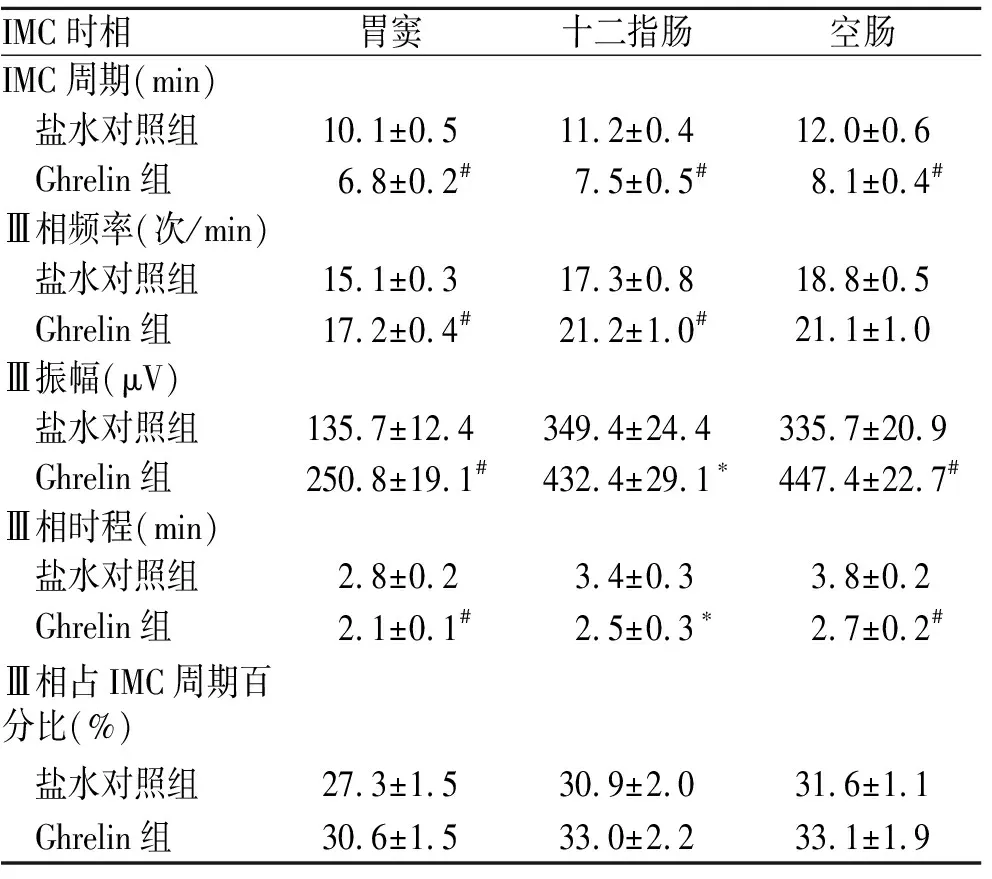
表1 注射ghrelin后大鼠IMC特征的参数变化
IMC时相胃窦十二指肠空肠IMC周期(min) 盐水对照组10.1±0.511.2±0.412.0±0.6 Ghrelin组6.8±0.2#7.5±0.5#8.1±0.4#Ⅲ相频率(次/min) 盐水对照组15.1±0.317.3±0.818.8±0.5 Ghrelin组17.2±0.4#21.2±1.0#21.1±1.0Ⅲ振幅(μV) 盐水对照组135.7±12.4349.4±24.4335.7±20.9 Ghrelin组250.8±19.1#432.4±29.1∗447.4±22.7#Ⅲ相时程(min) 盐水对照组2.8±0.23.4±0.33.8±0.2 Ghrelin组2.1±0.1#2.5±0.3∗2.7±0.2#Ⅲ相占IMC周期百分比(%) 盐水对照组27.3±1.530.9±2.031.6±1.1 Ghrelin组30.6±1.533.0±2.233.1±1.9
与盐水对照组比较,*P<0.05;#P<0.01。每组n=8。
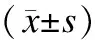
表2 注射ghrelin前后IMC不同时相血浆胃动素质量浓度的比较
与Ⅰ相比较,*P<0.05,**P<0.01;与Ⅱ相比较,#P<0.05。每组n=8。
IMC是一种禁食状态下存在的周期性、时相性肌电活动,从胃或小肠上部开始,向小肠末端移行,可促进胃排空及肠道食物转运,起着“肠道清洁夫”的作用。IMC的发生和移行主要受中枢神经系统、肠神经系统、自主神经系统及胃肠激素等多水平调控[11-12]。Ghrelin作为胃动素相关肽[2],其前体结构及氨基酸序列与胃动素有36%的同源性,其受体与胃动素受体有44%的同源性,跨膜区同源性高达87%。由于胃动素和消化道运动关系密切,可促进胃肠IMC,加速胃排空及小肠转运,ghrelin与消化道运动的关系也开始受到关注。国内研究提示,ghrelin可促进豚鼠的胃窦平滑肌收缩,增加平滑肌细胞内钙浓度,加速糖尿病小鼠的胃排空[13-14]。国外研究发现,ghrelin可加速小肠转运,诱发进食大鼠的禁食期肌电活动,通过胆碱能机制缩短小肠IMC周期,刺激禁食期胃肠动力[7-10]。本研究在此基础上进一步探讨了ghrelin对消化间期IMC的影响。研究结果显示,ghrelin促进胃肠IMC,使IMC周期缩短,Ⅲ相时程缩短,Ⅲ相占周期百分比无显著性改变;使胃和十二指肠Ⅲ相频率和振幅增加,空肠Ⅲ相振幅增加,对空肠的Ⅲ相频率无显著影响。由于GHS-R主要分布在胃,在肠道的分布显著减少[1,4]。因此,我们推测,与胃和十二指肠相比,ghrelin对空肠的促动力作用相对减弱,可能是由于空肠的GHS-R分布减少所致。
以往研究发现,血浆胃动素水平和IMC Ⅲ相之间关系密切,胃动素被认为是胃窦起源的IMC Ⅲ相的始动因子[15-16],是公认的以激素形式作用于胃肠道的胃肠激素。消化间期血浆胃动素浓度随IMC发生周期性波动,其峰值出现在IMC III相[16-17]。生理剂量的胃动素可激发胃肠区域IMC的出现,抗胃动素血清可抑制IMC的发生[18]。本研究结果显示,大鼠血浆胃动素水平随IMC呈周期性波动,IMC Ⅰ相时浓度最低,Ⅱ相时逐渐增高,在Ⅲ相开始时达到最高峰,这与大多数研究者的结论一致,也充分证实了胃动素在IMC启动和调节中的重要作用。本研究发现,给予ghrelin后,血浆胃动素浓度仍随IMC发生周期性波动。但是,各相应时相浓度与ghrelin作用前相比无显著性差异。因此,可以推测ghrelin可能不是通过提高血浆胃动素浓度而发挥促胃肠动力作用,其对IMC的影响与胃动素没有明显关系。
综上所述,GHS-R主要分布于大鼠消化道的肠肌丛和黏膜下丛,在胃腺体呈强阳性表达,在小肠腺有少量阳性表达。这提示在生理条件下,胃中释放的ghrelin可能通过激活肠神经丛的GHS-R发挥作用。Ghrelin可促进消化间期IMC,其促动力作用可能与血浆胃动素浓度无关。这些或许为阐明ghrelin及其受体的分布和作用机制提供有价值的研究资料,为胃肠动力障碍性疾病的治疗提供一定的理论基础。
参考文献:
[1] KOJIMA M, HOSODA H, DATE Y, et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J]. Nature, 1999, 402(6762):656-660.
[2] CHEN CY, TSAI CY. Ghrelin and motilin in the gastrointestinal system[J]. Curr Pharm Des, 2012, 18(31):4755-4765.
[3] BRON R, YIN L, RUSSO D, et al. Expression of the ghrelin receptor gene in neurons of the medulla oblongata of the rat[J]. J Comp Neurol, 2013, 521(12):2680-2702.
[4] DASS NB, MUNONYARA M, BASSIL AK, et al. Growth hormone secretagogue receptors in rat and human gastrointestinal tract and the effects of ghrelin[J]. Neuroscience, 2003, 120(2):443-453.
[5] XU L, DEPOORTERE I, TOMASETTO C, et al. Evidence for the presence of motilin, ghrelin, and the motilin and ghrelin receptor inneurons of the myenteric plexus[J]. Regul Pept, 2005, 124(1-3):119-125.
[6] RUCHALA M, RAFINSKA L, KOSOWICZ J, et al. The analysis of exogenous ghrelin plasma activity and tissue distribution[J]. Neuro Endocrinol Lett, 2012, 33(2):191-195.
[7] FUJINO K, INUI A, ASAKAWA A, et al. Ghrelin induces fasted motor activity of the gastrointestinal tract in conscious fed rats[J]. J Physiol, 2003, 550(Pt 1):227-240.
[8] CHEUNG CK, WU JC.Role of ghrelin in the pathophysiology of gastrointestinal disease[J]. Gut Liver, 2013, 7(5):505-512.
[9] FUJIMIYA M, ATAKA K, ASAKAWA A, et al. Ghrelin, des-acyl ghrelin and obestatin on the gastrointestinal motility[J]. Peptides, 2011, 32(11):2348-2351.
[10] MONDAL A, XIE Z, MIYANO Y, et al. Coordination of motilin and ghrelin regulates the migrating motor complex of gastrointestinal motility in Suncus murinus[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(10):G1207-G1215.
[11] DELOOSE E, JANSSEN P, DEPOORTERE I, et al. The migrating motor complex: control mechanisms and its role in health and disease[J]. Nat Rev Gastroenterol Hepatol, 2012, 9(5):271-285.
[12] 张建忠,王雁,袁申元.消化间期移行性复合运动产生的机制和临床意义[J].中华内科杂志, 1998, 37(1):57-59.
[13] 信芳杰,徐 珞. Ghrelin对豚鼠胃窦平滑肌细胞钙离子浓度的影响及与NO关系研究[J].现代生物医学进展, 2010, 10(2) :216-220.
[14] 邱文才,王维刚,王志刚,等. Ghrelin对糖尿病小鼠胃排空的影响及机制[J]. 世界华人消化杂志, 2007, 15(34):3617- 3620.
[15] TOMITA R. Relationship between interdigestive migrating motor complex and gut hormones in human[J]. Hepatogastroenterology, 2009, 56(91-92):714-717.
[16] WANG L, ZHOU L, TIAN R. Role of the area postrema of medulla oblongata in the regulation of canine interdigestive migrating motor complex[J]. Chin Med J(Engl), 2002, 115(3): 384-388.
[17] TAKAHASHI T. Mechanism of interdigestive migrating motor complex[J]. J Neurogastroenterol Motil, 2012, 18(3):246-257.
[18] LEE KY, CHANG TM, CHEY WY. Effect of rabbit antimotilin serum on myoelectric activity and plasma motilin concentration in fasting dog[J]. Am J Physiol, 1983, 245(4): G547-G553.

