不同方式的睡眠剥夺对大鼠学习记忆的影响
王博文,徐兆慧,杜 勇,陈 胜,刘芳娥
(第四军医大学基础医学实验中心,陕西西安 710032)
睡眠是维持机体生理活动和心理活动正常运行的重要保证。睡眠剥夺(sleep deprivation, SD)是指由于各种原因引起的机体睡眠量不足的状态[1]。随着社会节奏的加速、竞争压力的加大、网络的普及、持续性加班、不健康的生活方式等,致使越来越多的人处于不同程度的睡眠剥夺状态,尤其是某些特殊职业,如医务人员、执勤人员、航空航海乘务人员,或在某些极端情况下,如灾害救援、物资抢运、战时状态等,睡眠剥夺现象就会时常发生。睡眠可影响动物的行为和生理功能,如学习记忆和认知能力[2]。研究证实睡眠剥夺的大鼠学习记忆能力明显下降[3-4]。睡眠剥夺对脑功能以及学习记忆的影响显著,并且已经得到公认。因此,研究在不可避免的睡眠剥夺情况下,怎样减少睡眠剥夺对脑功能以及学习记忆的影响,具有重要的现实意义。但是,目前鲜见这方面的研究报道。本实验拟观察不同的睡眠剥夺方式对大鼠学习记忆能力和行为的影响,为减少睡眠剥夺对脑功能以及学习记忆的影响提供实验依据;同时检测大鼠大脑皮层、海马以及血浆中超氧化物歧化酶(SOD)、丙二醛(MDA)和乙酰胆碱酯酶(TChE)的含量,探讨其可能的发生机制。
1材料与方法
1.1实验动物上海产Sprague Dawley大鼠24只,成年、雄性、健康,体质量(300±30)g,由西安交通大学医学院实验动物中心提供。
1.2药品与仪器Morris水迷宫、旷场反应箱(成都泰盟科技有限公司);SOD、MDA和TChE试剂盒(南京建成生物技术公司);离心机,721型分光光度计,恒温水浴锅等。
1.3方法
1.3.1动物分组及不同方式睡眠剥夺模型的建立 将24只大鼠适应环境7 d后随机分为4组,每组6只:空白组(不做任何处理,正常睡眠),对照组(连续睡眠剥夺120 h),实验1组(睡眠剥夺共计120 h,分3次进行,每次40 h;间歇2次,每次10 h,共间歇20 h),实验2组(睡眠剥夺共计120 h,分6次进行,每次20 h;间歇5次,每次4 h,共间歇20 h),见图1。
1.3.2采用改良多平台法建立大鼠的睡眠剥夺模型 睡眠剥夺箱中央放置4个高15 cm圆形平台,直径6 cm,平台向中间凹陷,仅够大鼠在平台上站立。剥夺箱内注有水,水高5 cm,水温保持恒定。大鼠进入睡眠时,由于骨骼肌的松弛使大鼠掉入水中而惊醒,又跳上平台,造成睡眠剥夺。空白组大鼠平台直径15 cm,大鼠可以在平台上睡眠,其余与实验组环境相同。
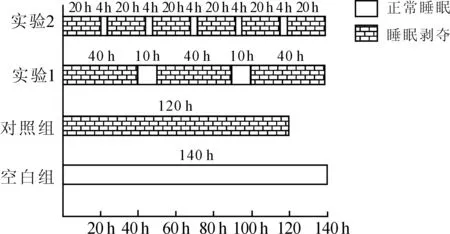
图1 各组大鼠不同睡眠剥夺方式模型的建立
1.3.3行为检测 用旷场反应箱测试大鼠行为的变化,将旷场反应箱放置在一个较封闭的屋内。旷场反应箱为一个底部面积为100 cm×100 cm,高30 cm的方形容器,旷场正上方有一个摄像头监视大鼠活动,并可以将实验数据和图像信息输入计算机。观察大鼠在旷场反应箱中5 min内的运动。静止总时间(total still time, TST)表示大鼠在旷场反应箱中5 min内静止的总时间,运动总距离(total movement distance, TMD)表示大鼠在旷场反应箱中5 min内运动的总距离。中心逗留时间(center stay time, CET)表示大鼠在旷场反应箱中5 min内在内环的停留时间,角落逗留时间(corner stay time, COT)表示大鼠在旷场反应箱中5 min内在旷场四角的停留时间。内环是指以旷场中心点为圆心,以10 cm为半径的圆。
1.3.4学习记忆能力的测试 用Morris水迷宫法进行大鼠学习记忆的训练与测试,其主要测试大鼠的空间学习记忆能力。水迷宫为一直径120 cm、高50 cm的圆形水池,池内水深25 cm,水池按方位平均分为4个象限,设定4个入水点。在一个象限内置一个直径7 cm、高23 cm的白色平台,平台没于水面下2 cm。水温保持在20 ℃左右。实验过程中水池及周围环境保持不变。实验时,将大鼠面向池壁从4个入水点分别放入水池,用秒表记录大鼠的逃避潜伏期[即从大鼠入水到找到水下隐蔽平台并站立于其上所需时间(s)],大鼠找到平台后,让其在平台上站立10 s。若入水后60 s大鼠未能找到平台,则将其轻轻从水中拖上平台,并停留10s,然后进行下一次实验。将每只大鼠从4个入水点分别放入水池为1轮训练,1轮训练进行4次,训练2轮,共训练8次,每次60 s,2次训练之间间隔30 s。训练成功的标志是大鼠在60 s内能够找到平台,淘汰训练未成功的大鼠。记录每只大鼠逃避潜伏期(escape latency, EL)的时间。
行为检测后对大鼠进行学习记忆的训练,训练成功后,即开始实验监测。实验时,将大鼠面向池壁从4个入水点分别放入的逃避潜伏期(s)取均数,作为测试成绩,若大鼠在60 s内未找到平台,则以60 s计。
1.3.5血浆SOD和MDA的测定 各组大鼠在水迷宫测量后,立即用200 g/L的乌拉坦进行腹腔注射,每只大鼠2 mL。然后断头处死大鼠,取血5 mL(每毫升全血加肝素100 U),静置30 min,3 000 r/min离心10 min,取血浆置于-20 ℃冻存待测。根据试剂盒的操作步骤,采用羟胺法检测SOD活力,TBA法检测MDA含量。
1.3.6海马和大脑皮层内SOD、MDA和TChE的测定 于冰浴中取出海马与大脑皮层,分析天平称质量,按质量海马和大脑皮层分别加冰冷的100 mmol/L PBS溶液(pH 7.0)稀释至100 g/L,并以玻璃匀浆器匀浆,离心3 min(3 000 r/min)后沉淀,取上清液待测。根据试剂盒的操作步骤,采用羟胺法检测SOD活力,TBA法检测MDA含量,比色法检测TChE含量。
2结果
2.1不同方式睡眠剥夺对大鼠行为兴奋性、探索性和学习记忆能力的影响旷场反应测试结果显示,对于TST、CET和COT,实验组时间均较空白组长(P<0.01),而较对照组短(P<0.01),而且实验2组较实验1组时间短(P<0.01);而对于TMD,实验组较空白组短(P<0.01),而较对照组长(P<0.01),且实验2组较实验1组长(P<0.01)。
水迷宫中逃避潜伏期的测试,实验组均较空白组延长(P<0.01),而较对照组缩短(P<0.01),而且实验2组较实验1组缩短(P<0.01,表1)。
表1 各组大鼠行为和学习记忆能力的比较
与空白组比较,*P<0.01;与对照组比较,△P<0.01;与实验1组比较,▲P<0.01,#P<0.05。
2.2不同方式睡眠剥夺大鼠血浆、海马和大脑皮层内SOD和MDA含量的变化大鼠血浆、海马和大脑皮层组织中SOD含量,实验组较空白组低(P<0.01),较对照组高(P<0.01),而且实验2组较实验1组高(P<0.01,表2);而血浆、海马和大脑皮层组织中MDA含量,实验组较空白组高(P<0.01),较对照组低(P<0.01),而且实验2组较实验1组低(P<0.01,表3)。
2.3不同方式睡眠剥夺大鼠海马和大脑皮层内TChE含量的变化大鼠海马和大脑皮层中TChE含量,实验组较空白组高(P<0.01),较对照组低(P<0.01),而且实验2组较实验1组高(P<0.01,表4)。
表2 血浆、海马和大脑皮层内SOD含量的比较
与空白组比较,*P<0.01;与对照组比较,△P<0.01,▲P<0.05;与实验1组比较,#P<0.01。
3讨论
研究证明,睡眠剥夺对学习记忆有损伤作用[4-5]。我们希望通过构建不同方式睡眠剥夺的大鼠模型来研究在不可避免的睡眠剥夺情况下,怎样减少睡眠剥夺对脑功能以及学习记忆的影响,提高工作和学习效率。因此,本实验设计2个实验组给予不同的间断性睡眠剥夺方式,并且设计一个空白组和一个完全睡眠剥夺的对照组,以此来模拟现实情况,并且每组大鼠睡眠剥夺总时间一样,间断总时间也一样,增加了每组之间的可比性。
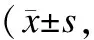
表3 血浆、海马和大脑皮层内MDA含量的比较
与空白组比较,*P<0.01;对照组比较,△P<0.01;与实验1组比较,▲P<0.01。
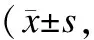
表4 海马和大脑皮层内TChE含量的比较
与空白组比较,*P<0.01;与对照组比较,△P<0.01;与实验1组较,▲P<0.01。
旷场实验中用静止总时间和运动总距离指标考察大鼠的兴奋性状态。大鼠在旷场反应箱中,由于环境陌生,基本上处于运动状态[6]。本研究结果显示,睡眠剥夺期间的间歇次数多,一次性间歇时间短的大鼠相比而言,运动能力较强,说明间歇次数多的大鼠运动减弱程度低。实验用中心逗留时间和角落逗留时间两个指标考察大鼠的探索性行为,动物在情绪兴奋时,更容易向空旷的地方进行探索。因此,在旷场中间逗留时间较长,反之则会在角落逗留时间较长[7]。在水迷宫实验中用逃避潜伏期来考察大鼠的学习记忆能力[8],学习记忆能力强的大鼠逃避潜伏期短[9]。本实验结果显示,间歇次数多、每次间歇时间短的大鼠,学习记忆能力和兴奋性较强,逃避潜伏期短,说明睡眠剥夺总时间虽然一样,但是有间歇的大鼠学习记忆能力明显比连续睡眠剥夺的对照组减弱程度稍低;间歇总时间一样,但是间歇次数越多,大鼠学习记忆能力的减弱程度就越低。
SOD是重要的金属酶,为机体直接清除自由基的重要酶类,通过歧化反应清除H2O2和OH·的前身O2,从而保护细胞免受毒性氧自由基的损坏[10]。睡眠剥夺后脑组织SOD活性降低,提示脑内氧自由基的含量升高,由此推测氧自由基增加及被清除能力减弱可能是睡眠剥夺后脑功能损害、学习记忆能力下降的重要原因之一[11]。MDA是脂质过氧化物的分解产物,为一种重要的生物大分子交联剂,它能交联蛋白质与核酸,使DNA发生突变,影响信息传递、转录和复制,导致蛋白质合成能力下降或合成蛋白质功能紊乱,从而表现出记忆力和智力下降,故其含量间接地反映了自由基的损害程度[12-14]。睡眠期间的很多神经递质影响学习记忆,乙酰胆碱(ACh)就是其中之一。TChE是脑内与学习记忆相关的重要酶类之一,可分解突触间隙的神经递质乙酰胆碱,使乙酰胆碱含量降低;TChE活性增加会导致脑内学习记忆活动障碍[14]。通过测量TChE含量可以间接反应大鼠大脑中ACh含量。实验结果表明,睡眠剥夺间歇次数多、一次性间歇时间短的大鼠SOD含量较高,MDA和TChE含量较低;睡眠剥夺总时间虽然一样,但是有间歇的大鼠SOD含量明显比连续睡眠剥夺的对照组减少程度低,MDA和TChE含量明显比连续睡眠剥夺的对照组增高程度低;间歇总时间一样,但是间歇次数越多,大鼠SOD含量越高,MDA和TChE含量越低,大鼠大脑功能损伤较轻,学习记忆能力越强,进一步验证了行为学实验的结果。
总之,与睡眠剥夺间歇次数多的大鼠相比,间歇次数少的大鼠行为兴奋性和学习记忆能力较强;同时,大鼠血浆、海马和大脑皮层内MDA、TChE含量较低, SOD的活性较高。说明间断性睡眠剥夺增强大鼠抗自由基和抗过氧化损伤能力,减少大鼠大脑内ACh的含量降低可能是增强学习记忆能力的重要机制之一。因此,在一些由于紧急情况而不可避免造成睡眠剥夺的情况下,尽可能安排多次少量的间歇休息时间,以减少睡眠剥夺对机体学习记忆和行为的影响,提高工作效率。
参考文献:
[1] 孙慧,姚明辉,等. 睡眠不足及夺眠引起机体生理功能的变化[J]. 世界临床药物,2009, 30(4):233-236.
[2] VILLALOBOS C, ANDRADE R. Visinin-like neuronal calcium sensor proteins regulate the slow calcium-activated after-hyperpolarizing current in the rat cerebral cortex[J]. Neurosci, 2010, 30:14361-14365.
[3] COLLINS MA, TAJUDDIN N, NEAFSEY EJ. Effect of adolescent/adult binge-pattern ethanol exposure on rat brain aquaporin-4 and phospholipase A2 levels[J]. Soc Neurosci Abstr, 2011, 37:256.
[4] ZADOR Z, STIVER S, WANG V, et al. Role of aquaporin-4 in cerebral edema and stroke. In: Handbook of experimental pharmacology[J]. Berlin, 2009 190:159-170.
[5] HERATH S, LILLY ST, FISCHER DP, et al. Bacterial lipopolysaccharide induces an endocrine switch from prostaglandin F2alpha to prostaglandin E2 in bovine endometrium[J]. Endocrinology, 2009, 150:1912-1920.
[6] CUI W, DARBY-KING A, GRIMES MT,et al. Odor preference learning and memory modify GluA1 phosphorylation and GluA1 distribution in the neonate rat olfactory bulb: Testing the AMPA receptor hypothesis in an appetitive learning model[J]. Learn Mem, 2011, 18: 283-291.
[7] VAN DORT CJ.BAGHDOYAN HA.LYDIC R.Adenosine A(1)and A(2A)receptors in mouse prefrontal cortex modulate acetylcholine release and behavioral arousal[J]. Neurosci, 2009, 29:871-881.
[8] LIM S, STRAHL T, THORNER J, et al. Structure of a Ca2+—myristoyl switch protein that controls activation of a phosphatidylinositol 4-kinase in fission yeast[J]. Biol Chem, 2011, 286: 12565-12577.
[9] JO J, SON GH, WINTERS BL, et al. Muscarinic receptors induce LTD of NMDAR EPSCs via a mechanism involving hippocalcin, AP2 and PSD-95[J]. Nat Neurosci, 2010, 13:1216-1224.
[10] ALIKUNJU S, ABDUL MUNEER PM, ZHANG Y,et al. The inflammatory footprints of alcohol-induced oxidative damage in neurovascular components[J]. Brain Behav Immun, 2011, 25(Suppl 1):S129-S136.
[11] JOLITHA AB, SUBRAMANYAM MV, ASHA DEVI S. Age-related responses of the rat cerebral cortex: influence of vitamin E and exercise on the cholinergic system[J]. Biogerontology, 2009, 10:53-63.
[12] NIIJIMA F, SAITO H, MURAI S, et a1. Effects of atomoxetine on levels of monoamines and related substances in discrete brain regions in mice intermittently deprived of rapid eye movement sleep[J]. Biol Pharm Bull, 2010, 33:617-621.
[13] BLURTON-JONES M, KITAZAWA M, MARTINEZ-CORIA H, et al. Neural stem cells improve cognition via BDNF in a transgenic model of Alzheimer disease[J]. Proc Natl Acad Sci USA, 2009, 106:13594-13599.
[14] BRINTON RD. Estrogen-induced plasticity from cells to circuits: predictions for cognitive function[J]. Trends in Pharmacological Sciences, 2009, 30(4):212-222.

