创建可视化的家蚕杆状病毒表达系统表达家蚕二分浓核病毒非结构蛋白NS1
李国辉,王鹏,李芒芒,徐五,胡朝阳,姚勤
江苏大学生命科学研究院,江苏 镇江 212013
杆状病毒-昆虫细胞表达系统 (BEVS) 是四大真核表达系统之一,与其他表达系统相比,BEVS具有一些独特的优越性,具体表现在:第一,外源基因在多角体强启动子的控制下,其表达产量较高;第二,BEVS具有能同时表达多个基因以及大片段DNA的能力;第三,表达产物具有正确的折叠以及翻译后加工、修饰等特性;第四,由于杆状病毒不感染脊椎动物,是一个相对安全的生物表达系统[1-4]。苜蓿丫纹夜蛾核多角体病毒(AcNPV)或家蚕核型多角体病毒(BmNPV) 是BEVS中常利用的杆状病毒表达载体,所表达出来的蛋白产物与其对应的天然产物具有相近的生物活性、抗原性和免疫原性,是一种非常理想的外源蛋白表达系统[5-6]。自1985年利用该系统首次成功表达人干扰素-β(IFN-β) 以来,现已包括白介素 1-3 (IL-1、IL-2、IL-3) 以及病毒来源的蛋白都获得表达,并对其进行了后续的功能研究,进而为蛋白药物以及高效价基因工程疫苗的研发和生产奠定了基础[7-10]。
BEVS在生产实践中已有近30年的应用历程,如今,BEVS已被广泛应用于外源蛋白的表达、疫苗生产、生物杀虫剂和基因治疗等研究领域中[11-14]。利用 BEVS表达外源蛋白,需要将重组杆粒DNA转染昆虫细胞制备具有感染性的重组病毒粒子[15-17],因此有效地判断转染的细胞中是否成功地产生了重组病毒粒子,是后续实验中靶蛋白获得表达的一个重要前提。通过比较转染前后的细胞形态变化,经验丰富的研究人员能够判定感染性病毒粒子产生的情况,而初学者难免不会作出误判,不利于重组病毒粒子的鉴定及后续研究的进行。为此,本研究在 BEVS中引入绿色荧光基因,构建了BmNPV来源的极早期基因ie1启动子控制egfp基因表达盒和多角体启动子控制外源基因双表达载体,通过转座将这两个启动子控制下的双表达盒插入到家蚕穿梭载体Bm-Bacmid中,创建一个整合型表达egfp和靶基因的重组Bm-Bacmid,进而利用可视化的绿色荧光信号,来快速判定重组杆粒 DNA在转染后的家蚕BmN细胞中病毒粒子的产生。

1 材料与方法
1.1 菌株、细胞和试剂
用于质粒克隆的大肠埃希菌Escherichia coliTG1及含有家蚕穿梭质粒 Bm-Bacmid的DH10B宿主菌在LB培养基中进行培养,含有pFastBacI质粒的大肠杆菌 DH5α以及含有pFastHTB质粒的大肠杆菌DH5α保存于本实验室。家蚕BmN细胞培养于添加10%胎牛血清的TC-100昆虫细胞培养基中,在27 ℃的恒温培养箱中进行培养,培养的家蚕BmN细胞用于转染及病毒感染实验。pMD18T-egfp和pMD18T-ns1载体由本实验室保存。卡那霉素、氨卞青霉素和四环素购自Sigma公司。SnaBⅠ、BamHⅠ、KpnⅠ、EcoRⅠ、SpeⅠ、XbaⅠ、NheⅠ、XhoⅠ、T4 DNA连接酶、Taq酶和pMD18-T载体购自宝生物工程 (大连) 有限公司。IPTG 和 X-gal购自上海朝瑞生物公司。引物合成和序列测定由上海生工生物工程公司完成。
1.2 重组质粒 pFastBacI-Pie1-egfp-sv40-Ppolh
的构建
为扩增杆状病毒BmNPV基因组中的极早期基因ie1启动子,通过Primer Premier 5.0软件设计两条特异性引物ie1-F和ie1-R(表1),通过PCR从BmNPV基因组中扩增 560 bp长的DNA片段,对扩增后的 DNA片段分别进行SnaBⅠ和BamHⅠ单酶切,将酶切后的目的DNA进行切胶纯化,并将纯化后的 DNA克隆到pFastHTB载体上产生重组质粒 pFastHTB-Pie1;为扩增egfp基因序列全长,通过Primer Premier 5.0软件设计两条特异性引物egfp-F和egfp-R,通过PCR扩增得到720 bp的egfp基因全长序列,对扩增得到的目的 D N A片段进行BamHⅠ/KpnⅠ双酶切,对双酶切后的产物进行切胶回收,并将回收后的产物与载体pFastHTBPie1进行连接,结果产生重组质粒 pFastHTBPie1-egfp。

1.3 重组质粒 pFastBacI-Pie1-egfp-sv40-
Ppolh-ns1-sv40的构建
1.4 重组杆粒Bm-Bacmid的构建

1.5 重组病毒粒子的制备
将经PCR鉴定正确的重组克隆接种在含有3 种抗生素 K+G+T+(50 μg/mL 卡那霉 素、7 μg/mL庆大霉素、10 μg/mL四环素)的LB液体培养基中,在37 ℃、225–320 r/min的条件下培养48 h后;取1.5 mL培养的菌液离心,对离心后的菌体抽提重组杆粒。在脂质体 Cellfectin®Ⅱ(Cat.no.10362-100)的介导下,将上述抽提的重组杆粒DNA转染BmN细胞,通过荧光显微镜对转染后的细胞进行荧光观察;为进一步证实产生的重组病毒粒子是否具有感染性,收集转染后的细胞培养上清,将其与BmN细胞孵育1 h后,弃上清,添加完全培养基继续培养,通过荧光显微镜对感染后的细胞在不同时间点进行连续观察。
1.6 Western blotting分析
对重组杆粒DNA转染后的BmN细胞进行荧光显微观察,收集能观察到绿色荧光的转染孔中的细胞培养上清,将收集的转染上清感染BmN细胞,进而收集感染4 d后的BmN细胞,对感染后的细胞总蛋白进行Western blotting分析,由于表达的NS1蛋白N端融合有6×His 的序列标签,用抗6×His Tag单克隆抗体 (Earthox)为一抗,碱性磷酸酶标记的马抗小鼠IgG (北京中杉金桥生物技术有限公司) 为二抗,显色底物为 BCIP/NBT碱性磷酸酯酶显色试剂盒 (海门碧云天生物技术有限公司)。
2 结果
2.1 重组质粒 pFastBacI-Pie1-egfp-sv40-Ppolh的构建策略


2.2 重组质粒 pFastBacI-


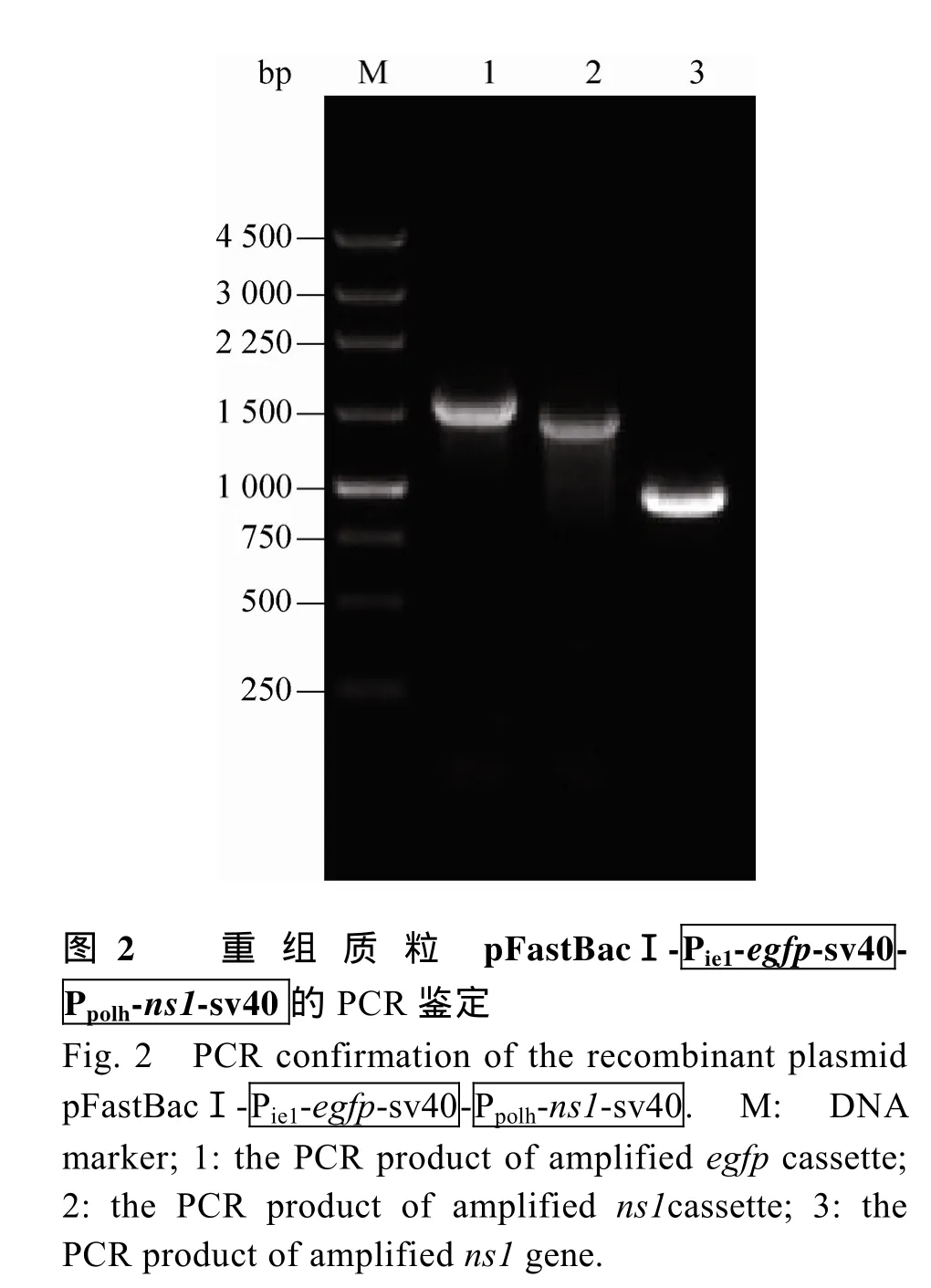
2.3 重组杆粒 Bm-Bacmid-
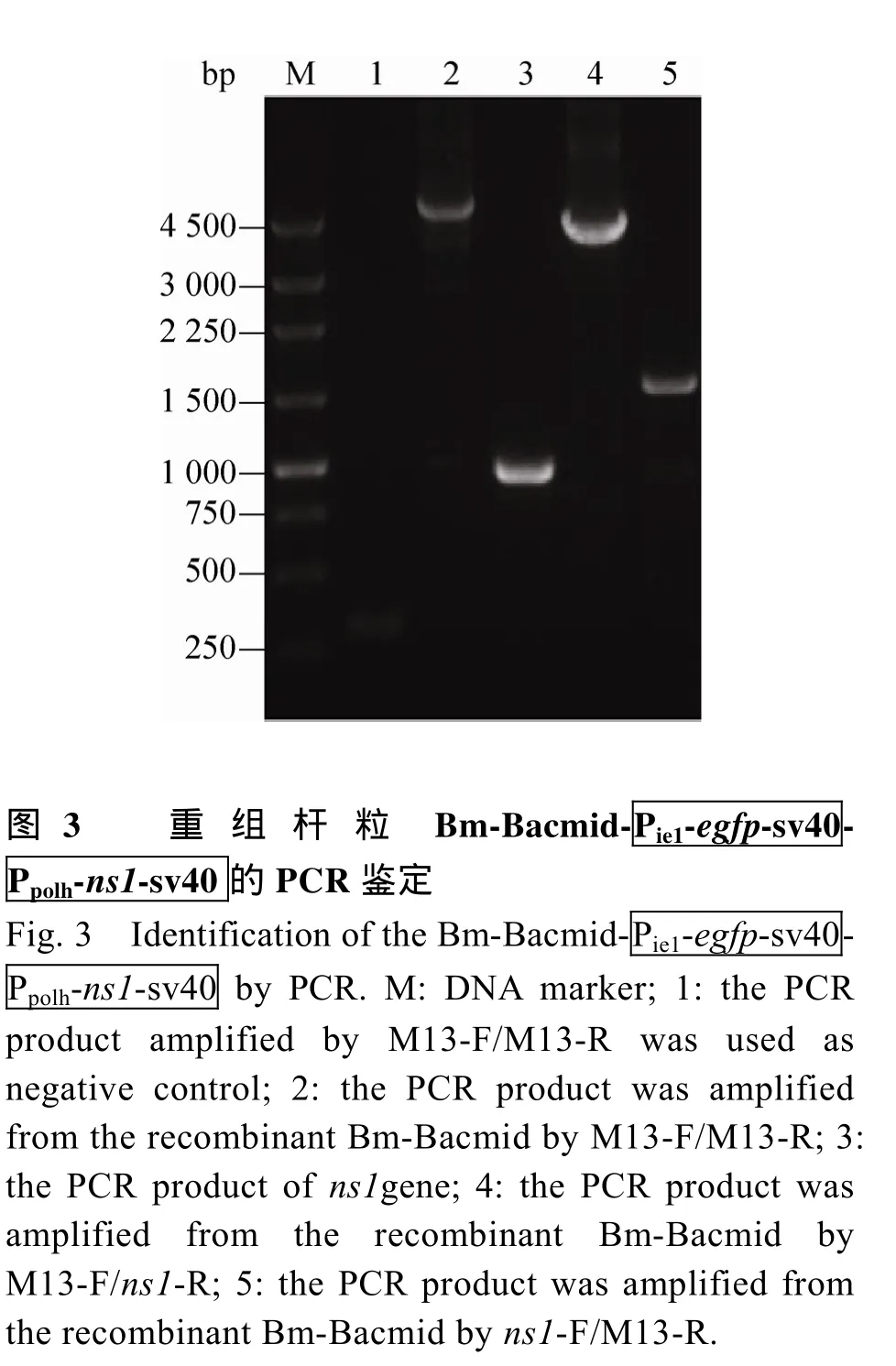
2.4 重组杆粒DNA转染BmN细胞后的荧光显微观察
通过转座将ie1早期启动子控制下的egfp表达盒引入到家蚕 Bm-Bacmid中,重组杆粒DNA在脂质体Cellfectin的介导下进入BmN细胞中,对转染后的BmN细胞不同的时间点连续进行荧光显微观察,鉴定重组 Bm-Bacmid在BmN细胞中绿色荧光蛋白的表达情况。荧光显微结果表明:转染24 h后,在BmN细胞中能看到零星的绿色荧光信号,随着时间的延长,绿色荧光信号越来越多 (图4 A);为验证转染上清中是否产生了重组芽生型病毒粒子以及是否具有感染性,收集转染96 h后的细胞培养上清,将其与新培养的BmN细胞进行孵育,24 h后,荧光显微结果表明:在转染上清孵育的BmN细胞中能观察到绿色荧光,随着时间的延长,荧光信号越来越多;96 h后,整个视野中都充满了绿色荧光信号 (图4 B),这些结果表明:转染后的细胞上清中已产生了具有感染性的重组病毒粒子;由此可见,可视化绿色荧光信号的介入有助于我们快速判定重组病毒粒子的产生,以及重组病毒粒子是否能够启动下一轮感染。
2.5 NS1蛋白的表达和鉴定
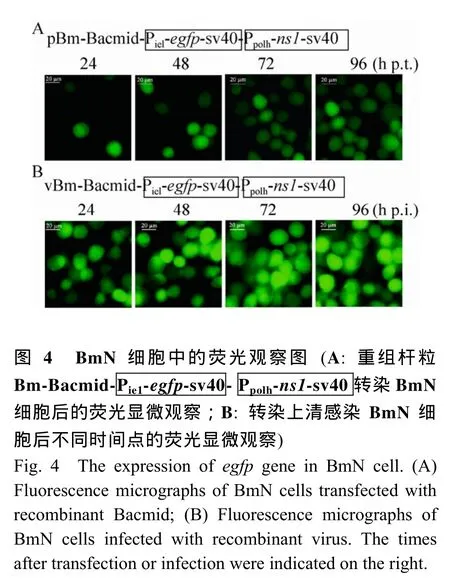

图5 NS1蛋白的Western blotting分析Fig. 5 Western blotting analysis of target protein NS1 expressed in BmN cells. M: standard protein marker; 1:negative control; 2: sample of NS1 protein.
3 讨论
杆状病毒是一种非人源化的病毒,只特异性地感染无脊椎动物,现已被遗传改造为真核表达载体,实践证明改造后的杆状病毒是一种非常有效的蛋白表达载体,已广泛用于外源基因的表达并成功表达上千种功能蛋白[7,22-24];除此之外,杆状病毒囊膜上还可展示异源蛋白,以及通过 BEVS在昆虫细胞内表达异源病毒的一些结构蛋白,使其在胞内组装成病毒样颗粒,可用来制备高效价的病毒疫苗;利用杆状病毒在哺乳细胞内不能增殖的特性,将其改造为基因治疗载体,在靶向治疗人类疾病方面拥有巨大的应用前景[1]。
利用杆状病毒-昆虫细胞表达系统表达外源基因,从重组病毒感染的细胞中纯化表达的靶蛋白,在体外对纯化后的靶蛋白进行活性分析,这是目前对未知基因功能研究常用的一种方法。然而,杆状病毒-昆虫细胞表达系统也有许多不足之处有待于进一步改进,尤为突出的是重组病毒感染细胞后会导致细胞裂解,显著降低靶蛋白的表达产量,从而增加了外源蛋白表达所需的成本和时间[25];另外,连续多次感染昆虫细胞后产生的重组病毒容易发生目的基因丢失,致使靶蛋白表达产量降低甚至不表达[26];其次,还有一些具有特殊理化性质的蛋白,比如猪瘟病毒 ( CSFV) E2蛋白[27],其在昆虫细胞中的表达量偏低或者根本不表达,而 Western blotting往往检测不到这一类蛋白的表达,由此让我们对表达流程中的系列步骤产生质疑,需要对实验过程中产生的中间产物逐一进行验证,尤其需要对转染后的昆虫细胞中是否产生了重组病毒粒子进行鉴定,而反复通过RT-PCR和Western blotting来对实验中的每个步骤进行验证,耗时、耗力、且浪费试剂,因此快速、有效地鉴定转染后的昆虫细胞中已产生具有感染性的重组病毒粒子,不仅与靶基因能否在BEVS中顺利表达直接相关,同时也是用来判定外源基因在 BEVS中表达或不表达的一个重要参数。
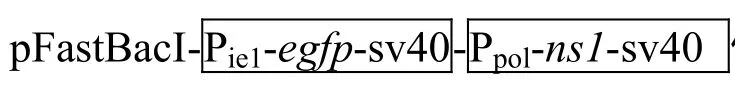
本文实验结果表明:通过构建整合性表达egfp的重组 Bm-Bacmid,是一种可行、有效地且能够快速判定转染后的细胞中是否产生了感染性的重组病毒粒子,利用该整合型表达载体成功地表达了家蚕二分浓核病毒(BmBDV)非结构蛋白 NS1。NS1蛋白的快速表达,为进一步揭示NS1蛋白的磷酸化表达模式与功能机制之间的相互关系以及为表达其他外源基因奠定了坚实的科学基础;同时也极大地促进和优化了杆状病毒-昆虫细胞表达系统在外源蛋白表达中的应用。
[1]Hu YC. Baculovirus as a highly efficient expression vector in insect and mammalian cells.Acta Pharmacol Sin, 2005, 26(4): 405–416.
[2]Tiwari P, Saini S, Upmanyu S, et al. Enhanced expression of recombinant proteins utilizing a modified baculovirus expression vector. Mol Biotechnol, 2010, 46(1): 80–89.
[3]Lee KS, Je YH, Woo SD, et al. Production of a cellulase in silkworm larvae using a recombinantBombyx morinucleopolyhedrovirus lacking the virus encoded chitinase and cathepsin genes.Biotechnol Lett, 2006, 28(9): 645–650.
[4]Liu T, Zhang YZ, Wu XF. High level expression of functionally active human lactoferrin in silkworm larvae. J Biotechnol, 2005, 118(3): 246–256.
[5]Lee KS, Kim BY, Je YH, et al. A new technique for producing recombinant baculovirus directly in silkworm larvae. Biotechnol Lett, 2007, 29(1):175–180.
[6]Chen J, Wu XF, Zhang YZ. Expression,purification and characterization of human GM-CSF using silkworm pupae (Bombyx mori) as a bioreactor. J Biotechnol, 2006, 123(2): 236–247.
[7]Maeda S, Kawai T, Obinata M, et al. Production of human alpha-interferon in silkworm using a baculovirus vector. Nature, 1985, 315(6020):592–594.
[8]Wang XM, Helaszek CT, Winter LA, et al.Production of active human interleukin-1 beta-converting enzyme in a baculovirus expression system. Gene, 1994, 145(2): 273–277.
[9]Gujar SA, Michalak TI. Characterization of bioactive recombinant woodchuck interleukin-2 amplified by RLM-RACE and produced in eukaryotic expression system. Vet Immunol Immunopathol, 2006, 112(3/4): 183–198.
[10]DiFalco MR, Bakopanos E, Patricelli M, et al. The influence of various insect cell lines, p10 and polyhedrin promoters in the production of secreted insulin-like growth factor-interleukin-3 chimeras in the baculovirus expression system. J Biotechnol,1997, 56(1): 49–56.
[11]Kost TA, Condreay JP, Jarvis DL. Baculovirus as versatile vectors for protein expression in insect and mammalian cells. Nat Biotechnol, 2005, 23(5):567–575.
[12]Unger T, Peleg Y. Recombinant protein expression in the baculovirus-infected insect cell system.Methods Mol Biol, 2012, 800: 187–199.
[13]Lu HY, Chen YH, Liu HJ. Baculovirus as a vaccine vector. Bioengineered, 2012, 3(5): 271–274.
[14]Koroleva NN, Spirin PV, Timokhova AV, et al.Baculovirus vectors for efficient gene delivery and expression in mammalian cells. Mol Biol (Mosk),2010, 44(3): 541–550.
[15]Na Z, Huipeng Y, Lipan L,et al. Efficient production of canine interferon-alpha in silkwormBombyx moriby use of a BmNPV/Bac-to-Bac expression system. Appl Microbiol Biotechnol,2008, 78(2): 221–226.
[16]Usami A, Ishiyama S, Enomoto C, et al.Comparison of recombinant protein expression in a baculovirus system in insect cells (Sf9) and silkworm. J Biochem, 2011, 149(2): 219–227.
[17]Sun J, Yao L, Yao N,et al. Production of recombinantBombyx morinucleopolyhedrovirus in silkworm by intrahaemocoelic injection with invasive diaminopimelate auxotrophicEscherichia colicontaining BmNPV-Bacmid. Biotechnol Appl Biochem, 2010, 57(3): 117–125.
[18]Li GH, Hu ZY, Tang Q, et al. Advance in functional mechanism of parvovirus non-structural protein NS1. Sci Sericult, 2012, 38(5): 0919–0923(in Chinese).
李国辉, 胡朝阳, 唐琦, 等. 细小病毒非结构蛋白 NS1作用机制的研究进展. 蚕业科学, 2012,38(5): 0919–0923.
[19]Zhang JH, Li GH, Yao Q, et al. Research advances on the function of non-structural protein NS1 of parvovirus. J Anhui Agri Sci, 2010, 22(5):11730–11731 (in Chinese).
张俊红, 李国辉, 姚勤, 等. 细小病毒非结构蛋白 NS1功能的研究进展. 安徽农业科学, 2010,22(5): 11730–11731.
[20]Li G, Sun C, Zhang J, et al. Characterization ofBombyx moriparvo-like virus non-structural protein NS1. Virus Genes, 2009, 39(3): 396–402.
[21]Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York:Cold Spring Harbor Laboratory Press, 1989:20–25.
[22]Zhou L, Wu X, Lan L, et al. Expression of Trichoderma reesei endo-beta-glucanase II in silkworm,Bombyx moriL. by using BmNPV/Bacto-Bac expression system and its bioactivity assay.Biotechnol Lett, 2009, 32(1): 67–72.
[23]Kato T, Kajikawa M, Maenaka K, et al. Silkworm expression system as a platform technology in life science. Appl Microbiol Biotechnol, 2010, 85(3):459–470.
[24]Summers MD. Milestones leading to the genetic engineering of baculoviruses as expression vector systems and viral pesticides. Adv Virus Res, 2006,68: 3–73.
[25]Ikonomou L, Schneider YJ, Agathos SN. Insect cell culture for industrial production of recombinant proteins. Appl Microbiol Biotechnol, 2003, 62(1):1–20.
[26]Pijlman GP, de Vrij J, van den End FJ, et al.Evaluation of baculovirus expression vectors with enhanced stability in continuous cascaded insect-cell bioreactors. Biotechnol Bioeng, 2004,87(6): 743–753.
[27]Bae SM, Kim HJ, Lee JB, et al. Hyper-enhanced production of foreign recombinant protein by fusion with the partial polyhedrin of nucleopolyhedrovirus. PLoS ONE, 2013, 8(4):e60835.

