烟草毛状根多倍体诱导及其植株再生
侯丽丽,施和平,余武,曾宝强,周卓辉
1 华南师范大学生命科学学院 广东省植物发育生物工程重点实验室,广东 广州 510631 2 香港教育学院科学与环境学系,香港 新界
多倍体 (Polyploids) 在植物中广泛存在,是植物进化的途径之一[1]。但由于自然界产生多倍体的过程相当漫长,一直以来国内外育种学家都采用秋水仙素人工诱导染色体加倍的方法来获得植物多倍体[2]。已有的研究表明,由于染色体加倍,多倍体植株不仅在根、茎、叶和花等器官上具有“巨型性”,而产生出较大的营养器官和繁殖器官[2-3];而且大都能显著增强药用植物的次生代谢,并能通过筛选获得次生物质含量及产量更高的优良植物品系[4-5]。因而秋水仙素诱导染色体加倍的技术一直以来都被用作植物种质创新的重要手段之一。然而,在利用秋水仙素人工诱导染色体加倍来培育多倍体植物时,大都是采用秋水仙素处理植物的叶片[6]、愈伤组织[7]、根段[8]、种子或幼苗生长点[9]等来进行多倍体诱导。极少见利用单细胞起源、可自主生长的毛状根 (Hairy roots) 用作多倍体诱变育种起始材料的研究报道。
发根农杆菌遗传转化植物细胞产生的毛状根不仅能在无外源激素的培养基上快速自主生长,而且具有次生代谢产率量高且稳定及易通过组织培养途径获得其再生植株等优势[10-11],因而应该非常适合用作秋水仙素诱导多倍体的实验体系。如利用秋水仙素诱导可获得青蒿素含量比原二倍体毛状根高 6倍的同源四倍体青蒿毛状根系[12]。但未见有关利用人工诱导产生的多倍体毛状根及其再生植株来生产植物次生物质及进行植物种质创新的更多研究报道。
为此,本文以烟草Nicotiana tabacumK326为材料,通过发根农杆菌遗传转化获得可自主生长的烟草毛状根后,用化学诱变剂秋水仙素对烟草毛状根进行多倍体诱导及其植株再生以及其次生物质烟碱含量的分析,旨在利用毛状根多倍体化来进行烟草种质创新和提高其次生物质烟碱含量,并为今后开展利用毛状根多态性来进行植物多倍体育种奠定实验和技术基础。
1 材料与方法
1.1 细菌菌株及培养
野生农杆碱型发根农杆菌Agrobacterium rhizogenesATCC15834由德国 Martin-Lüther Universitaet Halle/Wittenberg的Peter Lindemann博士提供。农杆菌在YEB固体培养基上暗培养和保存。挑取该农杆菌单菌落接种于YEB液体培养基中28 ℃振荡 (160 r/min) 培养30 h供感染用。
1.2 烟草无菌苗的获得及其外植体制备
按施和平等[13]的方法获得烟草Nicotiana tabacum烤烟品种K326的无菌苗。取无菌苗的幼嫩叶片切成1–1.5 cm2左右的外植体,置于无外源激素的MS培养基[14]上预培养24 h后,用于转化。
1.3 烟草毛状根的诱导与培养
将上述预培养24 h的烟草叶片外植体浸入用 MS培养基稀释 2倍的发根农杆菌ATCC15834菌悬液中20 min,取出、吸干多余菌液并放回原培养基上共培养 2 d后,转入MS+500 mg/L头胞噻肟钠(Cefotaxime)的无外源激素的MS培养基上,在25 ℃每天14 h散射光下诱导毛状根。切取从叶片外植体切口中脉处产生的毛状根置于含500 mg/L头胞噻肟钠的无外源激素的 MS培养基上除菌培养,约 5–6次继代培养后,所获得的无菌毛状根系供进行遗传转化鉴定、植株再生以及毛状根多倍体诱导用。
1.4 毛状根的遗传转化鉴定
采用Ri质粒TL-DNA (T-DNA左臂) 的rol基因的PCR扩增和TR-DNA (T-DNA右臂) 的冠瘿碱合成酶基因的表达产物冠瘿碱的纸电泳检测来对烟草毛状根进行遗传转化鉴定。
1.4.1 毛状根rol基因的PCR扩增
取适量无菌的毛状根,按Edward等[15]的方法提取其基因组DNA,纯化后用作PCR扩增的模板。以烟草非转化植株根的基因组DNA作对照。根据Furner等[16]发表的序列,分别设计并合成扩增rolB和rolC的PCR引物,其序列如表 1所示,均由上海生工生物工程有限公司合成。在 0.2 mL的硅化离心管中加入模板 DNA 50 ng,TaqDNA聚合酶2个单位,PCR反应总体积为50 μL。rolB、rolC基因PCR扩增参数如下:94 ℃ 5 min ;94 ℃变性1 min,53.5 ℃退火1 min,72 ℃延伸反应 1 min,37个循环;最后72 ℃延伸10 min。扩增产物采用0.8%琼脂糖凝胶电泳和EtBr替代染料Goldview染色进行分析。
1.4.2 冠瘿碱的检测
毛状根冠瘿碱的检测参照 Ellis等[17]的方法。取除菌后自主生长的毛状根系 200 mg, 加0.1 mol/L HCl 200 μL, 用玻璃棒捣成匀浆,4 000×g 离心15 min,上清液用毛细管点样于3 mm 厚的Watman滤纸上, 置于高压电泳槽中电泳。电泳条件: 40 V/cm, 1.5 h。滤纸取出风干后置于0.2%硝酸银丙酮溶液中30 s, 风干后转移到1% NaOH甲醇溶液中2 min, 最后用3%Na2S2O3溶液固定。

表1 PCR扩增所用的引物及其序列Table 1 Primer sequences used for the PCR amplification
1.5 烟草毛状根的植株再生
将上述遗传转化鉴定呈阳性的毛状根,切成2–3 cm的根段,分别接入添加1.0、2.0、3.0 mg/L 6-BA和0、0.1、0.2、0.3 mg/L NAA组合的MS培养基中进行植株再生。所有MS培养基均添加3%的蔗糖 (W/V),1%的琼脂,pH 6.0。
1.6 烟草毛状根多倍体诱导及其植株再生
采用秋水仙素根尖浸泡法来进行烟草毛状根多倍体诱导。选取经遗传转化鉴定呈阳性、且在 MS液体培养基中生长旺盛、长势粗壮的毛状根,切取其2–3 cm长的根尖段,分别置于盛有含0、0.05%、0.1%和0.2% (W/V) 秋水仙素的 MS液体培养基中进行振荡培养(200 r/min),并分别在处理12、24、36和48 h后挑选根尖明显膨大的根尖段,用 MS液体培养基洗去根尖表面残留的秋水仙素溶液和用无菌吸水纸吸干后,切取其根尖膨大部分接入添加 1.0、2.0、3.0 mg/L 6-BA 和 0、0.1、0.2、0.3 mg/L NAA组合的MS培养基中,进行毛状根多倍体的愈伤组织诱导和植株再生。待毛状根多倍体愈伤组织再生产生的丛生芽长至2–3 cm高时,切取丛生芽并置于无外源激素的 MS培养基中进行壮苗及生根诱导,获得再生植株。
1.7 毛状根多倍体再生植株的倍性鉴定
1.7.1 根尖染色体压片法
基本按Martinez-Gomez等[18]的方法进行根尖细胞染色体数目观察。取待鉴定的毛状根多倍体再生植株根尖段放入0.1%秋水仙素溶液中预处理2 h,用蒸馏水冲洗3次,放入卡诺氏固定液中固定20 h,1 mol/L盐酸60 ℃软化处理8 min,蒸馏水冲洗并浸泡20 min,改良石碳酸品红染液染色15 min后,进行压片和镜检;并按以下公式计算多倍体诱导率:多倍体诱导率=多倍体植株数/再生植株总数。
1.7.2 毛状根多倍体再生植株保卫细胞的观察
按陈佰鸿等[19]的透明胶带撕取法进行。分别取同期培养的秋水仙素处理获得的毛状根多倍体再生植株、对照毛状根再生植株 (二倍体)和二倍体野生型植株的成熟叶片,用剪刀剪取叶脉一侧的叶片,把下表皮部分放入透明胶带上,用大拇指用力下压,使下表皮粘于透明胶带上之后,用小镊子轻轻刮去上层的叶肉组织,薄薄的下表皮则平整地粘于透明胶带上。用剪刀将下表皮剪成 0.5 cm2左右的小块,用 1%I-KI溶液染色1 min后,制成临时装片,并在显微镜 (40×物镜) 下统计每个视野中保卫细胞的个数后,再在100×油镜下测量统计每个保卫细胞的大小及每个保卫细胞中叶绿体的数目。每棵植株统计两片叶片及随机测量统计 10个视野,100×油镜下统计10个保卫细胞的大小以及每个保卫细胞中叶绿体的数目。
1.8 毛状根多倍体再生植株次生物质烟碱含量的测定
取非转化 (野生型) 植株、毛状根再生植株(二倍体) 及毛状根多倍体再生植株的叶片,经60 ℃烘干、粉碎、研磨、过100目筛后,精确称取其干燥粉末1.5 g,加入NaOH 0.3 g,甲醇30 mL浸泡1 h,超声波破碎20 min及滤纸过滤后,滤液经0.45 µm滤膜过滤后进行GC-MS测定。
烟碱含量的 GC-MS测定基本参照肖遂等的方法[20]。其测定条件为:电离方式为电子轰击(EI),电子能量70 eV,离子源温度230 ℃,连接管温度280 ℃,溶剂延迟3 min,采用全扫描方式(Scan);升温程序:初温90 ℃,以15 /min℃升至140 ℃,保持20 min,再以15 /min℃升至260 ℃,保持 5 min。GC条件:DB-5MS色谱柱(30 m×0.25 mm×0.25 µm);进样口温度 250 ℃;氢火焰离子检测器温度 280 ℃。载气为 He,流速1.0 mL/min;不分流进样。以烟碱标准品 (Sigma)制作标准曲线,y= 1 388.29x– 7 351 260.48,r2=0.999 6;并依据标准曲线计算样品的烟碱含量。
2 结果与分析
2.1 烟草毛状根诱导与离体培养
未感染的烟草叶片外植体在无外源激素的MS+500 mg/L头胞噻肟钠的固体培养基上连续培养25 d后均不生根, 仅可见大部分的叶片外植体变黄或变褐;或从少部分叶片外植体的形态学下端切口中脉处产生少量浅黄色致密的愈伤组织。经发根农杆菌ATCC15834侵染处理共培养2 d后,烟草叶片外植体边缘略增厚、翘起,并向上卷曲;5 d后从叶片外植体叶脉切口处开始产生白色根原基,并逐渐发育成白色毛状根。15 d后统计,叶片外植体的生根率为100%;平均每个叶片外植体产生3–5条毛状根 (图1A)。
感染20 d后,将3–5 cm长的毛状根切下并分别接种至MS+500 mg/L头胞噻肟钠中进行单根除菌培养。经 4–5次单根除菌培养后,将除菌彻底的毛状根分别接入 MS固体及液体培养基中进行培养。发现毛状根能在无外源激素的MS固体和液体培养基中自主生长,其中固体培养的烟草毛状根缺乏向地性、贴壁生长、侧根多而纤细;而液体培养的毛状根生长速度较固体培养更快,且主根和侧根更粗壮 (图1B和C)。所获得的可自主快速生长的毛状根置于无外源激素的 MS培养基中继代保存,供进行遗传转化鉴定和秋水仙素人工多倍体诱导所使用。
2.2 烟草毛状根遗传转化鉴定
rolB和rolC是发根农杆菌Ri质粒TL-DNA上的两个生根基因。以rolB和rolC的引物分别从烟草毛状根、非转化根基因组DNA及发根农杆菌单菌落扩增产物的电泳结果见图2。从图2可见,利用rolB和rolC的PCR 引物能从烟草毛状根的总DNA 及发根农杆菌ATCC15834 单菌落克隆中分别扩增到期望的540 bp 和770 bp左右的特异性DNA 片段,而从烟草非转化根的总 DNA 中扩增不到任何片段 (图 2)。而图 3为烟草毛状根冠瘿碱的纸电泳检测结果。从图3可见, 上述经rol基因PCR扩增呈阳性的发根农杆菌ATCC15834菌株诱导烟草叶片外植体产生的毛状根能合成甘露碱和农杆碱,而对照根没有检测到农杆碱和甘露碱。这表明发根农杆菌Ri质粒的含rol基因的TL-T-DNA (T-DNA左臂)以及含编码冠瘿碱合成酶基因的 TR-DNA(T-DNA右臂)均已在烟草毛状根基因组中整合和表达。

图1 烟草毛状根诱导、培养及其多倍体诱导和植株再生Fig. 1 Induction and in vitro culture of hairy roots and its polyploidy induction and plant regenerations of Nicotiana tabacum. (A) Hairy roots formation from leaf explants 15 days after infection. (B) Solid culture of hairy roots for 10 days. (C) Liquid culture of hairy roots for 10 days. (D) The swollen root tips after colchicine treatment. (E) Callus induction from hairy root after cultured for 10 days. (F) Adventitious shoot formation from callus after cultured for 30 days. (G) The chromosomes in root tip cell of control plants. (H) The chromosomes in root tip cells of diploid hairy root-derived plants. (I) The chromosomes in root tip cells of polyploid regeneration plant 1. (J) The chromosomes in root tip cells of polyploid regeneration plant 2. (K;N) The guard cells of control plants. (L;O) The guard cells of diploid hairy roots-regenerated plants. (M;P) The guard cells of polyploid-hairy roots regenerated plants. (Q) Control plants. (R) Diploid hairy roots-regenerated plant. (S) Polyploid hairy roots-regenerated plants. (T)Untransformed plants after pot-grown for 30 days. (U) Hairy root-regenerated plants after pot-grown for 30 days. (V)Polyploid hairy root-regenerated plants after pot-grown for 30 days. (W) Untransformed plants after pot-grown for 60 days. (X) Hairy root-regenerated plants after pot-grown for 60 days. (Y) Polyploid hairy root-regenerated plants after pot-grown for 60 days.
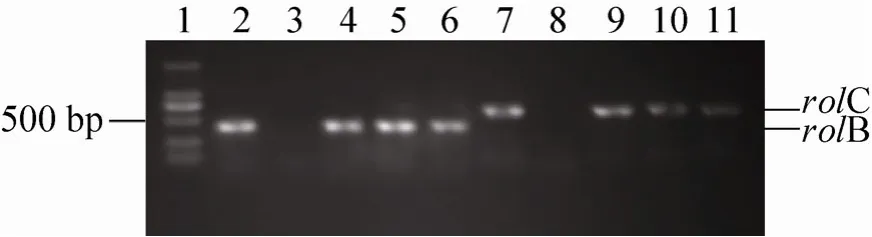
图2 烟草毛状根rol B和rol C基因的PCR扩增产物的凝胶电泳分析Fig. 2 Gel electrophoresis analysis of PCR fragments of rolB and rolC genes amplified from the genome DNA tobacco hairy roots. 1: 2 kb DNA marker; 2–6:fragments with rolB primers; 7–11: fragments with rolC primers; 2, 10: fragments amplified from the strains of A. rhizozgenes ATCC15834; 3, 8: fragments amplified from untransformed roots; 4–6, 9–11:fragments amplified from hairy roots.

图3 烟草毛状根冠瘿碱的纸电泳检测Fig. 3 Detection of opines in tobacco hairy roots by paper electrophoresis. 1, 2: hairy roots extract; 3, 4:normal root extract; 5: standard opines. A: agropine; M:mannopine; N.S: neutral sugars.
2.3 烟草毛状根多倍体的诱导及其植株再生
将上述遗传转化鉴定呈阳性且生长迅速的毛状根根尖段置于不同浓度秋水仙素的 MS培养基中处理12 h后发现,无论秋水仙素浓度高低,烟草毛状根根尖均开始膨大(图 1D),并且随着处理时间的延长,根尖也越来越膨大。而未经秋水仙素处理的毛状根根尖段 (对照) 则随着培养时间的延长,其根尖逐渐伸长,但始终无膨大现象出现。
将毛状根根尖的膨大部分切下并接入添加1.0、2.0、3.0 mg/L 6-BA和0.1、0.2、0.3 mg/L NAA组合的MS培养基及不含任何激素的MS培养基中进行培养后发现,在不含任何激素的 MS固体培养基中毛状根逐渐伸长,并陆续产出侧根,但始终无愈伤组织形成。培养30 d后从起始根段处直接再生出幼芽,40 d后幼芽可长成4–5 cm高的小植株;但再生频率低,约1–2株/瓶。与之相比,当秋水仙素处理膨大的毛状根根尖段在含不同浓度6-BA和NAA的培养基中培养5 d后,根尖开始变得膨大而疏松,逐渐形成浅黄色颗粒状的疏松愈伤组织;20 d后,浅黄色的愈伤组织逐渐变绿并开始形成少量的绿色芽点;随着培养时间的延长,浅黄色愈伤组织块的体积变得越来越大,并产生出更多的绿色芽点 (图1E和F)。然而,在毛状根多倍体植株再生过程中发现,当膨大的毛状根根尖段在仅含6-BA的MS培养基中培养时,随着6-BA浓度的增高,其愈伤组织出现时间越来越早,但所产生的愈伤组织质地较致密,且其随后分化所形成的绿色芽点也较少;而在6-BA和NAA组合的培养基中培养时,不仅膨大的毛状根根尖段产生的愈伤组织长势较好,颜色多呈浅绿色,而且其愈伤组织分化出的绿色芽点也较多。其中,最适合加倍后膨大的毛状根根段愈伤组织诱导及其植株再生的培养基为MS+6-BA2.0 mg/L+NAA0.2 mg/L,在该培养基中不仅诱导产生的愈伤组织体积最大,颜色更绿,而且再分化产生的不定芽数量也最多,长势也最好,其不定芽分化频率达25–30。将产生的绿色丛生不定芽切下、并置于无外源激素的 MS培养基中进行壮苗生根诱导培养10 d后,从其基部产生出较多白色的根,发育成完整植株。
2.4 毛状根多倍体再生植株的倍性鉴定
图1的G、H、I和J为烟草毛状根再生植株及其毛状根多倍体再生植株的根尖染色体倍性鉴定的结果。 从图1G-J可见,对照 (烟草二倍体野生型植株) 与二倍体毛状根再生植株根尖细胞的染色体数均为2n=48;而毛状根多倍体再生植株根尖细胞的染色体条数明显增多,其染色体数为4n=96,表明所获得的烟草毛状根多倍体再生植株为同源四倍体。
表2和图1K、L、M、N、O和P为对照植株、二倍体毛状根再生植株与毛状根多倍体再生植株叶片的保卫细胞大小形态、密度及其叶绿体数目的观察统计结果。由表 2可以看出,未加倍 (二倍体) 毛状根再生植株叶片保卫细胞的大小及其叶绿体数目与对照相比无显著差别,但其保卫细胞密度较大,且叶片颜色更深;而毛状根多倍体再生植株叶片的保卫细胞大小则明显比二倍体大,其长度分别约为对照和二倍体毛状根再生植株保卫细胞的1.64倍和1.71倍,而其宽度则分别约为1.33倍和1.36倍;同时,其保卫细胞的叶绿体数目分别约为对照和二倍体毛状根再生植株的2.02倍和1.86倍;但其叶片保卫细胞的密度则较对照有所降低。这可能是由于与其体积变大,导致在相对的单位面积上保卫细胞密度变小有关。
2.5 毛状根多倍体植株的形态特征及其烟碱含量分析
表 3为烟草毛状根多倍体诱导率的统计结果。从表 3可见,烟草毛状根多倍体诱导的最适条件是0.1%的秋水仙素处理36 h,其毛状根多倍体诱导率约为 64.71%。而从图 1的 Q、R和 S可见,烟草毛状根多倍体再生植株不仅具有明显的毛状根再生植株表型,即叶片略皱缩、节间缩短、根系发达;而且与 (二倍体) 毛状根再生植株相比,毛状根多倍体再生植株的叶色更深绿,叶肉更肥厚,茎杆更粗壮,呈现出常见多倍体的形态特征。图1的T、U、V、W、X和Y为烟草多倍体毛状根再生植株及二倍体毛状根再生植株和非转化野生烟草植株室外栽培30 d和60 d的生长形态。从图1 可见,与对照植株相比,二倍体毛状根再生植株的叶片长度比对照短,而叶片宽度也较对照略变窄;但叶片形态仍正常,植株顶端优势减弱,每个茎节叶腋处的侧芽均发育成侧枝 (图1T和U);而与对照相比,同源四倍体的叶片更宽而厚,但叶片表面呈现部分皱缩 (图1V);此外,对照烟草植株盆栽60 d后顶芽已明显分化出花芽 (图1W),而与对照相比,无论是二倍体的毛状根再生烟草植株还是毛状根多倍体再生植株的开花期明显延迟,盆栽60 d时,其植株仍处于旺盛的营养生长期 (图1X和Y);直至盆栽约81 d后才逐渐产生花芽,而且,所产生的花芽开花后,能形成其种子可正常萌发的烟草果实。
2.6 毛状根多倍体再生植株烟碱含量的测定
表4为盆栽60 d的烟草毛状根多倍体再生植株及其二倍体毛状根再生植株叶片的次生物质烟碱含量的GC-MS测定结果。从表4可见,与对照 (二倍体野生型植株) 相比,经发根农杆菌 ATCC15834诱导产生的烟草毛状根再生植株以及其毛状根多倍体再生植株不仅能合成烟碱,而且其烟碱含量均比对照高;其中以毛状根多倍体再生植株的烟碱含量最高,达到432.52 mg/g (干重),且分别约为对照和二倍体烟草毛状根再生植株的6.90倍和4.57倍。这表明采用毛状根多倍体化可大大提高烟草植株的烟碱含量,从而获得次生物质含量更高的新种质。

表2 多倍体与二倍体植株保卫细胞大小、密度及其保卫细胞叶绿体数目的比较Table 2 Comparison of the size, density and number of chloroplasts of guard cells between polyploid and diploid plants

表3 烟草毛状根多倍体诱导率Table 3 Induction rate of polyploid through polyploidization with hairy roots of N. tabacum

表4 烟草毛状根多倍体再生植株烟碱含量的测定Table 4 Detection of nicotine content in polyploid hairy roots regenerated plants
3 讨论
至今为止,应用秋水仙素人工诱导染色体加倍来获得植物多倍体新种质已在莨菪Hyoscyamus niger[4]、丹参Salvia miltiorrhizaBge.[21]和可乐豆木Colophospermum mopane[22]等多种药用植物以及百合Hemerocallis flavaL.[2]和仙客来Cyclamen persicum[23]等花卉植物中获得成功。然而,在人工诱导植物多倍体时,大都用化学诱变剂秋水仙素处理植物的叶片[6]或愈伤组织[7]、根段[8]或生长点[9]来进行多倍体诱导;极少见利用可自主生长、单细胞起源的毛状根作为倍性诱导起始材料的研究报道;也未见利用毛状根多倍体化来获得经济植物烟草毛状根多倍体及其再生植株的研究报道。在本实验中,用秋水仙素处理烟草毛状根不仅可获得其毛状根多倍体及其再生植株,而且所产生的多倍体易筛选,且多倍体诱导率也较高;这表明可自主生长的毛状根完全可用作人工多倍体诱变的良好起始材料。已有的研究表明,与原植物 (二倍体植株) 相比,由于染色体加倍,多倍体植株的农艺性状通常都有明显的变化,突出表现在根、茎、叶和花等器官上具有“巨型性”,而产生出较大的营养器官和繁殖器官[2-3,24]。同时还发现,虽然不同植物多倍体的生理功能不一致,但通过物种的染色体数目加倍,大都能增强植物的次生代谢;导致多倍体植株通常都具有较高的次生物质含量[4-5];如怀牛膝Achyranthes bidentata同源四倍体药用部位根干重显著高于二倍体植株,而其主要次生物质蜕皮激素的含量则较原植物高10倍之多[25]。而在本实验中,烟草毛状根多倍体植株不仅在外形上具有巨型性,叶片叶色浓绿,叶片大而肥厚,茎杆粗壮,而且其多倍体再生植株中主要次生物质烟碱含量也显著提高,分别为毛状根再生植株 (二倍体) 和对照 (野生植株) 的 4.57倍和6.90倍。此外,De Jesus-Gonzalez & Weathers等用秋水仙素诱导染色体加倍技术也获得了青蒿素含量比其二倍体毛状根高 6倍的同源四倍体青蒿Artemisia annuaL.毛状根[12];而这与本实验的结果类似。这表明,用单细胞起源、可自主生长的毛状根不仅可作为多倍体诱导的良好起始材料,而且通过其人工多倍体化还可以改变其生长形态,大幅提高其次生物质含量,达到创新其种质和改良其植物性状和品质的育种目的。
以往的研究表明,在秋水仙素人工诱导多倍体时,其多倍体的诱导率高低与植物类型、组织或器官特性以及秋水仙素的作用浓度和处理时间长短等有关[24,26]。如张海凤等[27]发现,以 0.1%秋水仙素处理杜仲Eucommia ulmoidesOliv.籽苗生长点时,处理12 h后达到最佳诱变效果,其多倍体诱导率 36.7%;但同样浓度的秋水仙素处理非洲菊Gerbera jamesonii丛生芽时,则以秋水仙素处理48 h的诱导效果最佳[26]。然而,在比较秋水仙素浓度和作用时间对 3种紫薇幼苗染色体加倍的效果时,0.5%和0.8%的秋水仙素处理紫薇Lagerstroemia indica和银薇L. indica Linn. f. alba 48–96 h后,其植株多倍体诱导率均较高,其中以0.5%秋水仙素处理紫薇72 h的多倍体最高,达54.17%[28]。而这与本实验利用秋水仙素处理烟草毛状根来进行毛状根多倍体诱导的结果不一致。在本实验中,当采用不同浓度秋水仙素溶液进行烟草毛状根多倍体诱变处理时,其多倍体诱导的最适条件是0.1%的秋水仙素处理36 h,其毛状根多倍体诱导率最高,约为64.71%。然而,用秋水仙素人工加倍处理获得四倍体青蒿毛状根时,则以0.25%或者0.5%的秋水仙素处理7 d的诱变效果最好,多倍体诱导率可达1%[12]。而这与本实验的结果不一致。这种差异的产生可能表明,秋水仙素人工诱导多倍体的效率高低或秋水仙素使用浓度高低可能与植物种类、外植体类型及其毛状根的生长特性等有关。
目前对植物多倍体的倍性鉴定最常用的方法是根尖细胞染色体倍性观察和气孔大小和形态等方法进行鉴定[12,28];但一些研究表明,以保卫细胞叶绿体数为基础的倍性鉴定也可作为一种快速、简便的倍性鉴定方法[29]。而在本实验中,通过毛状根根尖压片观察,发现烟草二倍体植株的细胞染色体数为2n=48,而所产生的毛状根多倍体再生植株为四倍体,其细胞染色体数为4n=96;同时发现,烟草二倍体和四倍体植株叶片的保卫细胞叶绿体数目比值与其染色体数比一致,均为 1∶2;这也表明,以保卫细胞叶绿体数目多少也可作为鉴定烟草多倍体植株染色体倍性鉴定的快速而可靠的辅助方法。
已有的研究表明,发根农杆菌 Ri质粒的T-DNA(含有 4个生根基因 rolABCD的 T-DNA区)片段在植物细胞核基因组中插入、整合及稳定表达后所产生的可自主快速生长毛状根,不仅可用来生产植物的次生物质[10-11];同时,由于所产生的毛状根能够或很容易通过组织培养技术再生出转化植株[30-31],因而也可用来生产转基因植株,用作植物种质创新、新品种培育及性状改良的有效工具;如能从毛状根再生植株中筛选到表型正常 (即不出现通常的叶片皱缩转化表型) 但花瓣颜色构成发生变化的长春花Catharanthus roseusL.[32];或筛选到生长习性和观赏性状发生变异的植株,如矮化、开花习性发生改变 (如两年生开花植物变为一年生开花或每年开花的植物) 的比利时菊苣Cichorium intybus和胡萝卜转化植株[33-34];或利用含发根农杆菌rolC基因的遗传转化,获得花期提早(前) 的碧冬茄Petunia hybrida植株[35];或从毛状根再生植株中获得无需春化诱导即可成花的菊苣Cichorium intybusL.新品种[36];或获得其花冠形状和株型改变的花卉植物高原龙胆Eustoma grandiflorum新株系[37];或培育出更具优良观赏性状的花卉植物紫高杯花Nierembergia scoparia毛状根转化植株[38],达到改良和培育植物新品种或创新其种质的目的。然而在本实验中,与对照相比,无论是二倍体烟草毛状根再生植株,还是多倍体毛状根再生植株也都能正常开花和结果;但其植株开花期均约比对照推迟21 d;这与Winefield等[35]仅用发根农杆菌rolC基因对碧冬茄遗传转化获得花期提早 (前) 的碧冬茄植株的结果不一致。而这种差异的产生可能与植株种类、毛状根类型以及rol基因种类等有关。而对于以收获营养器官为种植目的的烟草而言,本实验所获得的开花期较对照 (非转化植株) 大幅推迟,也即营养生长期明显延长的烟草二倍体毛状根再生植株和毛状根多倍体再生植株,将可能具有提高烟草产量的潜力。
本文结果表明,可自主生长的烟草毛状根不仅可作为多倍体诱导的良好起始材料,而且能够达到创新种质和改良植物性状和品质的育种目的。为今后开展利用烟草毛状根多倍体再生植株来提高烟草的产量和品质以及利用毛状根多倍体化来进行植物种质创新和性状改良奠定了实验和技术基础。
[1]Paterson AH. Polyploidy, evolutionary opportunity,and crop adaptation. Genetica, 2005, 123: 191–196.
[2]Chen CH, Goeden-Kallemeyn YC.In vitroinduction of tetraploid plants from colchicines-treated diploid daylily callus.Euphytica, 1979, 28: 705–709.
[3]Adaniya S, Shira D.In vitroinduction of tetraploid ginger (Zingiber officinalisRoscoe) and its pollen fertility and germinability. Sci Horti, 2001, 88(4):277–287.
[4]Lavania UC, Srivastava S. Enhanced productivity of tropane alkaloids and fertility in artificial autotetraploids ofHyoscyamus niger.Euphytica,1991, 52(2): 73–77.
[5]Dhawan OP, Lavania UC. Enhancing the productivity of secondary metabolites via induced polyploidy: a review. Euphytica, 1996, 87(2):81–89.
[6]Gu XF, Luo ZR. Regeneration of dodecaploid plants fromin vitroleave of “Luotian Tianshi”Persimmon treated with colchicine. Acta Horticul Sin, 2003, 30(3): 325–327 (in Chinese).
谷晓峰, 罗正荣. 秋水仙素处理-罗田甜柿获得12 倍体再生植株. 园艺学报, 2003, 30(3):325–327.
[7]Chen BJ, Gao SL, Bian YY. The induction of autotetraploid ofScutellaria baicalensisGeorgi by tissue culture. J Plant Resource Environ, 2000,9(1): 9–11 (in Chinese).
陈柏君, 高山林, 卞云云. 黄芩组织培养同源四倍体的诱导. 植物资源与环境学报, 2000, 9(1):9–11.
[8]Wang XH, Tan XF. Study ofGerbera jamesoniiinducing polyploid plants with colchicine. J Central South Forest Univ, 2005, 25(4): 57–61 (in Chinese).
王晓红, 谭晓风. 用秋水仙碱诱导非洲菊多倍体的研究. 中南林学院学报, 2005, 25(4): 57–61.
[9]Qian CZ, Wu MS, Dai FB, et al. Studies on polyploid breeding ofIsatis indigoticaFort. Acta Bot Sin, 1989, 31(9): 678–683 (in Chinese).
乔传卓, 吴美枢, 戴富宝, 等. 菘蓝多倍体育种的研究. 植物学报, 1989, 31(9): 678–683.
[10]Inoue F, Sugiura H, Tabuchi A, et al. Alteration of essential oil composition in transgenic Peppermint(Menthapiperita) carrying T-DNA fromAgrobacterium rhizogenes. Breed Sci, 2003, 53(2):163–167.
[11]Santos PAG, Figueiredo AC, Oliveira MM, et al.Growth and essential oil composition of hairy root cultures ofLevisticum officinaleW.D.J. Koch(lovage). Plant Sci, 2005, 168(4): 1089–1096.
[12]De Jesus-Gonzalez L, Weathers PJ. TetraploidArtemisa annuahairy roots produce more artemisinin than diploids. Plant Cell Rep, 2003, 21:809–813.
[13]Shi HP, Huang QS. Tissue culture and plantlet regeneration from leaves ofNicotiana tabacum.Subtropical Plant Sci, 2003, 32(4): 63 (in Chinese).
施和平, 黄群声. 烟草叶片组织培养及植株再生.亚热带植物科学, 2003, 32(4): 63.
[14]Murashige T, Skoog F. A revised mediumfor rapid growth and bioassays with tobacco tissue culture.Physiol Plant, 1962, 15: 473–497.
[15]Edward K, Johnstone C. A simple and rapid method for the preparationn of plant genomic DNA for PCR analysis. Nucleic acids Res, 1991, 19(6):1349.
[16]Furner IJ, Huffman GA, Amasino RM, et al. AnAgrobacteriumtransformation in the evolution of genusNicotiana. Nature, 1986, 319: 422–427.
[17]Ellis D, Roberts D, Sutton B, et al. Transformation of whit e spruce and other conifer species byAgrobacterium tumefaciens. Plant Cell Rep, 1989,8: 16–20.
[18]Martinez-Gomez P,Sanchez-Perez R, Vaknin Y, et al. Improved technique for counting chromosomes in almond. Sci Horticul, 2005, 105(1): 139–143.
[19]Chen BH, Li XS, Cao ZY, et al. A method for observing stoma by transparent gummed tape to tear epidermis from leaf. Plant Physiol Comm,2004, 40(2): 215–218 (in Chinese).
陈佰鸿, 李新生, 曹孜义, 等. 一种用透明胶带粘取叶片表皮观察气孔的方法. 植物生理学通讯, 2004, 40(2): 215–218.
[20]Xiao S, Zhou JH, Yang HQ, et al. An improvement of method for tobacco alkaloids determination by chromatography-mass spectrometry. J Hunan Agri Univ: Nat Sci Ed, 2010, 36(1): 22–25 (in Chinese).
肖遂, 周冀衡, 杨虹琦, 等. 气-质联用(GC/MS)法测定烟草生物碱的方法优化. 湖南农业大学学报: 自然科学版, 2010, 36(1): 22–25.
[21]Gao SL, Zhu DN, Cai ZH, et al. Autotetraploid plants from colchicines-treated bud culture ofSalvia miltiorrhizaBge. Plant Cell Tiss Org Cult,1996, 47(1): 73–77.
[22]Rubuluza T, Nikolova RV, Smith MT, et al.In vitroinduction of tetraploids inColophospermum mopaneby colchicine. South Afri J Bot, 2007,73(2): 259–261.
[23]Takamura T, Miyajima I. Colchicine induced tetraploids in yellow-flower cyclamens and their characteristics. Sci Hortic, 1996, 65(4): 305–312.
[24]Zhang ZS, Li YH, Jiang L, et al.In vitrotetraploid induction and its identification inAnthurium andraeanum. Acta Horticul Sin, 2007, 34(3):729–734 (in Chinese).
张志胜, 黎扬辉, 姜蕾, 等. 红掌四倍体的离体诱导及其鉴定. 园艺学报, 2007, 34(3): 729–734.
[25]Lü SM, Liang KJ, Ge CJ, et al. Studies on polyploid breeding ofAchyranthes bidentataBL.China J Chin Mater Med, 1988, 1(7): 11–14 (in Chinese).
吕世民, 梁可钧, 葛传吉, 等. 怀牛漆多倍体育种的研究. 中药通报, 1988, 1(7): 11–14.
[26]Li H, Yan B, Zhang T, et al. Preliminary studies on polyploidy mutation of cut flowerGerbera jamesoniiBolus. Acta Horticul Sin, 2009, 36(4):605–610 (in Chinese).
李涵, 鄢波, 张婷, 等. 切花非洲菊多倍体诱变初报. 园艺学报, 2009, 36(4): 605–610.
[27]Zhang HF, Guo BL, Zhang CH, et al. Induction and identification of tetraploids inEucommia ulmoidesOliv. Acta Horticult Sin, 2008, 35(7): 1047–1052(in Chinese).
张海凤, 郭宝林, 张成合, 等. 杜仲四倍体的诱导与鉴定. 园艺学报, 2008, 35(7): 1047–1052.
[28]Tong J, Ye YM, Feng B, et al. Colchicines induced polyploid plants and their identification in three species ofLagerstroemia indica. Acta Horticul Sin,2009, 36(1): 127–132 (in Chinese).
童俊, 叶要妹, 冯彪, 等. 秋水仙素诱导三种紫薇多倍体的研究. 园艺学报, 2009, 36(1):127–132.
[29]Liu RX, Huang Y, Lu YX, et al. Quick identification of tobacco pollen plants’chromosomes ploidy in seeding stage. J Hunan Agri Univ: Nat Sci Ed, 2008, 34(5): 541–544 (in Chinese).
刘仁祥, 黄莺, 陆永旭, 等. 烟草花粉植株染色体倍性苗期快速鉴定. 湖南农业大学学报: 自然科学版, 2008, 34(5): 541–544.
[30]Xu HW, Zhou XF, Lu JM, et al. Hairy roots induced byAgrobacterrium rhizogenesand production of regenerative plants in hairy root cultures in Maize. Sci China C: Life Sci, 2005,35(6): 497–501 (in Chinese).
徐洪伟, 周晓馥, 陆静梅, 等. 发根农杆菌诱导玉米毛状根发生及再生植株. 中国科学 C辑,2005, 35(6): 497–501.
[31]Christensen B, Sriskandarajah S, Serek M, et al.Transformation ofKalanchoe blossfeldianawith rol-genes is useful in molecular breeding towards compact growth. Plant Cell Rep, 2008, 27:1485–1495.
[32]Choi PS, Kim YD, Choi KM, et al. Plant regeneration from hairy root cultures transformed by infection withAgrobacterium rhizogenesinCatharanthus roseus. Plant Cell Rep, 2004, 22(11):828–831.
[33]Sun LY, Touraud G, Charbonnier C, et al.Modification of phenotype in Belgian endive(Cichorium intybus) through genetic transformation byAgrobacterium rhizogenes: conversion from biennial to annual flowering. Transgenic Res, 1991,1: 14–22.
[34]Limari MA, Sun LY, Douat C, et al. Natural genetic transformation byAgrobacterium rhizogenes: annual flowering in biennials, Belgian endive and carrot. Plant Physiol, 1998, 118(2):543–550.
[35]Winefield C, Lewis D, Arathoon S, et al. Alteration of Petunia plant form though the introduction of the rolC gene fromAgrobacterium rhizogenes. Mol Breed, 1999, 5: 543–551.
[36]Kamada H, Saitou T, Harada H. No requirement of vernalization for flower formation in Ri-transformed Cichorium plants. Plant Tiss Cult Lett, 1992, 9(3): 206–208.
[37]Handa T, Sugimura T, Kato E. Genetic transformation ofEustoma grandiflorumwithrolgenes. Acta Horticult, 1995, 392: 209–218.
[38]Godo T, Tsujii O, Ishikawa K, et al. Fertile transgenic plants ofNierembergia scopariasendmer obtained by a mikimopine type strain ofAgrobacterium rhizogenes. Sci Horticult, 1997, 68:101–111.

