银川地区规模化牛场奶牛衣原体病与布鲁菌病的血清学调查
李永琴,赵世媛,高菊梅,黄 龙,刘溪源,李晓娜,许立华
(宁夏大学农学院,宁夏银川750021)
衣原体为专性细胞内寄生菌,其广泛存在于世界各地,可以引起动物和人的多种疾病,特别是鹦鹉热嗜性衣原体和流产嗜性衣原体能够使禽类和多种动物感染,引起一种地方流行性的接触性人畜共患传染病[1-2]。妊娠母牛感染衣原体后在临床上表现为流产、早产、死产、产出弱犊、胎衣不下等繁殖障碍症状,有的甚至发生子宫内膜炎、乳房炎、输卵管炎及产奶量下降。新生犊牛表现出肠炎、多关节炎、支气管肺 炎、腹泻等症状[3-4]。1949 年Stamp 和Nisbeth首次在苏格兰报道了该病的发生[5],随后我国于20世纪70年代从羊身上分离到了衣原体,之后有关衣原体病的报道不在少数。周继章等[6]2007年统计有11个省(市)报道有牛衣原体病的流行,随后青海[7-8]、宁夏[9]、贵州[10]等省(区)也有血清学调查报道,这些从一个侧面反映了动物衣原体病的的流行在不断的上升。牛衣原体病给奶牛场造成的损失不仅仅是胎儿夭折,更严重的是产奶量与正常分娩牛相比,大幅度减少,同时造成饲料、人力巨大浪费和巨额医药费开支。对养殖业尤其是对奶牛业造成重大危害。
布鲁菌病是由布鲁菌引起的人兽共患慢性细菌性传染病。布鲁菌病在全世界范围内广泛分布。据世界卫生组织调查,在全世界200 多个国家中,有170多个国家和地区发现人、畜布鲁菌病的存在和流行。全球有布鲁菌病患者近100万例,而且每年以新发病例1万~2万例的速度增加[11]。在我国,布鲁菌病是国家规定的二类法定传染病,布鲁菌病的流行情况亦不容乐观。据报道,截止2010年全国29个省(区、市)发生畜间布鲁菌病,牛、羊、猪感染达百万头之多,人间布鲁菌病2010年全年新增病例3.7万例[12]。
布鲁菌可通过体表皮肤黏膜、消化道、呼吸道,也可由吸血蚊虫叮咬而侵入机体[13]。主要危害生殖器官,在家畜中,牛、羊、猪最常发生,还可传染给人和其他家畜。其特征是生殖器官和胎膜发炎,引起流产、不育和各种组织的局部炎症等特征症状[14]。我国每年因该病造成的经济损失也达数亿元。该病危害大、流行广,不仅影响奶牛业的健康发展,也严重威胁人类健康,是目前世界上严重的公共卫生问题之一,并被世界动物卫生组织(OIE)列为必须报告的动物疫病[15]。
近期银川一些规模化奶牛场部分奶牛出现疑似衣原体病、布鲁菌病的症状,为了确诊其病因,了解近期银川地区衣原体病及布鲁菌病的流行情况,制定牛群的防控方案。笔者及课题组成员对牛群进行衣原体与布鲁菌病的血清学检测。现将检测结果进行报告。
1 材料与方法
1.1 材料
1.1.1 待检血清 自银川地区A、B、C、D、E、F 6个规模化奶牛养殖场,随机抽取了244份血样,无菌分离血清,4 ℃下保存备用。
1.1.2 试剂 衣原体IHA 稀释液,批号130905;衣原体IHA 标准阳性血清,批号:1301115;衣原体IHA 标准阳性血清,批号:1301115。衣原体IHA抗原,批号:130524。以上试剂均由中国农业科学院兰州兽医研究所研制。布鲁菌平板凝集抗原及试管凝集抗原,易邦公司产品。
1.1.3 试验器械 96 孔V 型反应板、5μL~100μL移液器、玻璃板、微量振荡器、恒温箱、冰箱。
1.2 方法
1.2.1 衣原体间接血凝(IHA)试验 ①铺板:用移液器在96孔110°V 型反应板上每孔加衣原体IHA稀释液75μL;②稀释血清:用移液器吸取25μL 待检血清加入第一孔,然后以4倍递增稀释,从第一孔稀释到第三孔,到第三孔弃去25μL,保持孔内液体量为75μL。同一板上同时设阳性、阴性和空白对照各2组(稀释方法同上);③加入抗原:每孔加入稀释好的抗原25μL,置于微量振荡器上振荡2 min,之后盖上玻璃板,置于37 ℃恒温箱中作用2h。
1.2.2 衣原体间接血凝(IHA)试验结果判定 ①判定标准:“++++”红细胞全部凝集,形成一层均匀的膜,布满整个孔底;“+++”红细胞在孔底形成一层薄膜,面积比前者稍小;“++”红细胞在孔底形成薄层凝集,边缘松散或呈锯齿状;“+”红细胞在孔底呈稀薄、散在、少量凝集,孔底有小圆点;“±”红细胞沉于孔底,但周围不光滑或中心有空斑;“-”红细胞完全沉积于底,呈光滑的圆点;“++”以上的凝集判为阳性凝集,②对照试验出现如下结果试验方可成立,否则需要重试,阳性血清+抗原呈“++++”;阴性血清+抗原呈“-”;抗原+生理盐水呈“-”,③被检样品判定标准:哺乳动物血清效价≥1∶64(++)者判为阳性;效价≤1∶16(++)者判为阴性;介于二者之间判为可疑。
1.2.3 布鲁菌病虎红平板凝集试验 ①检测方法:按照农业部颁发的《中华人民共和国国家标准动物布鲁菌病诊断技术》中规定的技术要求进行操作,血清以布鲁菌病虎红平板凝集试验(RBPT)初筛,吸取20μL滴于洁净玻璃板上,加入20μL虎红平板凝集抗原,混匀后4min,阳性或疑似阳性的样品用布鲁菌病试管凝集试验(SPT)方法进行确认;②判断标准 以出现50%凝集(++)的血清最大稀释度作为该被检血清的凝集价,当凝集价1∶100以上时判为阳性,1∶50~1∶100之间判为可疑,1∶50以下判为阴性。
2 结果
2.1 衣原体间接血凝(IHA)试验结果
对银川地区6个规模化牛场244份血清样品进行检测,结果显示,检测的244份血清中,阳性总检出率为25%,牛群最高检出率为38.3%,最低为0(表1)。
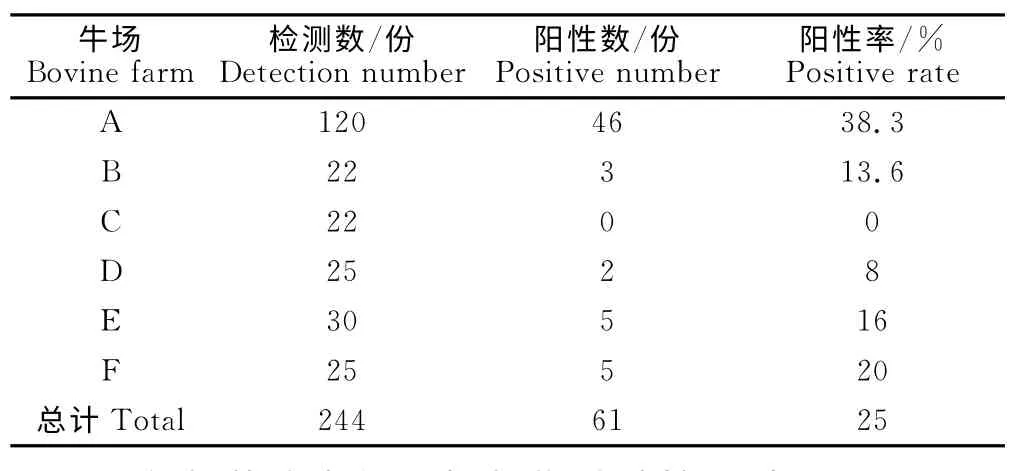
表1 衣原体间接血凝(IHA)试验结果Table 1 The result of Chlamydia indirect hemagglutination test
2.2 布鲁菌病虎红平板凝集试验检测结果
对银川地区6个规模化牛场244份血清样品进行布鲁菌病虎红平板凝集试验检测,结果显示,244份血清中布鲁菌阳性总检出率为34.3%,牛群最高阳性检出率为66.6%,最低阳性检出率为12%(表2)。
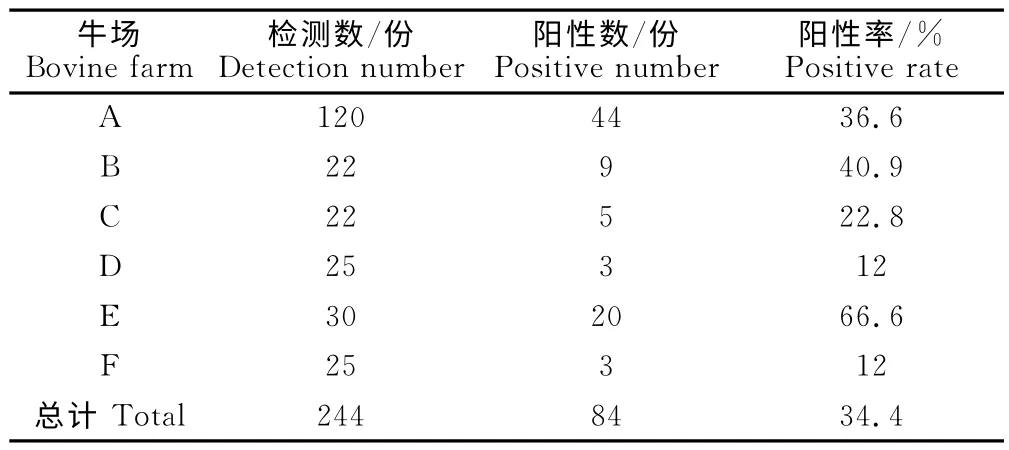
表2 布鲁菌病虎红平板凝集试验和试管凝集试验检测结果Table 2 The results of rose bengal plate agglutination and tube agglutination test for brucellosis
3 讨论
通过对银川地区6个规模化养殖场进行衣原体的血清学抽检调查,结果表明,在这244份血清中平均阳性率为25%,牛群最高阳性率为38.3%,最低为0。这与何存利等[16]的调查结果基本一致。近一段时间,银川地区这些规模化牛场的部分奶牛出现不同程度的率配不孕、流产、早产或死产等繁殖障碍症状,并伴有呼吸道症状,产奶量也不同程度下降。而且不同程度地存在犊牛肺炎、肠炎、关节炎的症状。在此之前进行的细菌学检测以及牛病毒性腹泻-黏膜病的检测都不能确定其主要病因。本次衣原体的血清学检测说明衣原体感染在银川地区已然存在广泛,一些牛场母畜发生的繁殖障碍可能与衣原体的感染有关,并且有可能是造成母畜不孕、早产以及犊牛肠炎、关节炎等的主要原因之一。规模化养殖场应对奶牛衣原体的感染予以高度重视。
衣原体病的综合防控方面,笔者建议重点从以下几方面着手:①严格贯彻执行兽医防疫卫生措施,加强饲养管理,注意清洁卫生,减少应激因素对牛群的不良影响,一旦发现流产、死胎,对胎儿、胎膜、子宫排出物等进行无害处理和彻底消毒。对已污染的畜棚、环境用20mL/L~50mL/L来苏儿或20g/L氢氧化钠等有效消毒剂迸行严格消毒,以有效控制该病传染的机会;②加强检疫工作力度,力求从源头上净化牛群。由于该病在临床感染上经常以隐性感染为主,很少引起明显症状,而且隐性感染牛可长期带毒,引起衣原体病的传播与暴发[17]。因此,规模化养殖场应当定期进行衣原体血清学检测,检出阳性牛应及时淘汰或治疗,以彻底净化牛群。并且牛场从外引进奶牛时,必须加强检疫,对新引进的牛群应采取隔离观察措施,防止疫病传入。对于检出疑似的牛,可用四环素类药物(如长效土霉素)进行及时治疗;③把衣原体病的免疫接种和防控工作纳入牛场主要工作议程,定期对牛群进行衣原体的预防接种。
通过对采集的244 份血清进行布鲁菌病的检测,结果显示,阳性有84份,平均阳性率为34.3%,牛群最高阳性率为66.6%,最低为12%。此次调查结果与张永康等[18]的调查结果相比,阳性率较高。但是我们不能确定是因为布鲁菌病在牛群中的感染率上升而引起。因为目前银川地区的养殖场普遍都进行针对布鲁菌病的弱毒疫苗接种,对布鲁菌病检出阳性者,存在两种可能,一种是自然感染布鲁菌病的牛,另一种是接种过弱毒疫苗的牛。因为当前的布鲁菌病虎红平板凝集试验及试管凝集试验并不能对这两种可能进行判别。但检测结果显示的阴性结果过多,由于在进行布鲁菌病调查之前,牛场都不同时间进行了布鲁菌病的弱毒疫苗接种。所以对于检测结果出现的过多阴性,说明疫苗在牛群中的免疫保护力及保护期未达到预期效果。这样就使得牛群中存在着布鲁菌病的大量易感牛,牛群感染布鲁菌病的机率较大。检测结果为阳性的牛中就有可能存在着自然感染布鲁菌病牛,并成为牛群中的传染源,感染牛群,造成母畜繁殖障碍。所以此次银川地区规模化牛场出现的母畜繁殖障碍就有可能与布鲁菌的感染有关。所以为了防控此类疫情的发生,养殖场必须实行以加强检疫净化为主的综合性防御措施。需要对牛群中布鲁菌的抗体消长水平进行实时监测,避免牛群中出现易感牛;可通过进一步的酶联免疫吸附试验确定有无自然感染牛,若存在则需淘汰;牛场需在外引进牛时,必须加强检疫,确保牛只健康后方可合群。
针对本次银川地区出现的疫情,我们了解到衣原体已在银川地区这些规模化牛场中存在广泛。虽然之前也有对银川地区衣原体病的相关报道,但并未引起本地区养殖企业对其重视,因此此次疫情给养殖场带来了比较严重的经济损失。本次血清学调查虽并不能确定布鲁病是为本次疫情的主要原因之一,但是它所存在的安全隐患不容忽视。衣原体病与布鲁病均为严重危害人类及家畜健康的人畜共患病,若同时存在与场群之中,将严重影响养殖场的经济效益以及养殖人员的公共卫生安全。因此,养殖企业需对这两种疾病引起一定的重视,及时进行疫情的防控与治疗。
[1]陈溥言.家畜传染病学[M].5版.北京:中国农业出版社,2008.
[2]Hinton D G,Shipley A,Galvin J W,et al.Chlamydiosis in workers at a duck farm and processing plant[J].Aus Vet J,1993,70(5):174-176.
[3]张作秀.格尔木地区牦牛衣原体病的血清学调查[J].青海畜牧兽医杂志,2012,42(1):17-18.
[4]钟卫东.民和县奶牛衣原体病的血清学调查[J].青海畜牧兽医,2013,43(2):32-33.
[5]李 娟,李德寿.青海省海晏县绵羊衣原体病的血清学调查[J].中国动物检疫,2011,28(6):59.
[6]周继章,邱昌庆.我国家畜衣原体病流行状况[J].中国畜牧兽医,2007,34(7):110-112.
[7]铁富萍.绵羊衣原体病的血清学调查[J].中国畜牧兽医,2010,37(4):234-235.
[8]张永兰,李 春.海晏县牛羊衣原体病的血清学调查[J].黑龙江畜牧兽医,2011(6):79-80.
[9]何存利,史 晓,张皓弘.宁夏鹦鹉热衣原体血清学调查[J].上海畜牧兽医通讯,2009(5):25.
[10]洪尼宁,颜修刚,皮 泉,等.贵州省牛羊衣原体感染血清学调查[J].动物医学进展,2012,33(11):127-129.
[11]邢 进,王金锋,赵宝华.布鲁菌病及其诊断方法研究进展[J].动物医学进展,2009,30(3):69-73.
[12]徐春志,方 英,蔺俐仲,等.奶牛布鲁菌病三种血清学诊断方法的比较研究[J].动物医学进展,2014,35(3):125-127.
[13]王天坤,姚学军,赵长光,等.奶牛布病的防控措施[J].中国畜牧业.2013(15):85-86.
[14]候宝华,乔平平,党志喜.奶牛布病防制主要技术措施[J].中国牛业科学.2010,36(6):100-101.
[15]Godfroid J.Brucellosis in wildlife[J].Rev Sci Tech Off In Epiz,2002,21(2):277-286.
[16]何存利,史 晓,张皓弘.宁夏鹦鹉热衣原体血清学调查[J].上海畜牧兽医通讯,2009(5):25-26.
[17]Takahashi T,Takashima I,Hashimoto N.Shedding and transmission ofChlamydia psittaciin experimentally infected chickens[J].Avian Dis,1999,32:650-658.
[18]张永康,吴 娥.宁夏地区奶牛衣原体病和布病的血清学调查[J].黑龙江畜牧兽医,2013(2):87-88.

