日本脑炎病毒NS3蛋白酶活性检测及抑制剂高通量筛选方法的建立
周景云,汪雪,裴超,宋云峰,陈焕春1 华中农业大学农业微生物学国家重点实验室,湖北 武汉 430070 华中农业大学动物医学院,湖北 武汉 430070
动物及兽医生物技术
日本脑炎病毒NS3蛋白酶活性检测及抑制剂高通量筛选方法的建立
周景云1,2,汪雪2,裴超2,宋云峰1,2,陈焕春1,2
1 华中农业大学农业微生物学国家重点实验室,湖北 武汉 430070 2 华中农业大学动物医学院,湖北 武汉 430070
日本脑炎病毒 (Japanese encephalitis virus,JEV) 是单股正链RNA病毒,全基因组仅含有一个开放阅读框,编码一条多聚蛋白前体,病毒编码的NS3蛋白酶在JEV多聚蛋白加工过程中起着重要作用,是重要的药物靶标。通过PCR扩增了NS2BH-NS3蛋白酶的编码区,构建了原核表达质粒并转化到大肠杆菌BL21 (DE3),经IPTG诱导得到可溶性的NS3蛋白酶,用镍亲和层析方法进行了纯化。建立了基于荧光共振能量转移的NS3蛋白酶活性检测方法,并确定了最佳的反应条件,对113个化合物进行了筛选,发现其中两个化合物对JEV NS3蛋白酶具有一定的抑制活性。本研究为JEV NS3蛋白酶的活性研究及抑制剂筛选提供了一种操作方便、成本低廉的方法。
日本脑炎病毒,NS3蛋白酶,可溶性表达,酶活性,抑制剂高通量筛选
日本脑炎病毒 (Japanese encephalitis virus, JEV) 是由蚊虫媒介传播的嗜神经病毒,为黄病毒科黄病毒属成员之一。JEV主要在亚洲流行并造成较大的危害[1-2],其感染猪后导致母猪流产,产死胎、木乃伊胎等繁殖障碍,公猪多发生睾丸炎,给我国的养猪业造成了巨大经济损失[3]。同时JEV可感染人引起急性脑炎,造成较高的致死率和致畸率,严重威胁人类的健康[4-6]。2006年,日本脑炎病毒在我国山西运城流行,导致66人感染,其中19人死亡[7],造成了较大的社会影响。尽管目前有商业化的日本脑炎病毒疫苗[8-9],但还没有有效的药物和特异性疗法来治疗JEV感染。因此寻求特异性针对JEV的药物和治疗方法具有重要的意义[10]。
JEV NS3的N端180个氨基酸与NS2B形成二聚体,具有丝氨酸蛋白酶功能[11-12]。JEV基因组仅编码一个开放阅读框,翻译为一条聚蛋白[13],聚蛋白的切割是依靠各种蛋白酶完成的,其中NS3蛋白酶负责切割大部分区域,包括C-prM、NS2A-NS2B、NS2B-NS3、NS3-NS4A、NS4A-NS4B、NS4B-NS5等,其他位置由弗林蛋白酶和一些未知蛋白酶进行切割[14]。JEV NS3蛋白酶的活性位点主要由NS3中His51、Asp75、Ser135三个氨基酸形成催化三角体[15],这3个氨基酸在丝氨酸蛋白酶中高度保守。NS2B的膜外区与NS3相互结合,使底物易于进入其催化位点[16]。由于JEV NS3蛋白酶在病毒复制周期中的重要功能,且其与宿主蛋白酶的同源性低,因此已成为黄病毒中具有潜力的药物靶标。本研究在原核细胞中表达了可溶的NS3蛋白酶,用荧光共振能量转移方法建立了酶活性检测方法[17],并在微孔板中建立了基于蛋白酶活性的抑制剂筛选方法,进行了初步应用。

表1 PCR引物序列Table 1 Primer sequences
1 材料与方法
1.1 材料
质粒pET-30a(+)由本实验室保存。感受态细胞E. coli DH5α、E. coli BL21 (DE3)购自北京全式金生物技术有限公司。IPTG、氨苄青霉素、卡那霉素购自默克公司。酵母提取物、胰蛋白胨购自OXOID公司。限制性内切酶BamHⅠ、XhoⅠ、Taq DNA聚合酶、dNTPs、T4 DNA连接酶均购自宝生物工程 (大连) 有限公司。Aprotinin、咪唑购自Sigma-Aldrich公司,Tris-base和甘氨酸购自AMERSCO公司。用于酶抑制活性筛选的化合物购自Specs公司。
1.2 方法
1.2.1 NS2B-NS3基因的扩增
根据NS2B和NS3基因的序列,设计并合成PCR引物,引物的序列见表1。
应用重叠PCR方法扩增NS3蛋白酶基因。提取JEV RNA后,分别以NS2BH-s和NS2BH-liner-a,Protease-Linker-s和NS3-a为引物,扩增出所需要的目的基因,将两次PCR的产物回收并混合。从混合物中取出1 μL为模板,以NS2BH-s、NS3-a为引物进行PCR扩增得到目的片段。PCR产物用琼脂糖凝胶DNA回收试剂盒进行回收。
1.2.2 原核表达质粒的构建及重组蛋白的表达纯化
将回收的PCR产物与pET-30a载体同时用BamH I、Xho I双酶切后在16 ℃连接,转化到DH5α菌株,双酶切法鉴定阳性克隆,所得的阳性克隆经DNA测序正确后将其转化到BL21 (DE3)感受态中,阳性质粒命名为pET-30a-NS2BH-NS3。
将转化pET-30a-NS2BH-NS3质粒的BL21 (DE3)细菌接种到含卡那霉素的LB培养基中,37 ℃、180 r/min摇床培养至对数生长期时,加入IPTG至终浓度为1 mmol/L,18 ℃、180 r/min诱导12 h后收集菌体,压力破碎,离心后取上清后,用镍亲和层析方法进行纯化。
1.2.3 蛋白酶活性测定的底物设计和合成
本研究中采用荧光共振能量转移的方法(FRET) 建立蛋白酶活性的测定方法,设计一段NS3蛋白酶可识别并切割的多肽,在N端标记荧光基团,在C端标记淬灭基团。该多肽完整时荧光被淬灭,加入蛋白酶后,多肽被切割,荧光基团和淬灭基团分离,因而体系中可检测到荧光。设计的底物序列为:Dabcyl-KQNKRGGNE(EDANS)G。
1.2.4 NS3蛋白酶的酶反应曲线
在黑色96孔板中依次加入60 μL 50 mmol/L Tris-HCl缓冲液,30 μL 20 µmol/L NS2BH-NS3纯化蛋白,10 μL 100 µmol/L荧光底物,水平振荡1 min后,置于37 ℃反应,每隔20 min测定340 nm激发光下的发射光 (485 nm),并绘制酶反应曲线。
1.2.5 NS3蛋白酶反应条件的优化
1) pH对NS3蛋白酶活性的影响:在96孔板中依次加入50 µL 2×pH 缓冲液、30 µL NS2BH-NS3纯化蛋白、10 µL荧光底物、10 µL去离子。其中2×pH 缓冲液的pH值分别为7.0–11.0。测定加样后0 min、120 min的荧光值,比较不同pH值条件下酶反应变化。
2) 二价金属离子对NS3蛋白酶活性的影响:在NS3蛋白酶反应体系中,分别加入终浓度为5 mmol/L CaCl2、3 mmol/L MgSO4或3 mmol/L MgCl2,测定蛋白酶反应变化 (反应条件同上) ,比较不同二价离子对酶反应的影响。
3) NaCl浓度对NS3蛋白酶活性的影响:在反应体系中分别加入终浓度为0 mmol/L、25 mmol/L、50 mmol/L、75 mmol/L、100 mmol/L、150 mmol/L NaCl,置于37 ℃反应,反应条件同上,比较蛋白酶活性的变化。
1.2.6 NS3蛋白酶米氏常数 (Km) 和最大反应速度 (Vmax) 的测定
在反应最佳条件下,在反应体系中加入不同终浓度的底物 (0–80 mmol/L),测定反应初速度,根据米氏方程求得JEV NS3蛋白酶的Km和Vmax。
1.2.7 基于NS3蛋白酶活性的抑制剂筛选方法的建立
在黑色96孔酶标板中依次加入50 mmol/L Tris-HCl缓冲液,20 µmol/L NS2BH-NS3,100 µmol/L荧光底物,1 mmol/L抑肽酶(Aprotinin),总体积100 μL。加样后立即置于多功能酶标仪中,37 ℃振荡1 min后,测定反应零时间发射光 (F0)。将96孔板置于37 ℃温箱中反应120 min后,再次用酶标仪检测体系中的荧光强度 (F1)。设置不加化合物的对照组,并测定反应后0 min (F0c) 和120 min (F1c) 的荧光值。抑制率(%)=100- (F1-F0) ÷ (F1c-F0c) ×100。
1.2.8 NS3蛋白酶抑制剂高通量筛选方法的初步应用
用上述建立的NS3蛋白酶抑制剂高通量筛选方法,随机选取实验室保存的113种化合物进行了初步筛选的应用。
2 结果与分析
2.1 NS2BH-NS3基因的扩增及重组质粒的酶切鉴定
用引物NS2BH-s/NS2BH-liner-a、Proteaselinker-s/Protease-a,通过RT-PCR方法分别从JEV基因组中扩增出约170 bp和570 bp的两个片段,再通过SOE-PCR扩增出约740 bp大小的一个片段。将扩增的目的片段插入原核表达载体后,双酶切后得到大小约为5 000 bp和740 bp的两个片段 (图1),证明重组质粒pET30a-NS2BH-NS3构建成功。测序结果也表明构建正确。
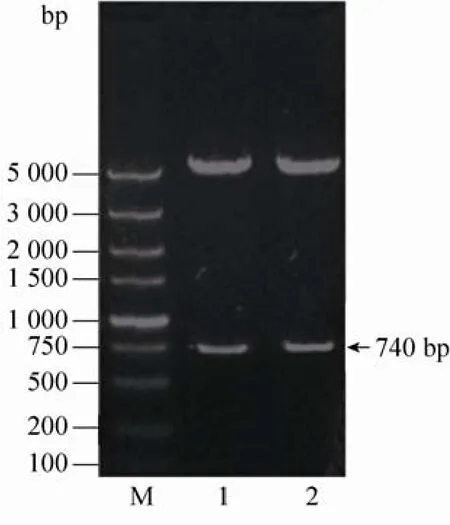
图1 质粒pET30a-NS2BH-NS3的酶切鉴定Fig. 1 Identification of plasmid pET30a-NS2BH-NS3. M: DL5000; 1-2: pET30a-NS2BH-NS3.
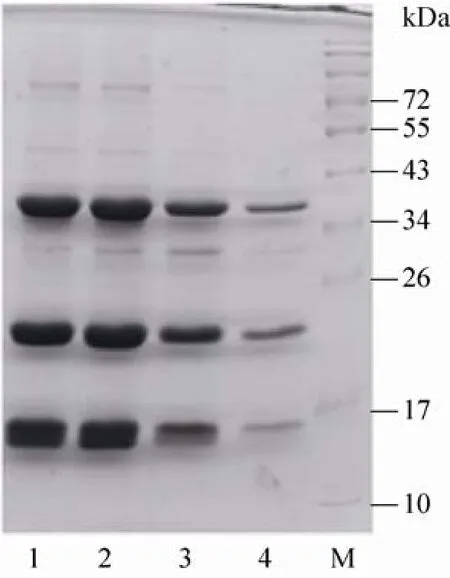
图2 重组蛋白NS2BH-NS3的SDS-PAGE鉴定Fig. 2 SDS-PAGE analysis of the purified NS2BHNS3. M: protein marker; 1-4: purified protein.
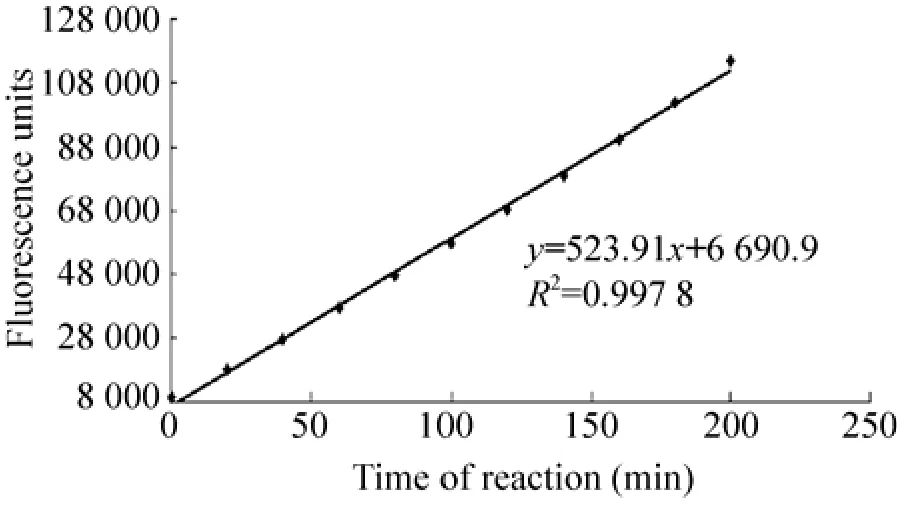
图3 NS3蛋白酶反应曲线Fig. 3 Reaction curve of NS3 protease.
2.2 重组蛋白的原核表达与纯化
活化的表达菌株在37 ℃培养至OD值0.6,加入IPTG至终浓度1 mmol/L,在18 ℃、180 r/min培养12 h后收集菌体,破碎,纯化。蛋白表达及纯化结果如图2所示,蛋白总分子量为36 kDa,同时,NS2BH-NS3蛋白可自我剪切成NS2BH (14 kDa) 和NS3 (22 kDa) 两条带 (图2)。
2.3 NS3蛋白酶的酶反应曲线
将纯化的NS3蛋白酶与合成的FRET底物混合后,置于多功能酶标仪中,设置温度37 ℃进行反应,每隔20 min测定体系的荧光强度,共测定10次。从测定结果看 (图3),随着酶反应时间的进行,体系中的荧光强度不断增加,经过相关性分析发现,体系中荧光强度的增加与时间成明显的线性相关 (R2=0.9978),说明在200 min内该蛋白酶反应均处于一级反应,反应速度恒定。
2.4 NS3蛋白酶反应条件的优化
2.4.1 pH对NS3蛋白酶活性的影响
在不同pH (7.5–11.0) 缓冲液中,加入NS3蛋白和FRET底物,于37 ℃反应120 min后,测定体系荧光值,计算反应初速度。从图4中可见,在pH 9.5时蛋白酶活性最高,而在pH 7.5时蛋白酶的活性最低 (图4)。因此确定了NS3蛋白酶催化反应的最佳pH为9.5。
2.4.2 二价金属离子对NS3蛋白酶活性的影响
在蛋白酶反应体系中加入不同的二价金属离子 (5 mmol/L CaCl2、3 mmol/L MgSO4、3 mmol/L MgCl2),在pH 9.5下测定反应的初速度,发现当反应体系中加入金属离子后会影响NS3蛋白酶的活性 (图5),本实验结果证明,JEV NS3蛋白酶活性不需要二价金属离子,相反在酶反应中二价金属离子会抑制酶活性。
2.4.3 NaCl浓度对NS3蛋白酶活性的影响
在酶反应体系中分别加入0–250 mmol/L NaCl,按照上述方法测定蛋白酶反应初速度。结果显示,NaCl对酶反应具有不利影响,随反应缓冲液中NaCl浓度的升高,NS3蛋白酶的活性越弱 (图6) 。因为在无盐离子时,NS3蛋白易于沉淀,因此在反应体系中我们加入了10 mmol/L NaCl。
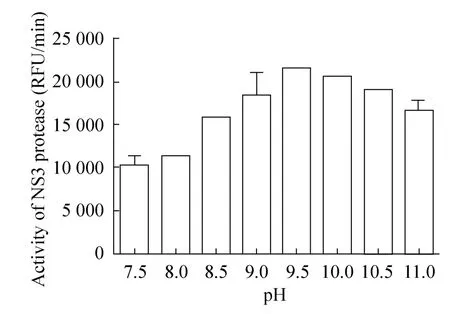
图4 pH对NS3蛋白酶活性的影响Fig. 4 Effect of pH on the activity of NS3 protease. RFU: fluorescence units.
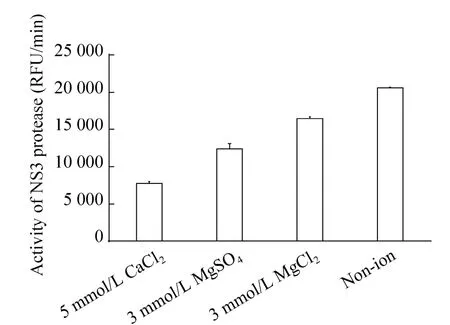
图5 二价金属离子对NS3蛋白酶活性的影响Fig. 5 Effect of divalent metal ions on the activity of NS3 protease. RFU: fluorescence units.

图6 不同NaCl浓度对NS3蛋白酶活性的影响Fig. 6 Effect of NaCl concentration on the activity of NS3 protease. RFU: fluorescence units.
2.5 NS3蛋白酶Km和Vmax的测定
根据上述最适反应条件的摸索,确定NS3蛋白酶活性测定的条件为:37 ℃,pH 9.5,10 mmol/L NaCl。在该条件下,加入不同浓度的底物测定反应初速度,用双倒数作图法得出NS3蛋白酶的米氏常数 (Km) 为59.28 µmol/L (图7),最大反应速度 (Vmax) 为500 Fluorescence units/min。
2.6 基于NS3蛋白酶活性的抑制剂筛选方法建立
将不同浓度 (10–50 μmol/L) 的蛋白酶抑制剂Aprotinin加入蛋白酶反应体系,用多功能酶标仪测定加Aprotinin后0 min、120 min的荧光值,并计算抑制率。发现Aprotinin对NS2BH-NS3活性有抑制作用,并随浓度减少抑制效果减弱 (图8)。

图7 NS3蛋白酶的Km和Vmax值的测定Fig. 7 Kinetic parameters (Km, Vmax) of JEV NS3 protease.
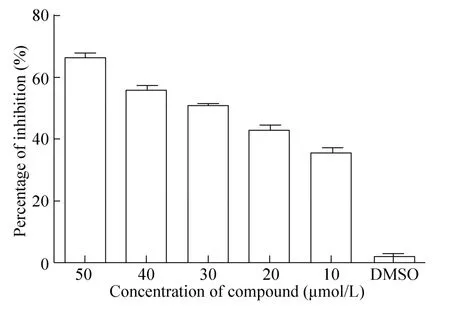
图8 Aprotinin对NS3蛋白酶活性的抑制作用Fig. 8 Inhibition of Aprotinin on NS3 protease activity.
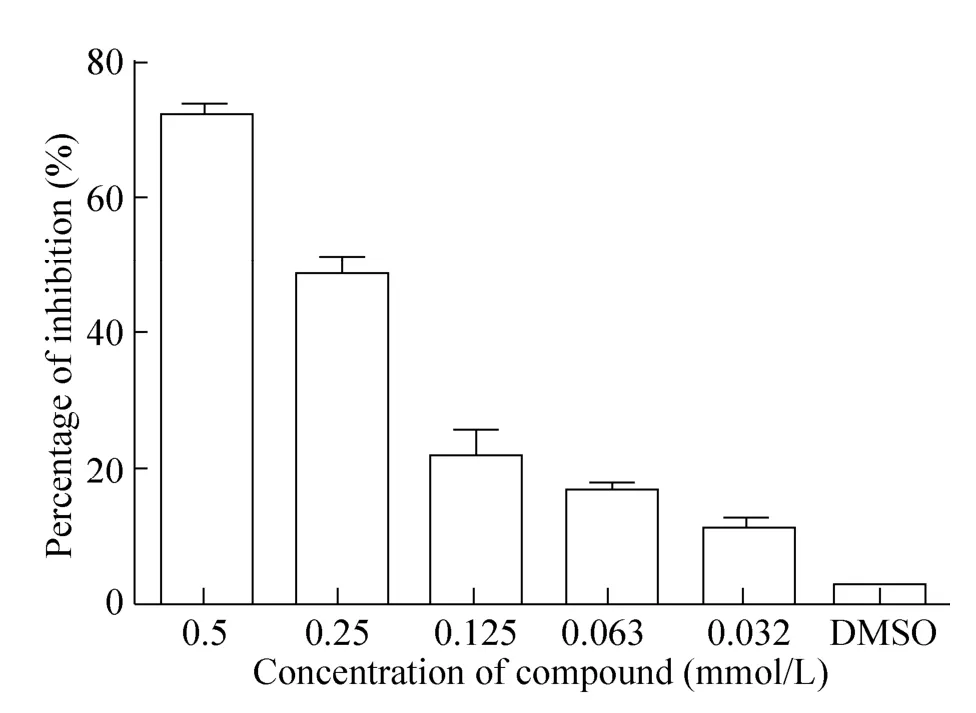
图9 81#化合物对NS3蛋白酶活性的抑制作用Fig. 9 Inhibition of 81# compound on NS3 protease activity.

图10 92#化合物对NS3蛋白酶活性的抑制作用Fig. 10 Inhibition of 92# compound on NS3 protease activity.
2.7 NS3蛋白酶抑制剂高通量筛选方法的初步应用
在黑色96孔板中,对113个化合物进行筛选,发现大多数化合物的抑制率均在20%–40%,其中2种化合物对NS3蛋白酶具有一定抑制活性,两个化合物在浓度为0.5 mmol/L时,抑制率分别为73%和71%。进一步将2种化合物在不同浓度下测定了抑制率,发现两种化合物对NS3蛋白酶的抑制呈现明显的剂量依赖效应,随着化合物浓度的降低抑制率也下降 (图9、10)。两种化合物的结构式如图11所示。
3 讨论
JEV NS3蛋白酶的活性依赖于NS2B的40个氨基酸的激活作用,NS2B与NS3蛋白酶识别底物有关,主要决定结合的亲和力[18],起着辅因子的作用。此外,NS2B的疏水区域与NS2B-NS3复合物的膜定位有关[19]。NS2B-NS3蛋白酶识别剪切双碱性残基序列RR、KK和RK,该序列在整个黄病毒属蛋白酶中高度保守,因此NS3蛋白酶被公认为潜在的治疗乙脑的良好靶标。目前针对HCV的NS3蛋白酶为靶标筛选出的波普瑞韦和特拉匹韦,均于2011年5月通过了美国FDA的上市许可。针对JEV NS3蛋白酶及其抑制剂的研究几乎还没有报道。本实验针对JEV NS3蛋白酶进行体外表达和活性研究,并用表达的蛋白对化合物进行抑制剂筛选从而为设计筛选基于蛋白酶靶标的JEV药物奠定了基础。
以往建立的蛋白酶活性的检测方法主要有放射性同位素法和高效液相色谱法。放射性同位素法较为灵敏,但操作度复杂,有放射性的污染,因此不适合进行高通量操作。高效液相色谱测定法要求抑制剂的纯度高[20],而且此方法也不适合大量药物筛选[21]。本实验使用荧光共振能量转移的方法检测酶活性并大量筛选药物[22],此方法操作简便,应用范围很广,成本低,并且可以进行高通量抑制剂筛选[23],但是在实验操作中发现一些化合物本身带荧光,会对实验结果造成一定的影响,可能产生一定的假阳性或假阴性,需要在分析实验数据时予以辨别。

图11 两种苗头化合物的结构式Fig. 11 Structures of the two hit compounds.
REFERENCES
[1] Fischer M, Casey C, Chen RT. Promise of new Japanese encephalitis vaccines. Lancet, 2007, 370(9602): 1806–1808.
[2] Marfin AA, Gubler DJ. Japanese encephalitis: the need for a more effective vaccine. Lancet, 2005, 366(9494): 1335–1337.
[3] Deng XF, Shi ZX, Qiu YF, et al. Characterization of nonstructural protein 3 of a neurovirulent Japanese encephalitis virus strain isolated from a pig. Virol J, 2011, 8: 209.
[4] Liu TH, Liang LC, Wang CC. The blood-brain barrier in the cerebrum is the initial site for the Japanese encephalitis virus entering the central nervous system. J Neurovirol, 2008, 14(6): 514–521.
[5] Solomon T, Dung NM, Kneen R, et al. Japanese encephalitis. J Neurol Neurosurg Psychiatry, 2000, 68(4): 405–415.
[6] Ariff IM, Thounaojam MC, Das S, et al. Japanese encephalitis virus infection alters both neuronal and astrocytic differentiation of neural stem/progenitor cells. J Neuroimmune Pharmacol, 2013, 8(3):664–676.
[7] Wang LH, Fu SH, Wang HY, et al. Japanese encephalitis outbreak, Yuncheng, China, 2006. Emerg infect Dis, 2007, 13(7): 1123–1125.
[8] Ishikawa T. Development of new Japanese encephalitis vaccine. Nihon Rinsho, 2005, 63(12): 2133–2137.
[9] Falgout B, Miller RH, Lai CJ, et al. Deletion analysis of dengue virus type 4 nonstructural protein NS2B: identification of a domain required for NS2B-NS3 protease activity. J Virol, 1993, 67(4): 2034–2042.
[10] Gould EA, Solomon T, Mackenzie JS. Does antiviral therapy have a role in the control of Japanese encephalitis? Antivial Res, 2008, 78(1): 140–149.
[11] Yang TC, Shiu SL, Chuang PH, et al. Japanese encephalitis virus NS2B-NS3 protease induces caspase 3 activation and mitochondria-mediated apoptosis in human medulloblastoma cells. Virus Res, 2009, 143(1): 77–85.
[12] Lin CW, Huang HD, Shiu SY, et al. Functional determinants of NS2B for activation of Japanese encephalitis virus NS3 protease. Virus Res, 2007, 127(1): 88–94.
[13] Zhang JS, Zhao QM, Zhang PH, et al. Genomic sequence of a Japanese encephalitis virus isolate from southern China. Arch Virol, 2009, 154(7): 1177–1180.
[14] Misra UK, Kalita J. Overview: Japanese encephalitis. Prog Neurobiol, 2010, 91(2): 108–120. [15] Paetzel M, Dalbey RE. Catalytic hydroxyl/amine dyads within serine proteases. Trends Biochem Sci, 1997, 22(1): 28–31.
[16] Lindenbach BD, Rice CM. Molecular biology of flaviviruses. Adv Virus Res, 2003, 59: 23–61.
[17] Junaid M, Chalayut C, Sehgelmeble Torrejon A, et al. Enzymatic analysis of recombinant Japanese encephalitis virus NS2B(H)-NS3pro protease with fluorogenic model peptide substrates. PLoS ONE, 2012, 7(5): e36872.
[18] Chappell KJ, Stoermer MJ, Fairlie DP, et al. Insights to substrate binding and processing by West Nile Virus NS3 protease through combined modeling, protease mutagenesis, and kinetic studies. J Biol Chem, 2006, 281(50): 38448–38458. [19] Lescar J, Luo D, Xu T, et al. Towards the design of antiviral inhibitors against flaviviruses: the case for the multifunctional NS3 protein from Dengue virus as a target. Antiviral Res, 2008, 80(2): 94–101.
[20] Aarnoutse RE, Verweij-van Wissen CP, et al. High-performance liquid chromatography of HIV protease inhibitors in human biological matrices. J Chromatogr B Biomed Sci Appl, 2001, 764(1/2): 363–384.
[21] Woolf E, Haddix HM, Matuszewski B. Determination of an in vivo metabolite of a human immunodeficiency virus protease-inhibitor in human plasma by high-performance liquid chromatography with tandem mass spectrometry. J Chromatoqr A, 1997, 762(1/2): 311–319.
[22] Nitsche C, Klein CD. Fluorimetric and HPLC-based dengue virus protease assays using a FRET substrate. Methods Mol Biol, 2013, 1030: 221–236.
[23] Yang CC, Hsieh YC, Lee SH, et al. Novel dengue virus-specific NS2B/NS3 protease inhibitor, BP2109, discovered by a high-throughput screening assay. Antimicrob Agents Chemother, 2011, 55(1): 229–238.
(本文责编 陈宏宇)
Method for Japanese encephalitis virus NS3 protease activity analysis and high-throughput screening assay for inhibitors
Jingyun Zhou1,2, Xue Wang2, Chao Pei2, Yunfeng Song1,2, and Huanchun Chen1,2
1 State Key Laboratory of Agricultural Microbiology, Huazhong Agricultural University, Wuhan 430070, Hubei, China 2 College of Veterinary Medicine, Huazhong Agricultural University, Wuhan 430070, Hubei, China
Japanese encephalitis virus (JEV) is a single-stranded and positive-sense RNA, which has a single ORF (open reading frame), encoding a polyprotein precursor. Non-structural protein 3 (NS3) plays an important role in processing the polyprotein precursor and has become an important drug target of flavivirus. In this study, NS2BH-NS3 gene was amplified by PCR and subcloned to the prokaryotic expression plasmid, resulting pET30a-NS2BH-NS3. The fusion protein was expressed in Escherichia coli BL21 (DE3) in soluble form after induction by Isopropyl β-D-1-Thiogalactopyranoside (IPTG). The recombinant protein was purified by Ni-NTA affinity column. Then a fluorescence resonance energy transfer (FRET) method was used to determine enzymatic activity and the assay conditions were optimized. After screening 113 compounds, we found two compounds inhibiting the activity of NS2BH-NS3. This study provides a convenient and cost-effective method for screening of JEV NS3 protease inhibitor.
Japanese encephalitis virus, NS3 protease, solubility expression, activity analysis, high throughput screening for inhibitors
May 6, 2013; Accepted: August 19, 2013
Yunfeng Song. Tel: +86-27-87617277; Fax: +86-27-87288629; E-mail: syf8728@163.com
周景云, 汪雪, 裴超, 等. 日本脑炎病毒NS3蛋白酶活性检测及抑制剂高通量筛选方法的建立. 生物工程学报, 2014, 30(2): 194-202.
Zhou JY, Wang X, Pei C, et al. Method for Japanese encephalitis virus NS3 protease activity analysis and high-throughput screening assay for inhibitors. Chin J Biotech, 2014, 30(2): 194-202.
Supported by: National Natural Science Foundation of China (No. 30800831), National High Technology Research and Development Program of China (863 Program) (No. 2011AA10A212).
国家自然科学基金 (No. 30800831),国家高技术研究发展计划 (863计划) (No. 2011AA10A212) 资助。
时间:2013-10-11 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20131011.1835.002.html

