猪伪狂犬病毒PCR检测方法的建立及应用
王香玲,沈诗源,焦连国,张家旺,王芳芳,吴星亮,王排军,王贵华∗
(1.大北农动物医学研究中心,北京100095;2.福州大北农生物技术有限公司,福州350014;3.北京大北农科技集团股份有限公司,北京100095)
猪伪狂犬病毒PCR检测方法的建立及应用
王香玲1,沈诗源2,焦连国1,张家旺3,王芳芳1,吴星亮1,王排军1,王贵华1∗
(1.大北农动物医学研究中心,北京100095;2.福州大北农生物技术有限公司,福州350014;3.北京大北农科技集团股份有限公司,北京100095)
根据猪伪狂犬病毒(PRV)gE基因序列保守区段,设计一对特异性引物,通过优化反应条件,建立了可区分猪伪狂犬病毒野毒株与基因缺失疫苗株的PCR检测方法,并对该方法的敏感性、特异性和重复性进行了验证。结果显示,该PCR方法可扩增出388 bp的目的片段;对模板的最低检测量为1.1 pg;与猪圆环病毒Ⅱ型、猪细小病毒、猪支原体、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪乙型脑炎病毒、猪流行性腹泻病毒无交叉反应,具有高特异性。采用建立的PCR方法对2014年以来全国不同地区81个猪场421份疑似病料进行检测,发现PRV猪场平均阳性率为35.80%,样品平均阳性率为25.42%。该方法灵敏度高、特异性强、重复性好,可用于PRV的临床诊断和流行病学调查。
猪伪狂犬病毒;PCR;野毒;疫苗毒
伪狂犬病(Pseudorabies,PR)是由伪狂犬病毒(Pseudorabies virus,PRV)引起的一种重要的传染病[1-2]。到目前为止,该病的发生已给世界上许多国家和地区的经济发展带来了巨大的损失,我国已有20多个省市报道了该病的发生,给我国的养猪业造成了极大的威胁[1]。
快速的临床诊断是防治猪伪狂犬病的一项重要措施。目前对PRV的各种诊断方法[3-7]均有其优缺点,有的程序太复杂,有的耗时太长,在发生急性动物疫情或混合性感染、隐性感染时往往不能获得满意的检测效果[1]。自21世纪以来,许多学者应用PCR方法检测伪狂犬病已取得很大的成果,他们根据PRV的gE序列设计了不同的引物,建立了检测PRV的PCR检测方法[8-9]。为了满足猪场的需要以及达到实验室检测准确、迅速的要求,本实验室根据PRV的gE序列,经过一系列比对,在其保守区域设计出一对特异性的引物,建立了一种PCR检测技术,并对采集的猪伪狂犬病病料进行了检测,以期为基层展开大规模流行病学调查与疫情检测提供技术支持。
1 材料和方法
1.1 材料
1.1.1 毒株 猪伪狂犬病毒(PRV)、猪圆环病毒II型(PCV2)、猪细小病毒(PPV)、猪支原体(MHP)、猪繁殖与呼吸综合征病毒(PRRSV)、猪流行性腹泻(PEDV)、乙脑(JEV)、猪传染性胃肠炎(TGEV)等毒株均由大北农动物医学研究中心提供;猪瘟病毒(CSFV)为猪瘟兔化弱毒疫苗购自福州大北农生物技术有限公司;PRV疑似病料来自不同地区疑似猪群。1.1.2 主要试剂 LA Taq DNA聚合酶,蛋白酶K,MLV反转录酶购自宝生物(大连)工程有限公司;TransScript First-Strand cDNA Synthesis SuperMix,2×EasyTaq PCR SuperMix,购自全式金生物科技有限公司。
1.2 方法
1.2.1 PCR引物 根据GenBank已报道的猪伪狂犬病病毒,选择gE基因中高度保守的区域设计上、下游引物,上游引物PRV-F:5’-CGGCTTC⁃CACTCGCAGCTCTTCTC-3’位于gE序列的687~710 bp,下游引物PRV-R:5’-TGTGGGTCAT⁃CACGAGCACGTACAGC-3’位于gE序列的1050~1075 bp。引物预扩增片段长度为388 bp,由上海立菲生物技术有限公司合成。
1.2.2 样本DNA/RNA的提取以及cDNA的合成取200 μL 1.1.1中所述PRV、PCV2、PPV、MHP毒株,按照文献[10]所述方法提取DNA,并保存于-20℃备用。取200 μL 1.1.1中所述PRRSV、PEDV、JEV、TGEV、CSFV毒株,按照文献[10]所述方法提取RNA。反转录按照MLV反转录酶使用说明书进行,反转录的cDNA保存于-20℃备用。
1.2.3 PRV PCR检测方法的建立及扩增片段的鉴定利用已制备好的模板进行PCR,反应体系为25 μL:2×GC Buffer I:12.5 μL,dNTP:4 μL,PRV-F/PRV-R:0.5 μL,LA Taq酶:0.25 μL,灭菌水:5.25 μL,模板:2 μL。反应程序:94℃3 min;94℃30 s,62℃30 s,72℃50 s,35个循环;72℃5 min;4℃终止反应。反应结束后,取5 μL的PCR扩增产物经1.5%的琼脂糖凝胶电泳进行检测,同时将扩增的PCR产物送英俊公司测序,将序列与GenBank中PRV的gE序列进行比对分析。
1.2.4 特异性试验 利用上述建立的PCR方法,对PRV、PCV2、PPV、MHP、CSFV、PRRSV、JEV、PEDV、TGEV等参考毒株进行PCR扩增,以验证该方法的特异性。
1.2.5 敏感性试验 取PRV细胞培养液200 μL,提取病毒DNA,用紫外分光光度计定量后,将DNA做10倍倍比稀释,每个稀释度取2 μL稀释液作为模板,按照1.2.3体系及方法进行PCR扩增,验证本方法的敏感性。
1.2.6 重复性试验 利用已经建立好的PCR反应条件,取5份现地采集的PRV疑似病料,交由3名不同技术人员(甲、乙、丙)进行检测,不同的病料再重复2次(即进行三批实验),从而验证该方法的重复性。
1.2.7 临床应用 利用上述建立的PCR方法,对来自不同地区的PRV疑似病料进行PCR检测,分析2014年以来猪伪狂犬病的发病情况。
2 结果
2.1 PRV PCR检测方法的建立及扩增片段的鉴定以提取的病毒DNA为模板,以PRV-F和PRV-R一对引物进行目的片段的扩增,得到一条大约400 bp的目的条带(图1),条带清晰,无杂带拖带现象。将扩增的片段送Invitrogen(上海)公司测序。将测序结果(图2)进行BLAST在线分析,结果表明该目的条带为gE基因。

图1 PRV的PCR扩增试验结果
2.2 特异性试验 利用反应条件优化后的PCR方法,以阳性样品和对照样品的基因组DNA为模板进行PCR扩增,结果仅PRV阳性样品能扩增到相应的目的片段,其他对照样品均未有扩增产物出现(图3)。
2.3 敏感性试验 将测定浓度后的病毒DNA(55 ng/μL)进行10倍倍比稀释,在相同的反应体系和反应条件下进行PCR扩增,结果显示在稀释至10-5时仍可见特异性扩增条带(图4),即在此PCR反应中,模板的最低检测量为1.1 pg。
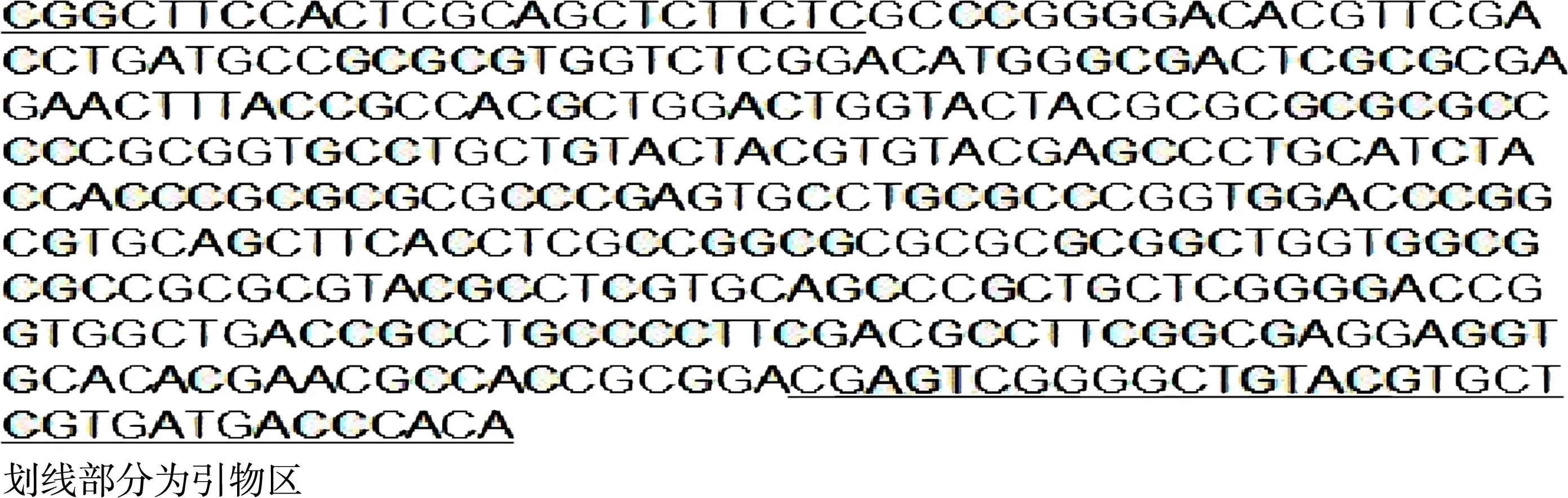
图2 PCR产物测序结果
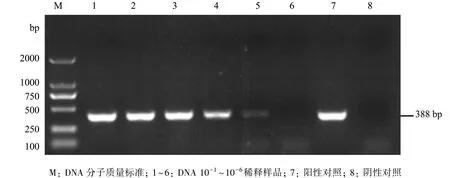
图3 PRV引物特异性试验结果
2.4 重复性试验 3名技术人员分别对3批(每批5份)不同疑似病料进行DNA提取以及PCR检测,对每批病料,3名技术人员获得的检测结果相同(表1-表3),证明本方法的重复性很好。
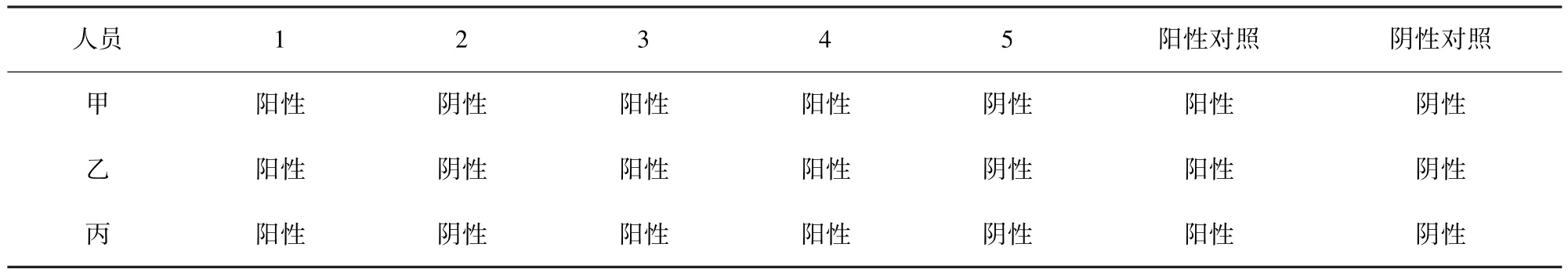
表1 第一批实验结果

表2 第二批实验结果

表3 第三批实验结果
2.5 临床应用 采用本次试验建立的PCR方法,对2014年以来全国不同地区的81个猪场421份病料进行检测,表4结果显示,有29个猪场107份样品为PRV阳性,平均阳性率为35.80%和25.42%。
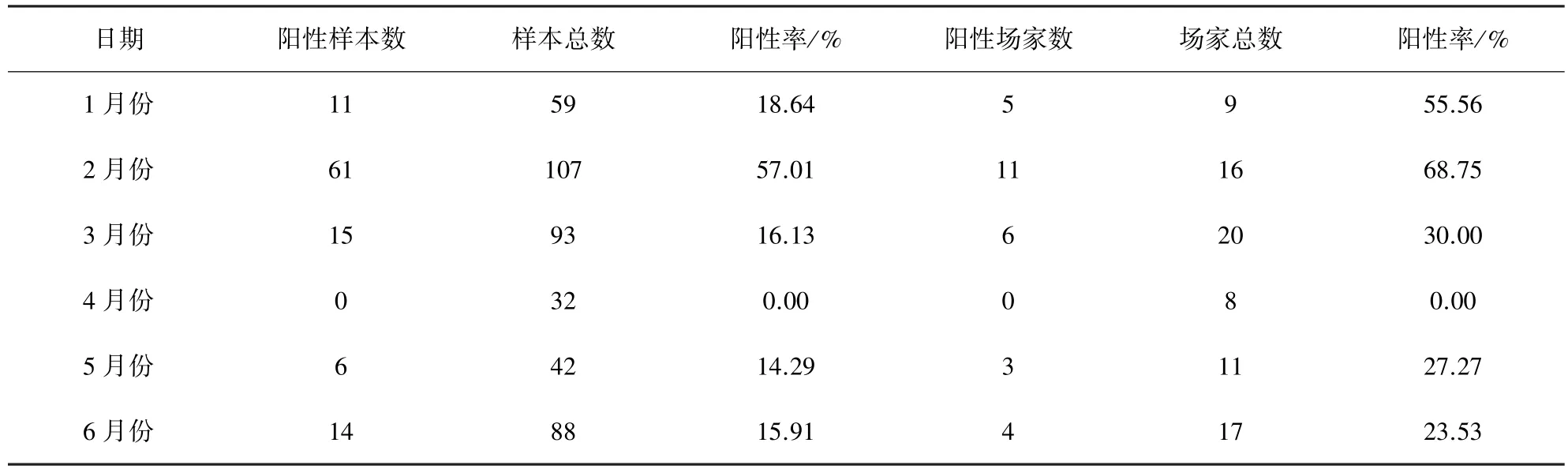
表4 2014年1-6月份PRV的阳性检出率
3 讨论
本研究成功建立了检测PRV野毒的PCR方法,根据该方法能够扩增出一条特异性的片段,大小为388 bp,将测序结果进行BLAST在线分析,证明扩增产物确实为PRVgE基因片段,可以继续后面的条件优化实验。
目前,缺失gE基因的疫苗是预防PRV的首选疫苗,该基因已作为PCR诊断的最佳基因[11-12]被用于特异性地检测PRV野毒感染的动物,而根据该方法对PCV2、PPV、MHP、CSFV、PRRSV、JEV的检测则均为阴性,说明本实验具有良好的特异性。本研究所建立的PCR方法在DNA模板量为1.1 pg时仍能扩出目的片段,表明我们建立的PCR方法具有较高的敏感性。在重复性试验中,我们随机选出3批,每批5份的PRV疑似病料,由3名技术人员同时进行平行试验,检测结果一致,表明所建立的方法具有很好地重复性。
我们利用该方法对全国不同地区的81个猪场421份病料进行检测,结果显示有29个猪场的107份样品扩增出了与预期大小相符的条带,阳性检出率分别为35.80%和25.42%。而且,由表4我们可以发现,PRV的阳性率在今年2月份处于较高的水平,场家阳性率为68.75%,样品阳性率为57.01%。
目前,随着我国规模化养猪的不断发展,PRV对猪群健康影响越来越大,给养猪业造成巨大经济损失。本实验建立的检测PRV的PCR技术可以快速准确地检测出现地病料的PRV野毒感染,对PRV的防制以及进一步的分子流行病学调查具有重要的应用价值。
[1] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:1180-1183.
[2] 斯特劳B E,阿莱尔S D.猪病学[M].8版.赵德明,等译.北京:中国农业大学出版社,2000:239-253.
[3] Yoon H A,Eo S K,Alyas A G,et al.Investigation of Pseudorabies virus latency in nervous issues of seropositive pigs exposed to field strain[J].J Vet Med Sci,2006,68(2):143-148.
[4] 娄高明,杜伟贤,廖筱萍,等.PCR检测伪狂犬病病毒DNA[J].中国生物化学和分子生物学报,2001,17(4):519-523.
[5] 王莉娟,陆明哲,陈义平,等.PR病检测技术研究进展[J].中国畜牧兽医,2005,32(6):42-43.
[6] 唐勇,陈焕春,覃雅丽,等.伪狂犬病毒gG基因的表达及gG-LAT诊断方法的建立[J].畜牧兽医学报,2003,34(1):72-76.
[7] 汪招雄,何启盖,刘丽娜,等.检测伪狂犬病毒病毒双抗体夹心间接ELISA方法的建立与应用[J].中国预防兽医学报,2006,28(2):220-225.
[8] 周斌,苏鑫铭,张素芳,等.PCR快速检测伪狂犬病病毒野毒感染[J].中国病毒学,2004,19(6):612-615.
[9] 吴发兴,郑辉,亓传德,等.猪伪狂犬病病毒PCR检测方法的建立与应用[J].动物医学进展,2009,30(5):5-9.
[10]贾赟,芦银华,张素芳,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学,2004,19(5):467-470.
[11]Heffner S,Kovacs F,Klupp B G,et al.Glycoprotein gp50-negative pseudorabies virus a novel approach toward a nonspreading live herpesvirus vaccine[J].J Virol,1993,67(3):1529-1537.
[12]Hammond J M,Jansen E S,Morrissy C J,et al.Vaccination of pigs with a recombinant porcine adenovirus expressing the gD gene from pseudorabies virus[J].Vaccine,2001,19(27):3752-3758.
(编辑:李文平)
Establishment and Application of PCR for Detection of Pseudorabies Virus
WANG Xiang-ling1,SHEN Shi-yuan2,JIAO Lian-guo1,ZHANG Jia-wang3,WANG Fang-fang1,WU Xing-liang1,WANG Pai-jun1,WANG Gui-hua1∗
(1.Animal Medicine Research Center of Da Bei Nong Group,Beijing 100095,China;2.Fuzhou Dabeinong Biotechnology Co.,Ltd,Fuzhou 350014,China;3.Da Bei Nong Group,Beijing 100095,China)
Based on the conserved region of gE gene,a pair of primers were designed,and a PCR assay which can distinguish wild strain and vaccine strains with gene deletion was established by improving condition.Meanwhile,the sensibility,specificity and repeatability of the assays were verified.The results demonstrated that the established PCR assay could amplify 388 bp target fragment,and could detect 1.1 pg DNA and no cross with porcine circovirus type 2,porcine parvovirus,Mycoplasma hyopneumoniae,classical swine fever virus,porcine reproductive and respiratory syndrome virus,swine Japanese encephalitis virus,porcine epidemic diarrhea virus.Using the established PCR method,421 suspected materials from 81 pig farms since 2014 were detected,the positive detection rate of pig farms and the materials were 35.80%and 25.42%,respectively.The PCR assay was sensitive,specific and accurate that could be used for massive samples detection and diagnosis of PRV infection.
pseudorabies virus;PCR;wild virus;vaccine virus
2014-07-29
A
1002-1280(2014)11-0005-05
S852.65+9.1
王香玲,硕士,从事猪病实验室检测工作。
王贵华。E-mail:343621466@qq.com

