全骨髓贴壁法体外分离培养兔骨髓间充质干细胞
宋明艳,李 娜,姜 彦,于龙刚
(1青岛大学医学院,山东青岛266071;2青岛大学医学院附属医院)
近年来,随着组织工程学、细胞及基因治疗技术的衍生和发展,骨髓间充质干细胞(BMSCs)因具有来源广泛、取材方便、可多向分化、易于分离培养及纯化等优点,被视为理想的种子细胞,受到越来越多的关注[1]。BMSCs的工程需求量较大,但它在骨髓中数量却极少,仅占单核细胞的0.001% ~0.01%,需要体外分离纯化和大量增殖,这也是推广组织工程学应用的重要前提[2]。因此如何高效获取并鉴定BMSCs成为研究的重要任务。2013年8~12月,我们采用全骨髓贴壁法从兔骨髓中分离出BMSCs进行培养,过程中检测细胞活性,鉴定细胞多向分化能力,对所获取的细胞进行综合评价,探讨此方法分离培养BMSCs的可行性。
1 材料与方法
1.1 材料 纯种新西兰大耳白兔,4周龄,雌雄不限,体质量约1.0 kg,由青岛市实验动物中心提供。实验所有过程中对兔的处置符合《关于善待实验动物的指导性意见》要求。DMEM/F12培养基、胎牛血清,0.25%胰蛋白酶,地塞米松、β-磷酸甘油、抗坏血酸、1-甲基-3-异丁基-黄嘌呤、吲哚美辛,碱性磷酸酶检测及脂肪细胞油红O染色试剂盒。
1.2 兔BMSCs的分离和原代培养 用10%水合氯醛(3 mL/kg)腹腔注射麻醉兔子,刮除其双下肢毛发,用1%的碘伏消毒术区,铺无菌洞巾,解剖出双侧股骨,剔净肌肉及骨膜,75%乙醇浸泡5 min后转移到超净工作台。PBS缓冲液冲洗3遍股骨,剪去两侧部分干骺端,用加有肝素的DMEM/F12培养基反复冲洗骨髓腔,收集骨髓混合液于离心管中,1 000 r/min离心5 min,弃上清,加入DMEM/F12培养基(含体积分数为10%的胎牛血清)制成单细胞悬液。将细胞以2×105/cm2的密度接种于底面积25cm2培养瓶中,置于37℃、体积分数5%CO2、饱和湿度下的培养箱内孵育。24 h后首次半量换液,弃去未贴壁的细胞,此后平均每48 h换液1次,严格无菌操作,光镜下观察培养结果。
1.3 兔BMSCs的传代培养 原代细胞达到90%融合度后,开始进行传代。吸除原培养废液,PBS缓冲液洗涤细胞3次,0.25%胰蛋白酶消化细胞,当光镜下细胞由梭形变为圆形时,提示细胞已完全分离,立即加入含10%胎牛血清的培养基终止消化,并反复轻轻吹打瓶底贴壁细胞,制成单细胞悬液,并按照1∶3的比例进行传代。原代细胞标记为P0,第一代标记为P1,以此类推,镜下观察细胞的形态及生长情况。
1.4 兔BMSCs的鉴定
1.4.1 贴壁率检测 取P3代细胞,0.25%胰蛋白酶消化后,加入DMEM培养基制成单细胞悬液,以5×107/孔的密度接种到12孔培养板中,每2 h弃去2孔细胞培养液,再次消化贴壁细胞,进行细胞计数,并取平均值,计算各个时间点的贴壁率后绘制曲线。贴壁率(%)=已贴壁细胞数/接种细胞总数×100%。
1.4.2 细胞增殖检测及生长曲线的绘制 取P3代细胞,0.25%胰蛋白酶消化后,加入DMEM培养基制成单细胞悬液,按1×107/L的密度接种到24孔培养板中,每天取3孔细胞消化后计数,取平均值,连续计数8 d,以培养时间为横轴、细胞平均值为纵轴,绘制细胞生长曲线。
1.5 兔BMSCs分化能力检测
1.5.1 兔BMSCs成脂诱导分化 取P3代细胞,当细胞达到90%融合后,加入脂肪细胞诱导剂(含LDMEM培养基、体积分数为10%胎牛血清、100 U/mL青霉素、100 g/mL链霉素、1 μmol/L地塞米松、200 μmol/L 吲哚美辛及 0.5 mmol/L 1-甲基-3-异丁基-黄嘌呤),每3 d换液1次,10 d后行油红O染色,镜下观察结果。
1.5.2 兔BMSCs成骨诱导分化 取P3代细胞,当细胞达到90%融合后,加入成骨细胞诱导剂进行诱导分化(含L-DMEM培养基、体积分数10%胎牛血清、100 U/L 青霉素、100 U/L 链霉素、10 mmol/L β-磷酸甘油、10-8mol/L地塞米松,50 mg/L抗坏血酸),每3天换液1次,21 d后行碱性磷酸酶定性染色,镜下观察结果。
2 结果
2.1 兔BMSCs形态学变化 原代BMSCs接种24 h,可见较多悬浮杂质细胞,贴壁细胞较少且分散,细胞较小,近似圆形或短梭形。3 d后贴壁细胞增多,出现放射状集落式生长,6 d后细胞集落生长明显,呈旋涡状或辐射状,此时细胞以长梭形为主,还可见三角形、扁平形和其他不规则形。多次传代后杂质被弃去,纯度不断提高,细胞生长活跃,形态较均一,维持长梭状。
2.2 兔BMSCs的贴壁率曲线 此贴壁率曲线显示,细胞培养2 h贴壁30%以上,4 h贴壁60%,8 h贴壁70%以上,12 h贴壁90%,充分反映了BMSCs旺盛的活力和快速增殖能力(见图1)。
2.3 兔BMSCs的生长曲线 P3代细胞的生长曲线大体呈S形,细胞培养至第2天时,细胞数目无明显增加,为细胞的适应期;3 d后细胞数迅速增加,大量细胞快速增殖,为对数生长期;6 d左右细胞数达到顶点,逐渐进入平台期,此时细胞增殖明显减慢(见图2)。

图1 P3代骨髓间充质干细胞的贴壁率
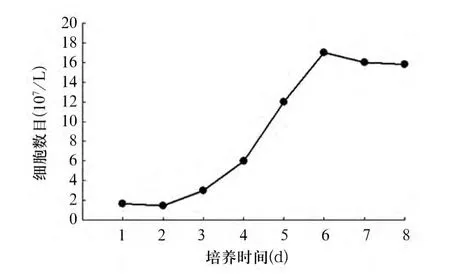
图2 P3代骨髓间充质干细胞的生长曲线
2.4 兔BMSCs成脂诱导分化情况 第6天光镜下初见细胞胞质内有黄色圆形脂滴沉着,细胞呈圆形,随着诱导时间的延长,脂肪细胞的比例逐渐增高。培养到21 d时,脂滴明显增大,胞核偏向细胞一侧,经油红O染色后,胞核呈现蓝色,脂滴呈现橙红色(见图3)。

图3 兔BMSCs来源的成脂细胞油红O染色(×100)
2.5 兔BMSCs成骨诱导分化情况 BMSCs向成骨诱导6 d时,细胞开始由梭形变为长方形或多角形,21 d时行碱性磷酸酶定性染色,细胞核呈紫色,胞质出现红棕色或褐色颗粒(见图4)。

图4 兔BMSCs来源的成骨细胞碱性磷酸酶染色(×100)
3 讨论
20世纪70年代,Friedenstein等[3]利用全骨髓贴壁法最先从骨髓中分离培养出了间充质干细胞,这是一种来源于中胚层的成体干细胞,具有较强的自我更新能力,在不同的诱导条件下,可向中胚层和外胚层组织分化,如向成骨细胞、脂肪细胞、神经细胞、软骨细胞、肌肉组织及支持造血的基质细胞等分化。间充质干细胞可以从骨髓、脂肪、脐带、羊膜或牙髓等众多组织中获取,其中骨髓一直是其主要来源。BMSCs取材相对方便、培养周期短、增殖能力强、呈贴壁式生长,具有一定的免疫调节功能,避免了发生免疫排斥反应,且多次传代后仍保持旺盛生命力,因此被组织工程学选为种子细胞和基因载体细胞,用于多种动物实验、临床及基因研究[4]。组织治疗技术是利用干细胞的黏附性及分化更新特性,将干细胞与特定生物材料相结合,并将材料移植到受损组织处,用以修复或替代机体受损组织,目前此技术已经取得较大的成功,如对骨组织、心肌及外周神经损伤后的修复等[5]。所以BMSCs在组织工程学中起着关键作用,细胞的分离培养至关重要。
目前,BMSCs常用的分离培养方法有四种,即密度梯度离心法、全骨髓贴壁法、免疫磁珠及流式细胞仪分离法[6,7]。后两种方法因为实验要求多,费用高,对细胞活性有很大影响而较少使用。密度梯度离心法虽可在最初获得较高纯度的单核细胞,但因操作复杂,过程中的反复离心影响细胞的活性,又使得大量细胞及生物因子流失,故不作为首选方法。全骨髓贴壁法主要利用细胞的贴壁特性对全骨髓进行分离,虽然在原代细胞中混杂有一定数量的造血干细胞或成纤维细胞等杂质,但这些悬浮未贴壁的细胞可在换液及传代的过程中被去除,而BMSCs则黏附于培养瓶底得以纯化,最后仍可获得较高纯化率。部分研究[8]表明,细胞培养早期残留的造血干细胞和其他杂细胞,有利于保持BMSCs的生长微环境,且骨髓中残留的血小板和巨核细胞可通过分泌相关细胞生长因子,促进集落形成和细胞增殖。全骨髓贴壁法简单易操作,分离时间短,细胞很少受到分离导致的损伤,获得的BMSCs活性强、纯度高,故是目前应用最多的分离方法。
BMSCs的鉴定目前没有统一标准,尚未发现其特异性表面标记物[9,10]。研究者多从细胞形态、细胞表型或细胞功能三个方面着手鉴定干细胞[11]。干细胞表面抗原的检测,仅仅用于判断所得细胞的均一性或纯度,或初步判断其是否为一种非造血干细胞[12]。而检测细胞的多向分化潜能才是鉴定BMSCs的金标准[13]。细胞形态方面如细胞呈类似成纤维细胞的梭形、贴壁式生长、克隆成集落快速增殖等均符合干细胞的形态学特征。在成骨及脂肪诱导剂作用下,向成骨及脂肪细胞转化,充分显示了干细胞的多向分化潜能以及自我更新的能力,符合干细胞的生物特性。S形生长曲线提示干细胞经历了潜伏期、增殖期及平台期,符合细胞的生长特性及增殖规律。细胞短时间内出现贴壁,培养12 h后贴壁率高达90%,反映出细胞超强的生存能力和活力[14]。
总之,全骨髓贴壁法可以比较简便的分离培养出BMSCs,同时保证干细胞的纯度及增殖活性,可适应组织工程对大量细胞的需求,对于提供充足高质量的种子细胞具有重大意义。
[1]曾晶晶,周诺,黄旋平,等.犬骨髓间充质干细胞体外培养和鉴定[J].实用医学杂志,2013,29(16):2649-2651.
[2]林春博,杨渊,陈维平.低渗结合自然沉降法分离兔骨髓间充质干细胞及其鉴定[J].中国组织工程研究与临床康复,2011,15(1):12-16.
[3]Friedenstein AJ,Chailakhjan RK,Lalykina KS.The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells[J].Cell Tissue Kinet,1970,3(4):393-403.
[4]童培建,何帮剑,金红婷,等.分离培养方法及冻存技术对犬骨髓间充质干细胞生长和增殖的影响[J].中国组织工程研究与临床康复,2008,12(38):7455-7459.
[5]何红云,邓仪昊,佟晓杰,等.骨髓间充质细胞构建组织工程神经修复坐骨神经缺损[J].中国组织工程研究与临床康复,2009,13(28):5562-5566.
[6]穆晓红,赵子义,徐林,等.密度梯度离心法体外培养骨髓间充质干细胞的分化能力[J].中国组织工程研究与临床康复,2011,15(27):4955-4958.
[7]黎婷,孙晋虎,赵亮,等.离心分离法与贴壁分离法对培养骨髓问充质干细胞生物学特性影响[J].中国组织工程研究与临床康复,2010,48(5):29-31.
[8]何仁君,杨自权,李兵,等.髓间充质干细胞体外分离培养条件的优化组合[J].中国组织工程研究与临床康复,2008,12(43):8463-8467.
[9]戚宗泽,罗云飞,侯勇,等.兔骨髓间充质干细胞的分离、体外培养、鉴定及成脂诱导[J].昆明医科大学学报,2013,(1):28-31.
[10]李鲁生,张涵,王成俊,等.骨髓间充质干细胞的分离方法和生物学特性[J].中国组织工程研究与临床康复,2010,14(10):1869-1873.
[11]贾贵清,张明鸣,杨平,等.不同分离及培养方法对大鼠骨髓间充质干细胞生长增殖和生物学特性的影响[J].四川大学学报,2009,40(4):719-723.
[12]郑有华,张志光,苏凯,等.人髁突来源骨髓间充质干细胞的分离与鉴定[J].中华口腔医学研究杂志,2009,3(2):23-26.
[13]Pittenger MF,Mackay AM,Beck SC,et al.Muhilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[14]孔根现,蒋知新,沙航,等.兔骨髓间充质干细胞分离培养后的活力检测[J].中国组织工程研究,2013,17(1):62-67.

