小肠间质瘤的螺旋CT诊断*
赖寿伟 温毅强
(广东医学院第三附属医院医学影像科,广东 茂名 525011)
小肠间质瘤(small intestine stromal tumor,SIST)在胃肠道间质瘤(gastrointestinal stromal tumor,GIST)中发病率较低,但随着多层螺旋CT技术的快速发展,其检出率不断提高。相对于发生于其他部分的胃肠道间质瘤,小肠间质瘤有其自身的特点,本研究旨在探讨其螺旋CT诊断价值及临床意义。
1 资料和方法
1.1一般资料 本组共19 例病人,均经手术及病理证实。男14例、女5例,年龄41~80岁,平均52岁。临床表现为上腹部不适及反复长期发作性腹痛8例,黑便4例,贫血、消瘦2例,腹部包块4例,体检做其他检查时偶然发现者1例。病程2个月~10年不等。
1.2检查方法 CT扫描设备为GE Light Speed VCT 128层螺旋CT和东芝Aquilion 16 层螺旋CT机,行全腹部平扫及双期增强扫描,部分行三期扫描。层厚、层距为5 mm,部分病例行MPR重组。2例行CTA后处理重建(MIP、VR)。增强扫描采用碘帕醇(300 mgI/ml)50~60 ml,肘静脉注射,流速2.5~3 ml/s。扫描时间为动脉期(25~30 s)、门静脉期(60~70 s),部分病例加延迟期(3~5 min)。胃肠道准备:扫描前禁食6~8 h ,视不同情况口服温开水或口服2%泛影葡胺。检查前2 h口服温开水或口服2%泛影葡胺1000 ml,检查前1 h口服同种液体500 ml, 扫描上机前再服500 ml。
2 结 果
2.1 小肠间质瘤的分布和性质 本组 19 例中,肿瘤起源于十二指肠 2例,空肠6例,回肠 10 例,均为单发。1例为多发病例(图1),空、回肠均见大小不等的肿块。良性 3 例 ,潜在恶性1例 ,恶性 15 例。
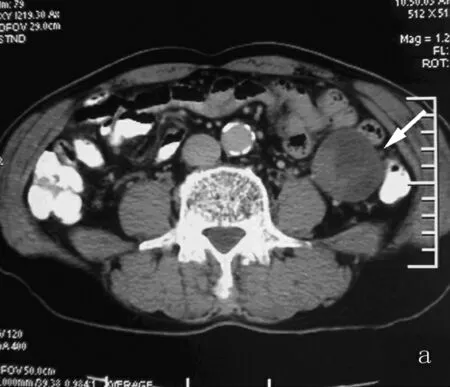
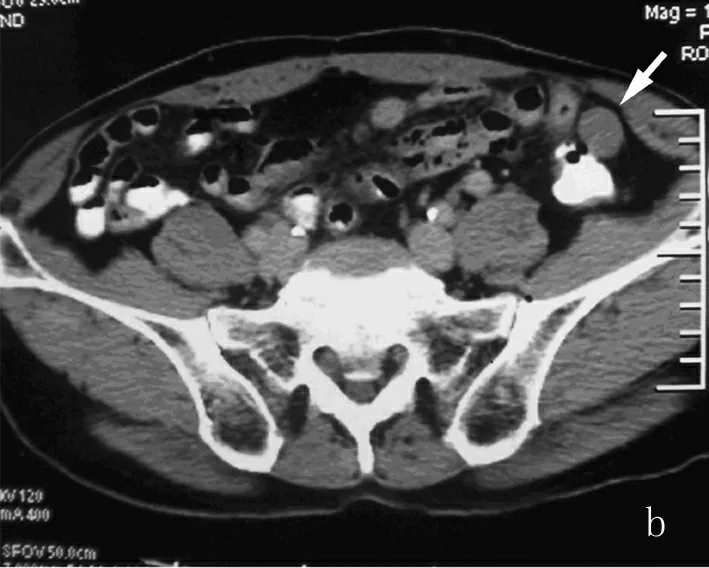
图1 多发间质瘤
a:增强扫描门脉期空肠区见一圆形肿块,轻度强化,内见偏心性坏死区达肿块边缘(箭)。b:增强扫描门脉期回肠区另见一小圆形肿块,轻中度强化,边缘清(箭)。
2.2小肠间质瘤的 CT表现 19例小肠间质瘤中,大多数呈椭圆形或类圆形,占13例,少数呈不规则形或分叶状。12 例病灶直径 > 4 cm ,CT显示最小病灶直径1.3 cm,其中良性者病灶直径均< 4 cm。本组19例小肠间质瘤主要CT表现为向肠腔外生长的肿块(图1),肿块与局部肠壁关系密切,较大肿块邻近肠曲可见推压移位,肠曲间距增宽。良性者,平扫密度均匀,边缘清晰,可见轻度均匀强化(图2)。恶性者,平扫及增强扫描肿块边缘清晰12例(图3),4例边缘模糊(图4),增强扫描见轻至中度强化14例,2例明显强化并见粗大的供血血管(图4),以CTA后处理图像MIP及VR观察供血血管更直观、清楚。多数肿块内见大小不等、形态不一的低密度坏死区,坏死区无强化。坏死区以增强扫描门脉期观察更理想。部分坏死区表现为直达肿块边缘的偏心性坏死区,本组有6例出现此形式坏死区(图1、3)。1例坏死囊变显著(图5),肿块呈壁较薄的囊肿样改变,但仍有小部分呈软组织密度。1例位于十二指肠的肿块内见气体影及液平面(图4)。
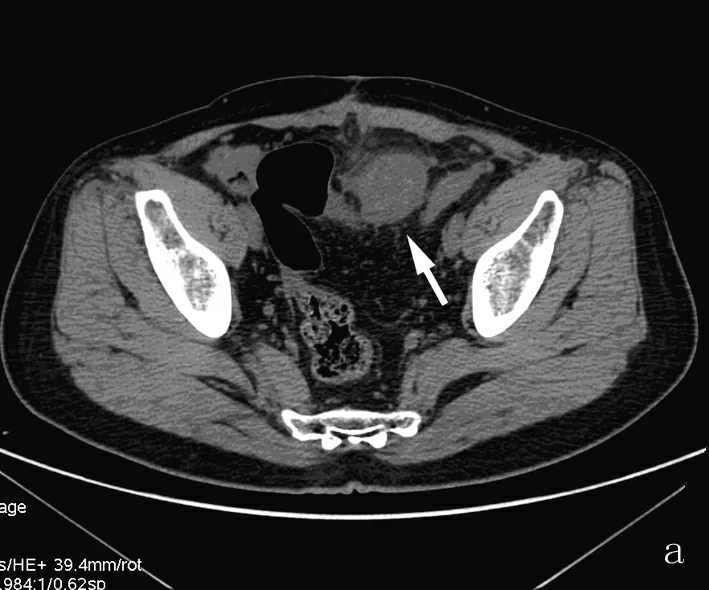

图2 回肠良性间质瘤
a:平扫肿块密度较均匀,边缘较清(箭)。b:增强扫描动脉期肿块轻度强化,密度较均匀(箭)。
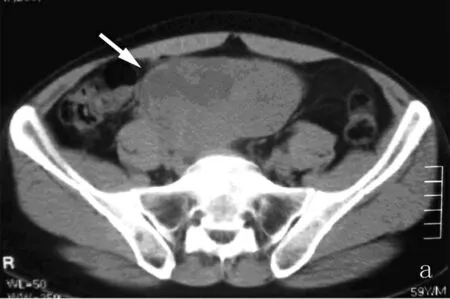
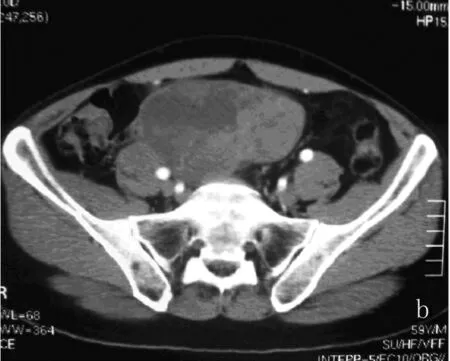
图3 回肠恶性间质瘤
a:平扫呈不规则肿块,边缘清,可见偏心性坏死,达肿块边缘(箭)。b:增强扫描动脉期肿块呈轻度强化,坏死区无明显强化。


图4 十二指肠恶性间质瘤
a:增强扫描见较明显强化,部分边缘模糊,内见含气体及液平面的坏死区,并见较粗的供血血管影。b:CTA-MIP图像示肿块由胃十二指肠动脉分支供血(箭)。
3 讨 论
GIST是一种少见的肿瘤,占全部胃肠道肿瘤的0.1%~0.3%[1]。GIST一词是由Mazur等[2]于1983年根据肿瘤的分化特征而提出, 目前得到国内外学者的公认。临床诊断比较困难,影像学检查是主要的检查方法,免疫组化和电子显微镜检查为确诊GIST的主要病理手段。GIST 的免疫组化检查表现为CD117和(或)CD34 阳性。

图5 空肠恶性间质瘤
增强扫描门脉期肿块大部分坏死囊变呈薄壁囊肿样改变,小部分实质部分明显强化(箭)。
GIST可发生于消化道的任何部位,多数研究显示GIST主要发生于胃,其次为小肠,Kim等[3]的747例GIST发生于胃(63%),小肠(30%)。也有作者报道小肠间质瘤的发病率达42%[4]。虽然这与样本的选择有一定关系,但随着检查技术的发展,其检出率将不断增加,同时采用正确有效的检查方法对提高检出率是有帮助的。小肠间质瘤的检查方法有超声、消化道造影、MRI及CT等,其中以CT检查价值更高, CT可清楚显示肿瘤的大小、形态、密度、边缘及生长方式等,甚至可以清楚显示邻近器官的浸润及远处转移情况。受各种因素影响,加上小肠冗长及相互重叠,小肠间质瘤的检出率不高,特别是较小的间质瘤。为提高小肠间质瘤的检出率,我们进行了一些有效的探讨,对于腹部CT检查,目前的胃肠道准备方法为喝开水充盈胃肠道,但这种方法不利于小肠间质瘤的检出。遇某些区域小肠内液体较少或肠蠕动收缩时,萎陷的肠管与较小的小肠间质瘤往往难以区分。因此,我们采取三种方案处理:一是对检查前诊断不明确者,仍按常规口服开水准备肠道;二是经其他方法如超声等怀疑小肠间质瘤的,予以口服2%的泛影葡胺准备肠道;三是对小肠间质瘤术后复查患者,予以口服2%的泛影葡胺准备肠道,以期发现较小的复发病灶。经口服2%的泛影葡胺准备肠道的,由于肠道内充盈的阳性造影剂与小肠间质瘤对比强烈,常能发现较小的间质瘤,其缺点是如需同时行小肠CTA后处理观察肿瘤血供则欠理想。
对于GIST的良恶性诊断标准仍存在一定分歧,病理上多将其分为良性、潜在恶性、恶性三级,但实际上目前病理学水平尚无法对其良恶性进行准确判断,几乎所有的GIST均有恶性潜能,即使分化好的GIST也存在术后复发或远处转移的风险,因此多数学者认为不能简单以良恶性来划分,而应该确定风险程度。Fletcher 等[5]以肿瘤大小和核分裂数将 GIST 分为极低危、低危、中危、高危。危险度分级可以评估及预测其恶性潜能和复发风险,对GIST 的诊断及指导临床治疗意义重大,也较为合理。肿瘤恶性程度也与起源的解剖位置有关,研究认为胃 GIST以良性多见,小肠GIST则更倾向于恶性,且危险度以高危为主[ 6-7]。在本组病例中,仅3例为良性,潜在恶性1例,而15例为恶性,恶性占79%,与报道相符。因此小肠间质瘤的预后较胃间质瘤差。小肠间质瘤的复发率及转移率也较高,文献报道约50%以上GIST在5年随访中复发,应长期密切随访[5]。本组病例中有3例复发,都发生于术后2年内,其复发率较报道低,可能与样本较少有关。我们注意到,小肠间质瘤的复发率高尚有两种情况可能,一是多发病灶,在较早期因较小未能发现,而当生长至一定阶段后被检出及发现,而并非真正的复发。本组一多发病例,CT检查发现6个病灶,但术中经详细探查其病灶多达20~30个,肉眼可见最小的直径约0.4 cm。另一情况是手术时是否能完整、完全切除,如术中肿瘤破溃,将有可能导致种植转移,因此术中保证肿瘤完整性非常重要。
小肠间质瘤CT主要表现为向肠腔外生长的肿块,部分呈圆形或椭圆形,部分呈不规则形或分叶状。GIST可表现为向腔内生长为主、同时向腔内及腔外生长、向腔外生长为主等多种形式,而小肠间质瘤较胃GIST更常为外生性生长[8]。本组19例均为向腔外生长。因此小肠间质瘤早期多数无明显症状,不容易发现,这可能也是造成其发病率不高的原因之一。有时即使肿块很大,因其主要向腔外生长,多数不会引起肠梗阻,本组无1例发生肠梗阻。小肠间质瘤多数与局部肠壁相连,因此充分显示肿瘤与肠管的关系对小肠间质瘤的诊断非常重要,是与其他肿瘤鉴别的要点之一。在这方面多层螺旋CT的优势更明显,除了横断面外,还可通过MPR等后处理方式从多角度展示肿瘤与肠管的关系。较多作者从肿瘤的大小、坏死及边缘等方面对GIST恶性征象的影像学表现进行了深入的探讨[9],但影像学对GIST的良恶性征象的判断仍有一定的限度,笔者认为其中较可靠的征象为肿瘤的边缘浸润生长,表现为边缘模糊不清,可为肿块部分边缘或全部边缘。本组病例中有4例恶性小肠间质瘤边缘模糊,术前已作出了正确诊断。恶性小肠间质瘤内可出现大小不等、形态不一的低密度坏死区,坏死区与肿瘤的大小有关,肿瘤越大出现坏死的机率越高,而较小的肿瘤即使是恶性也不一定出现坏死区,肿瘤显著坏死囊变可使肿块呈囊肿样改变。本组1例呈囊肿样改变,但仍有小部分呈实性软组织密度。我们研究发现,小肠间质瘤的坏死区多呈偏心性,坏死区边缘直达肿块边缘,这种直达肿块边缘的偏心性坏死区有一定的特异性,尚未见有报道描述此征象。本组病例中,有6例出现这种形式的坏死区,其意义有待进一步深入研究。文献报道[10]肿块囊变、坏死区与消化道相通时,肿块内可见气体、气-液平面,甚至可见到阳性对比剂。本组仅见1例出现此征象,发生率较低。增强扫描小肠间质瘤可出现轻度、中度至明显强化,良性者强化较轻及较均匀,恶性者强化程度不一,多为轻至中度的不均匀强化,而明显强化见于恶性程度较高的病例,有时可以见到增粗的肿瘤供血血管。
综上所述,小肠间质瘤有一定的CT表现特征,螺旋CT可以清楚显示小肠间质瘤的发生部位、大小、 形态、 密度、 轮廓及生长方式,尤其重要的是 CT 可以观察肿瘤对邻近器官有无侵犯以及是否有远处转移,对临床治疗及判断预后有重大价值,同时对术后随访也有重要意义。
[1] 张静,成官迅, 吴华旺.胃肠道间质瘤CT诊断[J].南方医科大学学报, 2008, 28(5): 892-893.
[2] Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis[J] . Am J Surg Pathol, 1983, 7(6): 507-519.
[3] Kim KM,Kang DW,Moon WS,et al. Gastrointestinal stromal tumors in Koreans: it's incidence and the clinical,pathologic and immunohistochemical findings[J].J Korean Med Sci, 2005, 20(6):977.
[4] 巴明臣,崔书中,陆勤,等. 小肠间质瘤的病理特征及诊治[J].广州医学院学报,2007, 35( 4):37-39.
[5] Fletcher CD,Berman JJ,Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach[J]. Hum Pathol,2002,33(5):459-465.
[6] 徐宏刚,阴骏,郑海军,等.胃肠道间质瘤的多层螺旋CT诊断[J]. 临床和实验医学杂志,2008, 7(3):29-31.
[7] 华广美,尹化斌,万凯明, 等. MSCT重建技术对小肠间质瘤的诊断价值[J].中国医学计算机成像杂志,2013,19(2):152-155.
[8] 李健丁,靳宏星,武志峰. 胃肠道间质瘤影像诊断[M]. 北京:人民卫生出版, 2009: 63-66.
[9] 何仲恒, 吕发金 , 曹兆飞, 等.多层螺CT诊断恶性胃肠道间质瘤[J].放射学实践,2009,24 (2 ):179-182.
[10] 龚静山, 杨鹏, 徐坚民,等. 胃肠道间质瘤的 CT和 MRI诊断[J]. 临床放射学杂志, 2008, 27(1):62-65.

