去乙酰化酶SIRT1在C57BL/6小鼠耳蜗的年龄相关性表达△
庞嘉祺 熊浩赖兰黄秋红郑亿庆
年龄相关性听力损失(age-related hearing loss,AHL)即老年性聋,是仅次于关节炎和高血压的世界第三大常见慢性疾病。据2006年全国第二次残疾人抽样调查推算,全国60岁以上老年人中老年性聋患者高达1 364.49万[1]。AHL的发病机制目前尚不明确,其病变部位涉及听力传导通路的各个区域,但尤以内耳组织的退行性变最为多见,近年来的文献已证实细胞凋亡是耳蜗损伤的重要机制[2]。沉默信息调节因子2(silent information regulator 2, Sir2)相关酶(sirtuin, SIRT)是一类烟酰胺腺嘌呤二核苷酸(nicotin-amide adenine dinucleotide, NAD+)依赖的去乙酰化酶,在哺乳动物中有七个同系物(SIRT1~7),其中,SIRTl蛋白主要分布在细胞核中,与常染色质结合在一起,参与多种基因的表观遗传调节。SIRT1作用底物不仅局限于组蛋白,还作用在一些非组蛋白底物的去乙酰化,如 P53[3]、FOXO[4];SIRT1参与DNA损伤修复、细胞代谢、衰老及凋亡的调控,已被证明与一些年龄相关性疾病,如癌症、糖尿病、心脑血管疾病和神经退行性病变有关[5];但SIRT1是否在耳蜗内表达尚不清楚。C57BL/6小鼠是最常用AHL动物模型,在5~8月龄时其听力开始出现下降,并随年龄增长呈渐进性加重,其耳蜗病理表现为毛细胞丢失、神经元数量减少及血管纹萎缩[6,7]。因此,本研究拟通过观察SIRT1在不同月龄C57BL/6小鼠耳蜗中的表达,探讨SIRT1与AHL发生的关系。
1 资料与方法
1.1实验动物及分组 健康的C57BL/6近交系小鼠(由中山大学动物管理中心提供)46只,其中 1~2月龄小鼠23只(青年组),体重12~15 g;12~16月龄小鼠23只(老年组),体重25~30 g。
1.2实验方法
1.2.1听性脑干反应(ABR)检测 采用Tucker-Davis Technologies(TDT系统III,FL,美国)系统专用电阻检测仪分别对两组小鼠行双耳ABR检测。小鼠用10%水合氯醛5 μl/g行腹腔注射麻醉,置于听力检测隔声屏蔽室内的恒温毯上,维持小鼠体温在37 ℃左右,针式记录电极置于头顶皮下,参考电极置于受试耳乳突皮下,接地电极置于鼻尖。刺激声为频率4、8、16和32 kHz的短纯音,扫描时间为10 ms,带通滤波频率为300~3 000 Hz;短纯音刺激的持续时间为4 ms,上升和下降时间0.5 ms;反应电位放大10 000倍,平均叠加1 024次;最大刺激声强度(声压级) 90 dB SPL,首先以10 dB递减刺激声声强,接近阈值时以5 dB递减,以能分辨出ABR波I的最低刺激强度为ABR的反应阈,每只小鼠测3次,取平均值作为阈值。
1.2.2合成互补DNA(complementary DNA, cDNA) 每组随机抽取20只C57BL/6小鼠,随机分成4组。于解剖显微镜下分离得耳蜗基底膜,用TRIzol Reagent(Invitrogen,美国)法提取组织的总RNA,Nanodrop 2000/2000C(Thermo Scientific,美国)测定纯度和浓度;取500 ng总RNA,应用PrimeScript®RT reagent Kit试剂盒(TaKaRa,日本)逆转录合成cDNA,置于-20 ℃保存。
1.2.3cDNA产物行聚合酶链反应(polymerase chain reaction, PCR)扩增 SIRT1引物序列为5′-CGGCTACCGAGGTCCATATAC-3′(前引物),5′-ACAATCTGCCACAGCGTCAT-3′(后引物),产物长度为135 bp;内参基因GAPDH引物序列为 5′-TGAACGGGAAGCTCACTGG-3′(前引物)5′-GCTTCACCACCTTCTTGATGTC-3′(后引物),产物长度为120 bp,由Invirtrogen公司合成。用TaKaRa TaqTMVersion 2.0 plus dye(TaKaRa,日本)于双巢式梯度PCR仪(BIO-RAD,美国)行PCR扩增,产物在2%琼脂糖凝胶行电泳。
1.2.4cDNA产物行实时定量聚合酶链反应(real-time quantitative polymerase chain reaction, qRT-PCR) SIRT1和GAPDH引物序列同上,应用SYBR®Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒(TaKaRa,日本)于LightCycler480 荧光定量PCR仪(Roche,瑞士)行qRT-PCR,以GAPDH为内参基因,计算两组小鼠SIRT1 mRNA的相对表达量;重复实验4次,取平均值。
1.2.5耳蜗切片免疫荧光染色:每组3只小鼠断头处死后取出耳蜗,参照文献[8]处理耳蜗,在SYD-K2040行冰冻切片,片厚10 μm。对切片进行染色[8],一抗SIRT1抗体(SANTA CRUZ,美国)稀释至1:200,阴性对照一抗为PBS;二抗 Alexa Fluor 594染料标记的驴抗兔IgG抗体(Life Technologies,美国)稀释至1:200,在研究级正置荧光显微镜BX63(奥林巴斯,日本)下观察,用Image J软件分析各区域免疫荧光阳性面积及平均荧光强度。
1.3统计学方法 采用SPSS19.0软件对数据正态性分布和方差齐性进行检验,符合则行两组独立样本t检验,不符合则行秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1两组小鼠的ABR反应阈比较 青年组和老年组小鼠ABR反应阈见表1。老年组小鼠4、8、16、32 kHz各频率ABR反应阈均高于青年组, 差异均有统计学意义(t值分别为-12.929,-18.958,-18.529,-12.338,均为P<0.001),提示老年组C57BL/6小鼠听力较青年组明显下降。
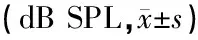
表1 两组C57BL/6小鼠各频率ABR反应阈(n=23只)
注:*与青年组比较,P<0.001
2.2两组小鼠耳蜗中SIRT1 mRNA的表达 青年组和老年组小鼠耳蜗SIRT1 mRNA的PCR扩增结果见图1,可见,在青年和老年耳蜗组织中, 在120 bp可得到GAPDH mRNA特异性条带,亮度基本一致,而在135 bp均可得到SIRT1 mRNA特异性条带,青年组电泳条带亮度明显高于老年组;实时定量qRT-PCR结果提示,青年组和老年组SIRT1mRNA相对含量分别为1.004±0.102和0.457±0.292(t=3.90,P<0.01),提示老年组C57BL/6小鼠耳蜗内SIRT1 mRNA的表达明显低于青年组。
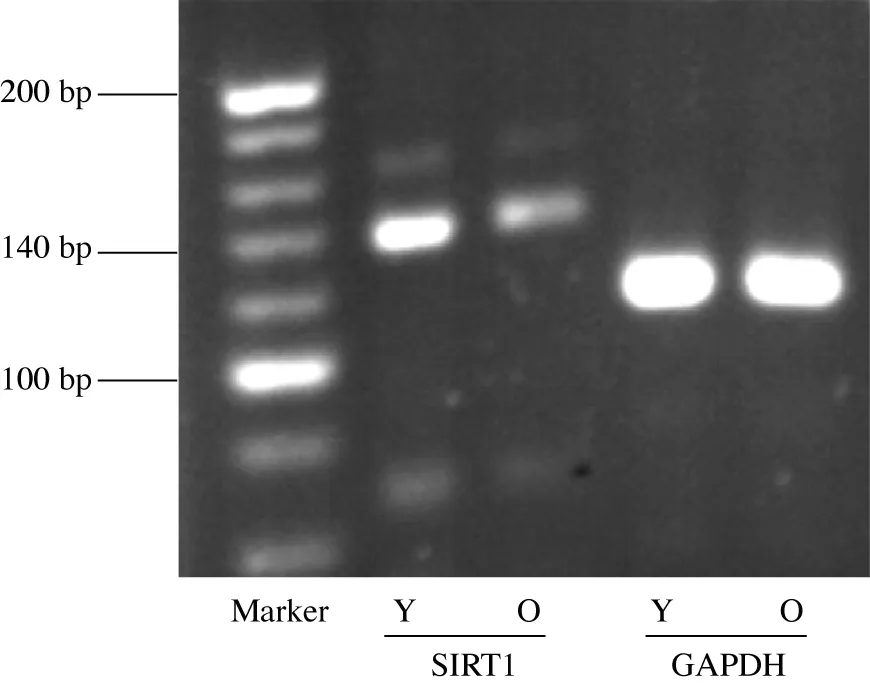
图1 SIRT1 mRNA在耳蜗中的表达Y:青年组;O:老年组;GAPDH:内参基因
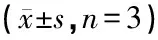
表2 两组小鼠Corti器、螺旋神经节、外侧壁的SIRT1蛋白表达阳性面积及平均荧光强度比较
注:*与青年组比较,P<0.001
2.3SIRT1蛋白在两组小鼠耳蜗中的表达 青年组小鼠耳蜗中SIRT1主要分布在内毛细胞、外毛细胞、支持细胞、血管纹细胞和螺旋神经节细胞的细胞核(图2);老年组小鼠耳蜗可见外毛细胞和螺旋神经元大量丢失,血管纹萎缩(图3);老年组小鼠的Corti器、螺旋神经节和血管纹SIRT1蛋白表达阳性面积均较青年组缩小(表2,t值分别=44.089、33.168、29.493,均P<0.001),在残存的内毛细胞、血管纹细胞和螺旋神经节神经细胞胞核中,老年组SIRT1蛋白的平均荧光强度较青年组显著下降(表2,t值分别为66.809、35.652、12.643,均P<0.001)。
3 讨论
去乙酰化酶Sir2在代谢、衰老、凋亡等生命活动中起重要调节作用,已证实其过表达可延缓酵母、线虫、果蝇的衰老,延长其寿命[9]。SIRT1是在哺乳动物中Sir2同源性最高的同系物[10],SIRT1表达模式的改变参与众多生理病理活动,如:在老年动物脑组织中SIRT1表达明显降低[11,12],冠状动脉内皮细胞中SIRT1的表达亦降低[13],但SIRT1在耳蜗中的表达及与耳蜗病理改变的关系尚未阐明。本研究结果显示,老年组C57BL/6小鼠ABR反应阈较青年组明显提高,表现出年龄相关性的听力损失特点,与以往文献报道相符[6,7];在青年组C57BL/6小鼠耳蜗中SIRT1 mRNA和蛋白大量表达,其中SIRT1蛋白主要在内毛细胞、支持细胞、螺旋神经节神经细胞、血管纹纤维细胞和中间细胞的细胞核表达,在外毛细胞的细胞核也有中等程度表达;在老年组C57BL/6小鼠中,SIRT1 mRNA和蛋白的表达明显下降,虽然,其外毛细胞大量丢失是SIRT1减少的重要原因之一,但在残存的内毛细胞中,SIRT1蛋白表达量亦明显下降。可见,SIRT1可能参与耳蜗的年龄相关性病理改变及AHL的发生。
衰老被认为是活性氧(reactive oxygen species,ROS)介导的氧化应激损伤在机体累积多年引起的一个不可避免的过程。氧化应激指机体受到多种病理因素刺激后,体内ROS产生过多,抗氧化能力下降,打破了机体正常氧化/还原动态平衡,造成DNA氧化损伤和蛋白质的表达异常,干扰正常生命活动,使机体处于易损状态。尽管有内源性抗氧化剂的存在,在氧化磷酸化反应电子转运时,仍有相当一部分ROS可离开线粒体,造成细胞内大分子如膜磷脂、蛋白质、DNA的损害或功能下降。此外,线粒体内积累的ROS可以通过细胞色素C释放到细胞质中触发细胞凋亡[14],ROS损伤组织和诱导细胞凋亡与多种老年性相关疾病的发生发展密切相关,如糖尿病[9]、癌症[3]、神经退行性病变[14]、动脉粥样硬化[15]、年龄相关性听力损失[16,17]等。已证明SIRT1可提高细胞对ROS介导氧化应激的抵抗[18],具有抗细胞凋亡作用[9],如:在人结肠癌细胞中,SIRT1增加p53去乙酰化,使其重新进入细胞周期,减少凋亡[3];在主动脉和冠状动脉内皮细胞中,过表达SIRT1可抑制其衰老、凋亡,延缓动脉粥样硬化的发生[15];在肾脏球系膜细胞中,SIRT1通过Smad7去乙酰化抑制转化生长因子β诱导凋亡[19]。多项研究表明,随年龄增加,耳蜗中ROS水平的提高或抗氧化能力的减退可导致大量耳蜗细胞的凋亡,是AHL发生的重要原因[20];从本研究结果看,SIRT1在耳蜗中的表达随C57BL/6小鼠年龄增长而下调,提示SIRT1的减少可能诱导耳蜗细胞的凋亡,参与AHL的发生。

图2 SIRT1蛋白在青年C57BL/6小鼠耳蜗中的表达 a~c:青年鼠Corti器;IHC为内毛细胞,OHC为外毛细胞,DC为Deiter样细胞,BC为边界细胞,IS为内沟细胞,IPh为内指细胞;d~f:青年鼠螺旋神经节;SGC为螺旋神经节细胞;g~i为青年鼠血管纹及螺旋韧带,FC为纤维细胞,IC为中间细胞。标尺:10 μm。n= 3。图a左下角示内毛细胞放大图;图c左下角示阴性对照

图3 SIRT1蛋白在老年C57BL/6小鼠耳蜗中的表达 a~c:老年鼠Corti器;IHC为内毛细胞,OHC为外毛细胞,DC为Deiter样细胞,BC为边界细胞,IS为内沟细胞,IPh为内指细胞;d~f:老年鼠螺旋神经节;SGC为螺旋神经节细胞;g~i为老年鼠血管纹及螺旋韧带,FC为纤维细胞,IC为中间细胞。标尺:10 μm,n= 3。 *表示缺失的外毛细胞
目前唯一被证实可延缓AHL的方法是热量限制(calorie restriction, CR)[21],研究表明CR通过上调sirtuin家族成员SIRT3表达,激活抗氧化系统,延缓AHL的发生;而SIRT1在多种转录激活和翻译后修饰活动中参与调控SIRT3信号通路[22,23]。因此,上调SIRT1是否可以延迟AHL的发生值得进一步研究。
4 参考文献
1 于丽玫, 孙喜斌, 魏志云, 等. 全国老年听力残疾人群现状调查研究[J]. 中国听力语言康复科学杂志, 2008(3):63.
2 Tadros SF, D'Souza M, Zhu X, et al. Apoptosis-related genes change their expression with age and hearing loss in the mouse cochlea[J]. Apoptosis, 2008,13:1303.
3 Yamakuchi M, Ferlito M, Lowenstein CJ. miR-34a repression of SIRT1 regulates apoptosis[J]. Proc Natl Acad Sci USA, 2008,105:13421.
4 Brunet A, Sweeney LB, Sturgill JF, et al. Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase[J]. Science, 2004,303:2011.
5 Westphal CH, Dipp MA, Guarente L. A therapeutic role for sirtuins in diseases of aging?[J]. Trends Biochem Sci, 2007,32:555.
6 Noben-Trauth K, Zheng QY, Johnson KR, et al. mdfw: a deafness susceptibility locus that interacts with deaf waddler (dfw)[J]. Genomics, 1997,44:266.
7 Jimenez AM, Stagner BB, Martin GK, et al. Age-related loss of distortion product otoacoustic emissions in four mouse strains[J]. Hear Res, 1999,138:91.
8 Yang H, Xiong H, Huang Q, et al. Compromised potassium recycling in the cochlea contributes to conservation of endocochlear potential in a mouse model of age-related hearing loss[J]. Neurosci Lett, 2013,555:97.
9 Abdellatif M. Sirtuins and pyridine nucleotides[J]. Circ Res, 2012,111:642.
10 Baur JA, Ungvari Z, Minor RK, et al. Are sirtuins viable targets for improving healthspan and lifespan?[J]. Nat Rev Drug Discov, 2012,11:443.
11 Ren Y, Shan TZ, Zhu LN, et al. Effect of breed on the expression of Sirtuins (Sirt1-7) and antioxidant capacity in porcine brain[J]. Animal, 2013,7:1994.
12 Chang HC, Guarente L. SIRT1 mediates central circadian control in the SCN by a mechanism that decays with aging[J]. Cell, 2013,153:1448.
13 Menghini R, Casagrande V, Cardellini M, et al. MicroRNA 217 modulates endothelial cell senescence via silent information regulator 1[J]. Circulation, 2009,120:1524.
14 Bonda DJ, Lee HG, Camins A, et al. The sirtuin pathway in ageing and Alzheimer disease: mechanistic and therapeutic considerations[J]. Lancet Neurol, 2011,10:275.
15 Borradaile NM, Pickering JG. Nicotinamide phosphoribosyltransferase imparts human endothelial cells with extended replicative lifespan and enhanced angiogenic capacity in a high glucose environment[J]. Aging Cell, 2009,8:100.
16 Someya S, Yamasoba T, Kujoth GC, et al. The role of mtDNA mutations in the pathogenesis of age-related hearing loss in mice carrying a mutator DNA polymerase gamma[J]. Neurobiol Aging, 2008,29:1080.
17 Someya S, Yamasoba T, Weindruch R, et al. Caloric restriction suppresses apoptotic cell death in the mammalian cochlea and leads to prevention of presbycusis[J]. Neurobiol Aging, 2007,28:1613.
18 Someya S, Xu J, Kondo K, et al. Age-related hearing loss in C57BL/6J mice is mediated by Bak-dependent mitochondrial apoptosis[J]. Proc Natl Acad Sci USA, 2009,106:19432.
19 Kume S, Haneda M, Kanasaki K, et al. SIRT1 inhibits transforming growth factor beta-induced apoptosis in glomerular mesangial cells via Smad7 deacetylation[J]. J Biol Chem, 2007,282:151.
20 Yamasoba T, Lin FR, Someya S, et al. Current concepts in age-related hearing loss: epidemiology and mechanistic pathways[J]. Hear Res, 2013,303:30.
21 Someya S, Yu W, Hallows WC, et al. Sirt3 mediates reduction of oxidative damage and prevention of age-related hearing loss under caloric restriction[J]. Cell, 2010,143:802.
22 Brenmoehl J, Hoeflich A. Dual control of mitochondrial biogenesis by sirtuin 1 and sirtuin 3[J]. Mitochondrion, 2013,13:755.
23 Guedes-Dias P, Oliveira JM. Lysine deacetylases and mitochondrial dynamics in neurodegeneration[J]. Biochim Biophys Acta, 2013,1 832:1345.

