大鼠内耳前体细胞的增殖研究*
曾亮 江红群
耳蜗在声音传导中充当着重要角色,耳蜗毛细胞或与之相关联的螺旋神经元的缺失或退化是导致绝大多数感音性聋的元凶[1]。Jero等[2]认为未来内耳疾病的主要治疗方式将是基因导入、生长因子注入以及干细胞移植,以恢复内耳的生物学基础结构。李华伟等[3]于2003年首次发现成年鼠内耳前庭器官存在干细胞,江红群等[4]亦报道耳蜗Corti器细胞培养可见细胞球形成,90.1%的球内细胞BrdU表达阳性,为未来感音神经性聋的治疗带来了希望。本研究拟通过解剖不同天龄SD大鼠的内耳前庭器官及耳蜗Corti器,获得内耳前体细胞,以探讨不同年龄及生长因子对大鼠内耳前体细胞体外增殖的影响。
1 材料与方法
1.1实验动物 出生后1天(P1)、7天(P7)、14天(P14)、21天(P21)、30天(P30)、60天(P60)的清洁级合格SD大鼠,由南昌大学医学院动科部提供。
1.2主要试剂 胰酶-EDTA、无血清培养添加剂B27、N2为美国GIBCO公司的产品;嗜热菌蛋白酶购自美国Sigma公司;胎牛血清、DMEM/F12(1:1)培养液购于美国HyClone公司;生长因子EGF、bFGF、IGF-1为美国Peprotech公司产品,生长因子LIF购自美国Millipore公司;Mouse anti-Nestin monoclonal antibody购于美国Santa Cruz公司,Mouse anti-Brdu monoclonal antibody为北京中彬金桥生物技术有限公司的产品;FITC标记的抗大鼠IgG为北京中彬金桥生物技术有限公司的产品;青/链霉素双抗、低溶点琼脂糖、BrdU购于北京Solarbio公司。
1.3内耳前体细胞的获得[3,4]选取出生后1、7、14、21、30、60天(P1、P7、P14、P21、P30、P60)的健康SD大鼠各12只(24耳),共72只(144耳),取耳蜗Corti器和前庭器官各36只(72耳)。麻醉、消毒后置于动物实验台上,断头,去除皮毛,无菌状态下分离出双侧颞骨,置入超净台中一含PBS(pH 7.4,冰浴)缓冲液的培养皿中,在解剖显微镜下完整暴露耳蜗和前庭。
1.3.1耳蜗 Corti器的分离 从上至下分离解剖开螺壳,暴露听觉上皮,用眼科镊细心将周围的螺旋缘和血管纹剥离,完整地将基底膜(包含有Corti器)与蜗轴分离开,移至一含有PBS液的离心管中,机械粉碎后在4 ℃恒温离心机中2 000 rpm离心5分钟。弃上清液,加入1 ml的0.125%胰酶,37 ℃环境下消化15分钟后,加入1 ml含10%胎牛血清的培养基终止消化5分钟,用烧口玻璃移液管吹打10余次,使单细胞从膜组织中脱落。
1.3.2球囊斑、椭圆囊斑感觉上皮的分离 使用尖针分别从蜗顶及圆窗挑破并移除耳蜗,自上而下暴露前庭器官,镜下可见两个相距不远的白色斑块,其中位于前庭后上方的为椭圆囊斑,位于前庭前下方的为球囊斑,利用尖针以及纤维镊小心分别完整游离出两个斑块,PBS液(pH 7.4,冰浴)漂洗后转移至含有嗜热菌蛋白酶(0.5 mg/ml)的试管中,消化30分钟后,获得纯净的椭圆囊斑或球囊斑感觉上皮,置入含有1 ml 0.125%胰蛋白酶的试管中,37 ℃环境下消化10分钟后,加入1ml含10%胎牛血清的培养基终止消化5分钟,用烧口玻璃移液管轻柔吹打10余次,使单细胞从膜组织中脱落。
1.3.3细胞收集及原代培养 分别收集上述两组细胞混合液于离心管中,在4 ℃恒温离心机中1 000 rpm/min离心沉降5分钟,弃上清液,添加适量配置好的无血清细胞培养液(DMEM/F12+ B27+ N2),重新制成细胞悬液,经50 μm的细胞滤网滤去较大的组织残骸以及碎片后,接种至经上述处理后的48孔细胞培养板中,定容成密度为1×104的细胞悬液,置入培养环境为37 ℃、5% CO2的细胞孵箱内,无血清低密度悬浮培养7天,每2天换半液一次。在倒置相差显微镜下计数、拍照。
1.4细胞球的定量研究及其数量变化曲线描绘
1.4.1计数细胞球标准 细胞呈球形或者椭球形,通过目镜测微尺在低倍视野下,耳蜗Corti器所获的细胞球直径约等于或大于100 μm,球囊斑和椭圆囊斑所获的细胞球直径约等于或大于50 μm;若有数个重叠的细胞球,则按一个计数,贴壁细胞球不参与计数。
1.4.2细胞球数量曲线描绘 统计分析各天龄细胞球数据(耳蜗Corti器、球囊斑、椭圆囊斑),计数资料以平均数和标准差表示,以年龄为横轴,细胞球数的平均数值为纵轴(以0作为起点),采用SPSS 17.0软件制作折线图。
1.5表皮生长因子(EGF)、成纤维细胞生长因子(bFGF)、胰岛素样生长因子(IGF-1)、白血病抑制因子(LIF)对内耳高增殖细胞增殖的影响 另选取健康P1 SD大鼠24只,分为每组6只(12耳),按前述获取内耳高增殖细胞及其培养方法,将单个耳蜗Corti器、球囊斑、椭圆囊斑三种内耳器官所获细胞分别随机接种到五组不同培养液中,其中不含生长因子培养条件下所获得的细胞球设为对照组,实验组则分别按照加的四种不同生长因子划分为四组:EGF组,bFGF组,IGF-1组,LIF组,均为20 ng/ml;悬浮培养,在37 ℃、5% CO2的细胞孵箱内悬浮培养7天,每2天换半液一次;第8天在倒置相差显微镜下以上述采纳标准对所获细胞球数量进行计数、拍照。
1.6细胞及细胞球特性鉴定
1.6.1贴壁 在超净台内,将预先准备好的特制爬片置入24孔培养板中(赖氨酸面朝上),收集P1SD大鼠刚取材的内耳高增殖细胞和经悬浮培养7天后所获得的细胞球,分别接种在特制爬片上,每孔均滴加适量含胎牛血清的培养液(10%FBS+DMEM/F12+B27+N2)进行诱导贴壁,在37 ℃、5% CO2的孵箱内培养,新分离的单细胞诱导贴壁6小时,而细胞球则诱导贴壁16小时;倒置相差显微镜下观察细胞及细胞球贴壁情况,捞取贴壁良好的爬片置入新的24孔培养板内,PBS缓冲液常温下漂洗3次,4%的多聚甲醛溶液固定30分钟,而后进行免疫细胞的化学荧光染色。
1.6.2免疫荧光标记 单个细胞进行nestin免疫荧光染色,而细胞球团分别进行nestin及BrdU免疫荧光染色。进行BrdU染色的细胞球在贴壁之前需通过含有BrdU试剂(10 μmol/L)的无血清培养液对内耳高增殖能力细胞进行悬浮培养7天后获取。①适量PBS液(0.01 mol/L,pH 7.4)漂洗3次,加入0.3%TritonX-100增加细胞通透性;② PBS漂洗3次后,用封闭剂(0.1%TritonX-100和10%封闭用山羊血清)室温下封闭30分钟;③滴加适量稀释后的一抗nestin(1:100)或BrdU(1:200)在爬片上,务必覆盖整个表面,置入湿盒内,避光,4 ℃环境下过夜;④0.1%TritonX-100液室温下漂洗3次;⑤滴加按比例稀释的二抗:FITC标记的山羊抗大鼠(1:100),置入37 ℃孵箱内,避光,50分钟;⑥ PBS液漂洗3次,加入少量DAPI染色液染核;⑦PBS液漂洗3次,封片,荧光显色,拍照。
1.7统计学方法 用SPSS17.0软件,对结果进行方差分析。
2 结果
2.1细胞球的形态 第8天,孔内形成的球团数量不再变化,故选取培养7天后的细胞球进行计数,大多数形状规则呈球形或椭球形(图1)。相同培养环境下,添加适量生长因子的实验组培养7天后同样倍数的视野下观察,可看见簇拥或重叠在一起的细胞球(图2)。

图1 培养第8天所形成的细胞球(×400)
2.2细胞球数量的增龄性变化
2.2.1单个耳蜗Corti器 P1及P7 SD大鼠耳蜗内所取细胞在无血清悬浮培养的条件下,随时间增长,可见数量不等的细胞球形成,形态多呈规则的球形或椭球形,P1大鼠单个Corti器可形成细胞球数为50±23个,P7大鼠为33±15个,总体均数相等,差异有统计学意义(方差分析,P=0.041<0.05)。随着天龄的增长,形成的细胞球数量呈下降趋势,而P14、P21、P30、P60大鼠所取细胞同样条件下培养,无细胞球形成,其内可能不存在增殖细胞。
2.2.2球囊斑、椭圆囊斑 P1、P7、P14、P21、P30、P60 SD大鼠所取细胞在无血清悬浮培养的条件下,随时间增长,可见数量不等的细胞球形成,形态多呈规则的球形或椭圆形,与耳蜗Corti器内前体细胞所形成的球体相比,其数量较少,直径较小。分别统计各天龄段球囊斑组及椭圆囊斑组形成的细胞球数,并进行方差分析(多个样本均数间的多重比较),总体方差不全相等,(方差齐性Levene检验,F=0.002和0.011,均小于0.10),将所有数值对数变换后再行检验得F值大于0.10,符合方差齐性。将变换后数据列表进行多样本均数间多重比较结果见表1、2。各天龄段大鼠球囊斑及椭圆囊斑形成的细胞球数平均值绘成的折线图见图3,可见总体趋势均表现为随着天龄的增长,形成的细胞球数量下降。球囊斑高增殖细胞减少主要集中在出生后第1天至21天,而椭圆囊斑高增殖细胞减少主要集中在出生后第1天至30天;除出生后21天的大鼠外,其他同天龄段大鼠两种前庭器官内高增殖细胞的增殖能力无差异。

表1 各天龄段SD大鼠单个球囊斑形成细胞球数(个,及统计P值

表2 各天龄段SD大鼠单个椭圆囊斑形成细胞球数(个,及统计P值
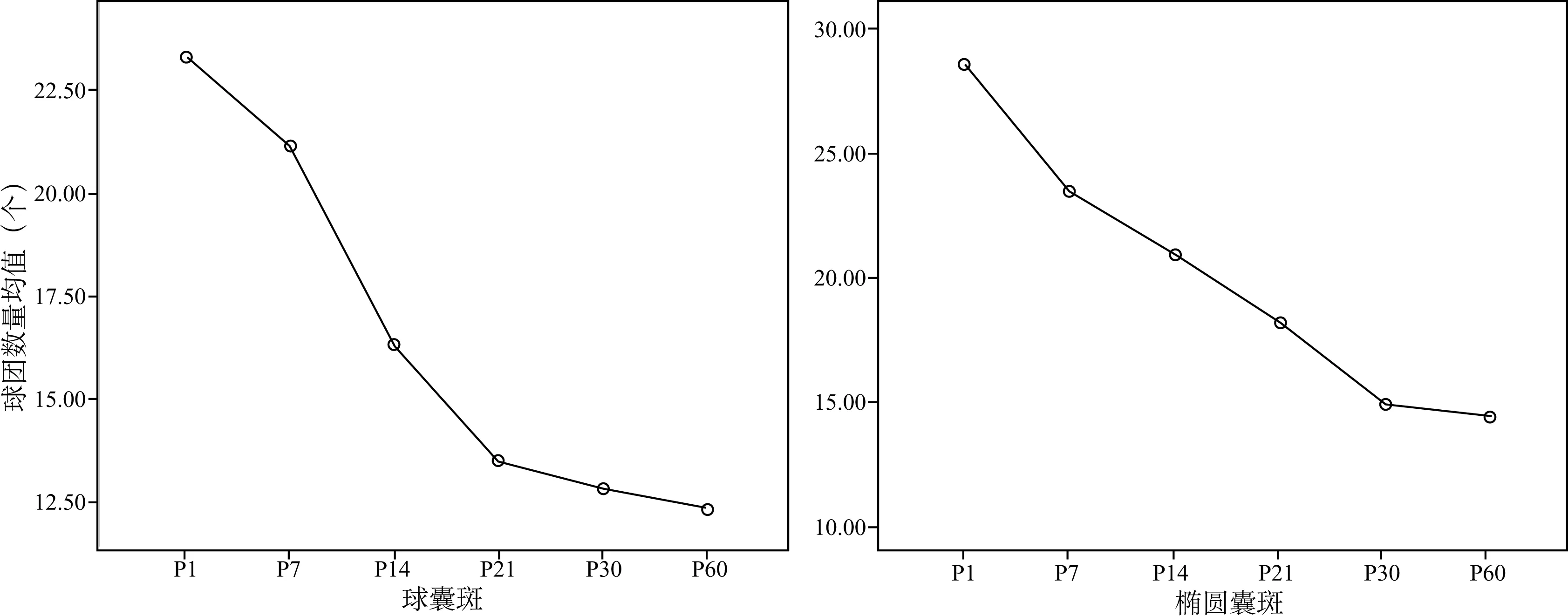
图3 培养7天后,P1至P60大鼠球囊斑和椭圆囊斑细胞球数量均值折线图
2.3生长因子对细胞球数量的影响 与对照组比较,添加了EFG、bFGF、IGF-1的培养板中单个器官细胞球数量明显增加(P<0.01),而添加LIF因子的培养液中细胞球数目则无明显变化(P>0.05)(表3~5)。

表3 P1大鼠各组单个耳蜗Corti器形成细胞球数(个,及统计P值

表4 P1大鼠各组单个球囊斑形成细胞球数(个,及统计P值

表5 P1大鼠各组单个椭圆囊斑形成细胞球数(个,及统计P值
2.4内耳高增殖细胞及所形成细胞球的免疫荧光特性
2.4.1耳蜗Corti器、球囊斑、椭圆囊斑所获悬浮单细胞,贴壁后经抗体nestin荧光染色标记后可见,其中有细胞染色阳性,表达出神经干细胞的特性(图4)。
2.4.2特异性BrdU抗体染色标记后可见,大部分球内细胞的细胞核染色阳性,表明球团内存在有自我更新能力的细胞(图5);特异性的nestin抗体染色可见球内细胞的细胞质同样呈现出阳性反应,可以认为该球团由有神经干细胞特性的细胞增殖分裂而来(图6)。

图4 单细胞免疫荧光染色图片 表现为nestin阳性(a~c分别为nestin、DAPI、融合图像)
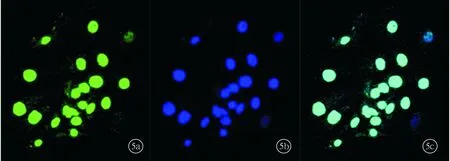
图5 细胞球团免疫荧光染色图像 球团内细胞的细胞核表现为BrdU阳性(a~c分别为BrdU、DAPI、融合图像)
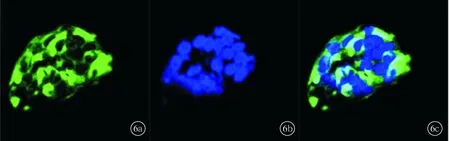
图6 细胞球团免疫荧光染色图像 球体内细胞的细胞质表现为nestin阳性(a~c分别为nestin、DAPI、融合图像)
3 讨论
3.1内耳细胞及细胞球的干细胞特性 以细胞技术治疗感音神经性聋,主要目的就是重塑内耳结构,恢复生理功能,可以通过自体、同种异体或者是异种的干细胞内耳移植与损伤处内耳细胞自我修复两种途径实现,其中关于细胞移植的研究已进行了数十年,相比于它,后者更是一种让人满意、充满前途和希望的治疗方式[5]。内耳细胞自身修复方式主要包括内耳干细胞的诱导分化以及支持细胞的转化。本世纪初即有学者自内耳前庭器官感觉上皮内分离出有高增殖能力的细胞[3],近几年来亦有学者不断从哺乳动物耳蜗、椭圆囊斑等器官的感觉上皮中提取细胞,体外悬浮培养形成细胞球[6~8],他们认为这些从耳内特殊区域所获得的增殖细胞,具有修复或替代损伤感觉上皮的功能,是未来临床治疗耳聋的关键。亦有研究者在体外特定的环境下将人的骨髓间叶干细胞[9]和多能干细胞[10]增殖诱导分化成内耳前体细胞,并表达其特性。本研究分离SD大鼠内耳三大器官的的感觉上皮细胞,在体外无血清悬浮培养后,得到了大量细胞球,并分别对单细胞及细胞球进行了干细胞的特性鉴定,证实其具有干细胞的特征。
3.2干细胞增殖能力的增龄变化 在细胞移植治疗疾病的实验中,高增殖能力的细胞可提高成功率,干细胞具有高增殖分化能力的特性,但其增生分裂的能力受多种因素影响,包括生存微环境、某些信号转导途径、核内DNA损伤以及干细胞自身的衰老。兔的角膜缘干细胞能表达特异的细胞膜蛋白,利用RT-PCR可以检测到该标志物的mRNA含量,将白兔分成青年、中年、老年3组,培养后发现干细胞表达的标志物mRNA随年龄增长逐渐下降,为非线性过程[11]。有学者[12]结扎大鼠的冠脉造成心肌梗死后迅速注入人间质干细胞(human mesenchymal stem ceds,hMSCs),分别于注入后1、2、4周测试心功能,发现年幼的hMSCs提高心梗后心功能的效果要高于衰老的hMSCs。
本研究通过比较不同天龄的SD大鼠相同器官内耳单细胞体外悬浮培养形成细胞球数量,发现来源于P1耳蜗内的高增殖细胞较来源于P7的细胞增殖能力更强,而P14及以后各天龄段大鼠耳蜗内细胞无细胞球形成。推测大龄鼠的耳蜗内高增殖细胞基本分化为终末细胞,也可能是由于体外培养条件不能诱导该类增殖细胞恢复增殖能力。另外,文中结果显示前庭器官内高增殖细胞表现为随着年龄的增长,呈现出下降态势;与前庭器官比较,耳蜗Corti器内高增殖细胞的增殖能力减退更快,出生后14天大鼠耳蜗内Corti器即未能发现高增殖细胞,前庭器官内高增殖细胞的增殖能力下降缓慢,持续至出生后60天仍可见高增殖细胞。
3.3不同生长因子对干细胞增殖能力的影响 细胞工程学的目的是将增殖细胞移植入损伤组织内,诱导其增殖分化,以替换这些病态细胞,在这个过程中,生长因子扮演了重要的调控角色。近年来发现不同生长因子可促进或抑制增殖细胞的增殖能力,NGF可以促进MSCs的增殖,并激活PI3K/Akt信号传导通路,以诱导其分化生成血管[13];Keerl等[14]在研究新分离的脂肪干细胞增殖分化成毛细血管样结构的过程中,发现PDGF联合bFGF在其中起到决定性作用;文献[15~17]报导EGF、bFGF、IGF-1以及LIF这4种生长因子可影响增殖细胞的增殖能力。本研究同样发现在添加了EGF、bFGF、IGF-1生长因子的实验组中,细胞球团数量较空白对照组明显增多,但对细胞球的形态和体积无明显影响,因此认为这3种生长因子对内耳高增殖细胞的增生分裂有促进作用;而LIF对于内耳器官增殖细胞则没有明显的促增生分裂作用,与李华伟等[3]研究结果相符,但也有研究[18]称LIF可促进来源于SGNs的神经干细胞的增生分裂,而抑制其分化。
内耳高增殖细胞相对其他干细胞具有巨大优势,如果可以通过激发损伤部位原有的增殖细胞增生分化出新的功能细胞来修复或补充受损细胞,不仅可以避免体外增殖细胞耳内移植的繁琐步骤和风险,而且可以避免异种细胞排斥的问题。本研究还发现某些生长因子对内耳器官增殖细胞的增殖能力有促进作用,为未来探讨影响内耳增殖细胞增生分裂的微环境奠定了基础,Okano等[19]观察到IGF因子信号途径可以调控小鼠耳蜗内感觉细胞的分化时间,为未来调控内耳增殖细胞分化能力提供新的方向。
4 参考文献
1 Matsui JI,Parker MA,Ryals BM,et al.Regeneration and replacement in the vertebrate inner ear[J].Drug Discov Today,2005,10:1307.
2 Jero J,Aarnisalo A.Future therapeutic options for inner ear disease[J].Duodecim,2011,127:848.
3 Li HW,Liu H,Heller S.Pluripotent stem cells from the adult mouse inner ear[J].Nature Medicine,2003,9:1293.
4 江红群,王正敏,沈云珍,等.新生大鼠耳蜗增殖细胞的培养鉴定及超微结构观察[J].中华耳鼻咽喉头颈外科杂志,2007,42:42.
5 Wei D,Yamoah EN.Regeneration of the mammalian inner ear sensory epithelium[J].Curr Opin Otolaryngol Head Neck Surg,2009,17:373.
6 Diensthuber M,Heller S.Characterization of stem cells derived from the neonatal auditory sensory epithelium[J].HNO,2010,58:1056.
7 Oshima K,Senn P,Heller S.Isolation of sphere-forming stem cells from the mouse inner ear[J].Methods Mol Biol,2009,493:141.
8 Oiticica J,Barboza-Junior LC,Batissoco AC,et al.Retention of progenitor cell phenotype in otospheres from guinea pig and mouse cochlea[J].J Transl Med,2010,8:119.
9 Boddy SL,Chen W,Romero-Guevara R,et al.Inner ear progenitor cells can be generated in vitro from human bone marrow mesenchymal stem cells[J].J Regen Med,2012,7:757.
10 Koehler KR,Mikosz AM,Molosh AL,et al.Generation of inner ear sensory epithelia from pluripotent stem cells in 3D culture[J].J Nature,2013,500:217.
11 李强,马蕾.增龄对兔角膜缘干细胞标志物ABCG2表达的影响[J].山西医药杂志,2009,38:608.
12 Fan M,Chen W,Liu W,et al.The effect of age on the efficacy of human mesenchymal stem cell transplantation after a myocardial infarction[J].Rejuvenation Res,2010,13:429.
13 Wang WX,Hu XY,Xie XJ,et al.Nerve growth factor induces cord formation of mesenchymal stem cell by promoting proliferation and activating the PI3K/Akt signaling pathway[J].Acta Pharmacol Sin,2011,32:1 483.
14 Keerl S, Gehmert S, Song YH. PDGF and bFGF modulate tube formation in adipose tissue-derived stem cells[J].Ann Plast Surg,2010,64:487.
15 Yu JM,Bunnell BA,Kang SK.Neural differentiation of human adipose tissue-derived stem cells [J].Methods Mol Biol,2011,702:219.
16 Puri G,Kumar K,Singh R,et al.Effects of growth factors on establishment and propagation of embryonic stem cells from very early stage IVF embryos and their characterization in buffalo [J].Int J Stem Cells,2012,5:96.
17 Kouroupi G,Lavdas AA,Gaitanou M,et al.Lentivirus-mediated expression of insulin-like growth factor-1 promotes neural stem/precursor cell proliferation and enhances their potential to generate neurons [J].J Neurochem,2010,115:460.
18 Whitlon DS, Grover M, Tristano J, et al. Culture conditions determine the prevalence of bipolar and monopolar neurons in cultures of dissociated spiral ganglion[J].Neuroscience,2007,146:833.
19 Okano T,Xuan S,Kelley MW.Insulin-like growth factor signaling regulates the timing of sensory cell differentiation in the mouse cochlea[J].J Neurosci,2011,31:18104.

