FeNi3催化剂的制备及其对NaBH4水解制氢的催化活性评价
姚海瑞,郑喜俊,张 军,李晶晶,白孝康
(河南科技大学化工与制药学院,河南 洛阳 471023)
FeNi3催化剂的制备及其对NaBH4水解制氢的催化活性评价
姚海瑞,郑喜俊,张 军,李晶晶,白孝康
(河南科技大学化工与制药学院,河南 洛阳 471023)
以水溶性镍盐和铁盐为金属源,通过水合肼作为还原剂,聚乙烯吡咯烷酮作为模板和稳定剂,采用水热法在碱性溶液中制备出了双金属化合物FeNi3。考察了聚乙烯吡咯烷酮和碱液浓度对产物形貌和物相的影响,借助X射线粉末衍射和透射电镜手段,分别对产物进行了表征和分析。同时,通过调控不同的反应条件,比较了FeNi3以及不同形貌的Ni粉对于NaBH4水解产氢速率的影响,从而对FeNi3的催化活性进行了评价。研究结果表明:在试验设定的条件下,所得产物均为结晶度良好的微纳米整比化合物FeNi3,聚乙烯吡咯烷酮的加入能够有效地改善产物的结晶习性,而且有助于形成粒径均匀的高分散性微纳米菱形片形状;在相同的水解条件下,30℃时,反应开始后10 min内FeNi3对NaBH4的催化水解制氢速率比单质金属镍微粉高出26.8%以上,表明FeNi3的催化活性明显高于单质镍粉。
制备;FeNi3;NaBH4;产氢;催化
0 引言
金属(或类金属)组元按照一定化学配比有序结合形成的金属间化合物,晶体构型有别于相应的单质金属晶体[1],在微观结构和物相上,兼具金属单质和化合物的双重特点。金属间化合物的组成复杂,大致可归结为两大类:一类是按金属元素的周期系“族价”,金属间直接以“族价”相结合,如:Mg2Sn和Mg2Pb(Mg的“族价”为二价,Sn、Pb则是四价元素);另一类则属于电子化合物,其组成决定于两种金属的电子数和原子数之比,周期族系Ⅷ族元素Fe、Co、Ni等所构成的金属间化合物Ni3Al、Co3V就属此类。与单质金属或类金属相比,金属间化合物具有独特的电学、磁学和声学等物理化学性质,因而在半导体材料、形状记忆材料、储氢材料和磁性材料等领域用途广泛[2-3]。尤为重要的是,金属间化合物良好的化学稳定性,赋予其优异的抗蚀、抗毒能力,在用作高效催化剂方面具有较大潜力。
微纳米金属铁具有强磁性,常用作高密度磁记录材料,而金属镍微粉则具有较高的催化活性,被广泛用作加氢、脱氢等过程的催化剂[4]。通过在适宜工艺条件下,将金属镍与金属铁相互化合,形成金属间化合物,兼具两种金属元素各自的性能特点,可望获得一种具有磁选分离特点、低成本的新型高效催化剂。因此,镍铁间金属化合物的研究引起了科技界的广泛关注。文献[5]以NaBH4为还原剂,油酸为分散剂,采用液相还原法制备出纳米铁镍前躯体,通过氮气保护,500℃焙烧,得到平均粒径为30 nm的球形FeNi合金,产物呈现超顺磁性;文献[6-7]则通过水热合成路线,制备了链状、球状和花状的铁镍合金化合物FeNix;同时,也有学者对不同形貌镍铁化合物的形成机制进行了探讨[8]。但是,上述工作并未对产物的催化活性进行系统地研究。
本研究采用聚乙烯吡咯烷酮(PVP)为模板和稳定剂,通过调控溶液的碱性,借助于水热合成路线,一步法制备了微纳米尺度的菱片状FeNi3,并以NaBH4水解制氢作为探针反应,详细考察对比了产物FeNi3和金属镍粉对产氢速率的影响,从而对产物FeNi3的催化性能进行了科学评价。
1 试验部分
1.1 试验原料及仪器
乙酸镍(Ni(CH3COO)2·4H2O,99.0%,分析纯),硝酸铁(Fe(NO3)3·9H2O,98.5%,分析纯),氢氧化钠(NaOH,96.0%,分析纯),水合肼(N2H4·H2O,80%,分析纯),聚乙烯吡咯烷酮((C6H9NO)n,PVP,K30,M r=10 000),所有试剂使用前均未作进一步纯化处理;试验用水来自本实验室自制的二次蒸馏水。采用Advance-D8型X射线粉末衍射(XRD)仪(德国Bruker公司)分析产物样品的物相,测试条件为0.154 06 nm铜靶Kα射线,电压和电流分别为35 kV、35 mA;产物的形貌和粒径大小分析,在H-800型透射电子显微镜(TEM)(日本Hitachi公司)上完成。
1.2 双金属FeNi3催化剂的合成
称取0.200 0 g PVP和2.540 0 g四水乙酸镍先后溶于60 m L蒸馏水中,常温下搅拌30 min,得均匀绿色透明溶液,再加入适量的NaOH固体,搅拌使其完全溶解;然后,加入10 m L水合肼,搅拌均匀,按照n(Fe)∶n(Ni)=1∶3的比例,加入相应量的硝酸铁,搅拌,充分混合。将混合溶液转移至100 m L聚四氟乙烯衬里的高压反应釜中,填充率为80%,于160℃下静态水热反应8 h。反应完毕,冷至室温,倾析,取出黑色固体产物,用蒸馏水和乙醇依次洗涤3~5次,然后置于60℃下真空干燥6 h,即可获得黑色FeNi3粉末。相同操作,改变PVP加入量、NaOH的浓度等条件,同样可研究这些因素对产物物相和形貌的影响。
1.3 FeNi3催化剂活性的评价方法
在一定浓度的NaBH4溶液中,加入NaOH以维持适当碱性,然后加入不同类型、不同质量的催化剂(FeNi3或Ni),分别考察各反应条件下单位时间内的水解产氢量,以评价催化剂的催化能力。选用适当容积的三口烧瓶,中口加料,其余两个口分别安装温度计和排水集气装置,烧瓶置于恒温水浴中以保持温度恒定,用防水式磁力搅拌器对反应液进行扰动。将一定量催化剂、适量的NaBH4碱性水溶液依次放入烧瓶,水解反应发生后,间隔计时,并记录产氢气的体积。
2 结果与讨论
2.1 产物的物相表征
按照n(Fe)∶n(Ni)=1∶3的比例,配制Ni2+浓度为0.1 mol/L的混合金属离子溶液,调整混合液的NaOH浓度为4 mol/L,控制PVP添加量为0.034 g/m L,在160℃水热温度条件下,反应8 h,所得产物的XRD测试结果如图1所示。分析图1发现:该图与国际粉末衍射标准联合会(JCPDS)公布的No.38-0419的PDF数据能够很好地相一致,即在2θ衍射角为44.28°、51.72°和75.82°这3个位置分别出现了FeNi3物相的(111)、(200)和(220)晶面,其空间群相应为Pm-3m[221],立方相结构,晶胞参数为0.354 5 nm×0.354 5 nm×0.354 5 nm(90°×90°×90°)。图谱中未见其他杂峰,表明没有其他杂质出现,且FeNi3物相的纯度较高,同时也证实了两种金属被还原后,形成了双金属化合物晶体。相同操作下,改变试验条件后,所得产物的XRD图谱均与此类似,相应图谱省略。
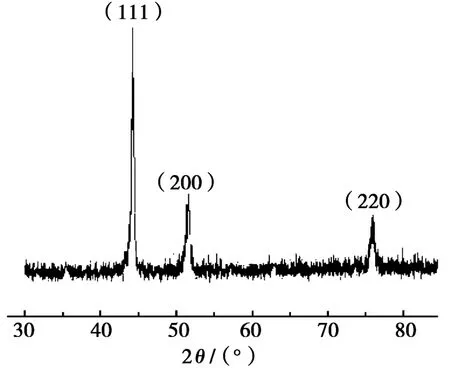
图1 温度160℃、反应8 h,所得FeNi3的XRD图谱
2.2 产物形貌
2.2.1 PVP对产物形貌的影响
为了考察PVP的加入及其添加量(M)对产物形貌的影响,本文通过改变水热合成溶液体系中PVP的浓度大小,对所得产物进行TEM观察和分析,从而评判了PVP对产物形貌的调控作用。图2表示:当水热时间8 h,反应温度160℃,n(Ni)∶n(Fe)=3∶1,Ni浓度0.1 mol/L,且NaOH浓度为4 mol/L时,控制PVP添加量分别为0 g/m L、0.017 g/m L、0.034 g/mL时,所得FeNi3产物微粒的TEM图。

图2 160℃下,反应时间8 h,PVP添加量(M)不同时,产物FeNi3的TEM图
当不加入PVP(浓度为0 g/m L)时,产物FeNi3的外形如图2a所示,产物微粒呈不规则的短棒状(A-1),它由许多细小颗粒以串链状相互垒积、衔接而成,棒长约200 nm,直径约20 nm。保持其他反应条件不变,加入0.017 g/m L PVP时,短棒状产物逐渐收缩聚集成团,如图2b所示,出现了多边形结构的规则颗粒(B-2),但颗粒间界面模糊,团聚较多,分散性不好,颗粒大小不一,而且,还出现了六角片状(B-3)的规则结构,虽然仍可看到有部分短棒状结构存在(B-1),不过其数量已经变得很少,且棒径变小。当PVP加入量达到0.034 g/m L时,产物形貌逐渐清晰(见图2c),颗粒感增强,有明显棱角,形成平均粒径约为50 nm的以菱形片状(C-1)为主的微纳米颗粒,仍残留很少量的不规则结构(C-2),未能形成多边形颗粒,这可能是由于反应时间过短或反应温度不足而致。
2.2.2 NaOH浓度对产物形貌的影响
保持反应温度160℃,反应时间8 h,n(Ni)∶n(Fe)=3∶1,Ni2+浓度0.1 mol/L,且PVP加入量维持在0.034 g/m L,调节NaOH的浓度(N)分别为0.5 mol/L、2.0 mol/L、4.0 mol/L,图3展示了相应条件下所得FeNi3产物的TEM测试结果。

图3 NaOH浓度(N)不同时所得FeNi3的TEM图
从图3可以看出:NaOH浓度不同,产物的形貌差异很大。当NaOH浓度为0.5 mol/L时,产物的TEM图如图3a所示,此时产物类似于小球状结构,单体颗粒粒径很小,约10 nm,表面粗糙,互相黏结,团聚现象非常严重。图3b则表示NaOH浓度为2.0 mol/L时所得产物的TEM图,此时产物的形貌发生了很大变化,颗粒变得规则有序,粒径增大,大部分产物微粒已经开始向规则多边形(b-1)转变,虽有团聚现象,但已不像图3a那样严重。当NaOH浓度增大至4.0 mol/L时(见图3c),产物形貌进一步明晰,颗粒大小趋于一致,粒径均约30 nm,呈微纳米菱形片状(c-1),几乎无团聚,分散性显著改善。
关于双金属化合物FeNi3特殊形貌的形成机理,本文试作如下解释:FeNi3双金属晶体特殊形貌的形成,主要因晶体沿着某一晶面的定向生长所致。外在工艺条件,如PVP、NaOH、反应温度和时间等是影响晶体定向生长的重要因素。在FeNi3双金属晶体制备过程中,主要涉及到如下反应:
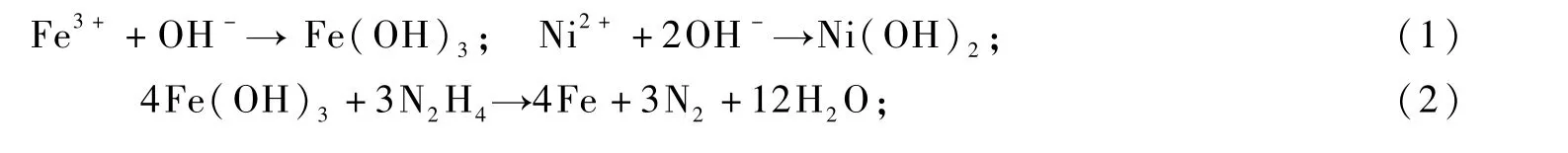
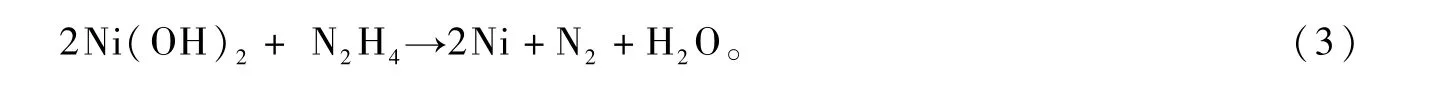
在碱性溶液中,Fe3+、Ni2+首先与OH-结合,形成基于Fe(OH)3和Ni(OH)2的双电层结构胶体离子,使得溶液中的游离态金属离子浓度下降,从而使还原反应的速率受到有效控制,有利于初生态晶粒的有序、定向生长[9]。另外,PVP分子中的O和N原子能够提供孤电子对,与金属离子形成配位键,也可对金属离子起到稳定和降低浓度的作用[10];同时,PVP分子中O原子的配位能力强于N原子,这种不对称的配位作用,使得初生态FeNi3晶粒的不同晶面受到不同程度的“封盖”,致使各晶面生长速率不同,从而呈现不对称的面和棱[11]。在FeNi3晶体的形核和生长过程中,OH-和PVP的协同作用,是形成菱片状特殊形貌晶体的关键因素[12]。
2.3 催化活性评价
2.3.1 FeNi3催化活性的评价
NaBH4水溶液可以发生水解产生氢气:NaBH4+2H2O→4H2+NaBO2,但在常温常压下该反应自发进行的速度很低,只有借助适当的催化剂,才能够有效提升其产氢速率。前期研究结果表明:在碱性条件下,不同形貌的金属镍粉和非晶态合金[13]均可用作NaBH4水解的催化剂,能够提高产氢速率。为此,通过设置与前期研究同样的试验条件,即溶液中NaBH4和NaOH浓度均设定为5%(质量分数)、催化剂FeNi3的加入量为0.8 mg/m L,详细考察了5组温度(20℃、25℃、30℃、35℃、40℃)下,NaBH4溶液水解产氢的体积和速率,具体结果如图4所示。
分析图4发现:在20~40℃,FeNi3的催化活性均随温度的升高而升高,但一定时间后反应速率不再变化。40℃温度下,反应进行到18 min,产氢量即可达到最大值(149 m L),然而,20℃下达到最大产氢量(149 m L)需要时间则为50 min。其余3个温度(35℃、30℃和25℃)条件下,达到最大产氢量的时间分别为25 min、27 m in和39 m in,均比40℃温度下有不同程度的延长。在达到最大产氢量之前,5个温度下的产氢量与时间之间,基本上均呈单调的线性上升关系。在反应开始后的前10 min之内,从高到低5个温度下的产氢速率分别为7.3 m L/m in、5.9 m L/min、5.2 m L/m in、3.7 m L/min、2.1 m L/m in,依次下降,变化趋势非常明显。与20℃时的产氢速率(2.1 m L/m in)相比,25℃、30℃、35℃和40℃条件下的产氢速率分别提高了76.2%、147.6%、181.0%和247.6%。由此可见,适当提高反应温度,可以较大幅度地提高催化剂FeNi3的催化性能。
2.3.2 不同形貌金属镍粉催化活性的对比评价
为了对比评价FeNi3的催化性能,本文以自制的不同形貌单质微纳米镍粉作为催化剂,采取与FeNi3催化水解NaBH4溶液相同的试验工艺条件,同时将温度设置为30℃,测定了相应的产氢量,并计算了产氢速率,试验结果如图5所示。
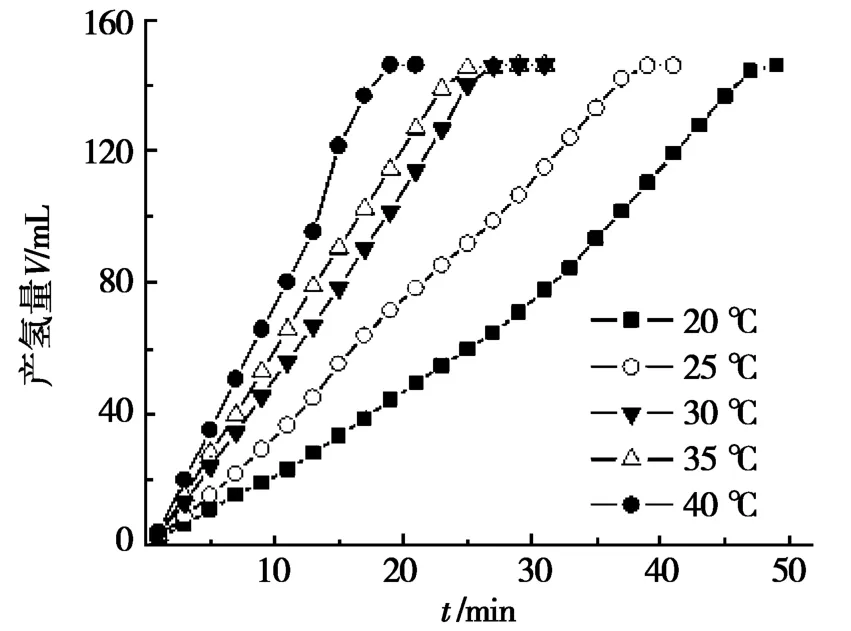
图4 5%NaBH4、5%NaOH,不同温度对FeNi3催化水解NaBH4产氢速率的影响
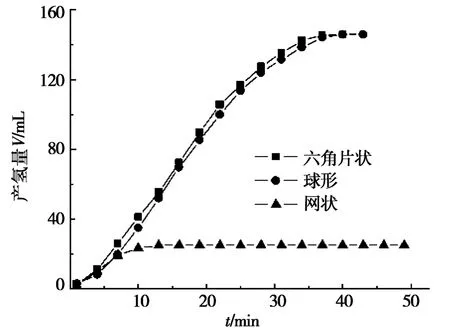
图5 NaBH4与NaOH浓度均为5%,温度30℃,Ni粉催化剂形貌对产氢速率的影响
图5显示:在反应开始后5 m in内,3种形貌的单质镍粉催化产氢速率基本相同。反应至10 m in时,网状微纳米镍粉催化水解产氢量达到最大值28 m L,继续水解反应,产氢量基本不再增加。对于六角片与球形镍粉,10 min时的产氢量并未达到最大值,继续反应,产氢量仍持续上升,且两者的产氢速率非常接近,当反应进行到38 m in时,两者几乎在同时到达最大产氢量148 m L。计算可知:在反应进行到10 min时,六角片状、球形与网状微纳米镍粉催化剂的平均产氢速率分别为4.1 m L/min、3.8 m L/min和2.8 m L/m in,其中以网状镍粉的产氢速率最低。
将图4与图5进行比较不难发现:在相同的催化水解反应条件下,分别采用FeNi3以及不同形貌(六角片状、球形与网状)的单质微纳米镍粉作为催化剂来催化水解NaBH4溶液,反应进行至10 m in时,产氢速率分别为5.2 m L/min、4.1 m L/min、3.8 m L/min和2.8 m L/min。六角片状微纳米镍粉的产氢速率在3种单质镍粉中为最大,虽然达到了4.1 m L/m in,但与FeNi3的产氢速率5.2 m L/m in相比,FeNi3的催化效率仍然要比六角片状单质镍高出26.8%。因此可以判断,两种类型镍基催化剂催化能力大小的顺序应为:FeNi3>六角片状Ni>球形Ni>网状Ni。
3 结论
以水合肼为还原剂,PVP为模板和稳定剂,采取水热处理,成功制备出具有特殊形貌的双金属互化物FeNi3催化剂,并通过与单质镍粉催化水解NaBH4的产氢速率进行比较,科学评价了FeNi3的催化能力。综合分析结果表明:(1)所得产物为分散性好、结晶度高的微纳米菱片状双金属化合物FeNi3;(2)PVP和NaOH是形成菱形片的关键因素,较低的PVP浓度不足以对晶核形成有效包覆,不能形成明显的棱角;NaOH为反应提供了必要的碱性环境,而且铁盐和镍盐所形成的氢氧化物所固有的内在性结构也是菱形片形成的基础;(3)在催化NaBH4水解过程中,相同反应条件下,水解温度同为30℃时,反应开始后10 min内,FeNi3的催化率高出单质镍粉26.8%以上,即产物FeNi3的催化活性明显高于金属单质镍粉。
[1] 陈国良.金属间化合物材料结构研究现状与发展[J].材料导报,2000,14(9):1-5.
[2] 陈健,郑启,唐亚俊,等.NiAl基金属间化合物多晶和单晶合金的力学性能研究[J].航空材料学报,1996,16(3):1-10.
[3] 彭超群,黄伯云,贺跃辉.TiAl基合金的工艺-显微组织-力学性能关系[J].中国有色金属学报,2001,11(4):527-541.
[4] 朱全力,赵旭涛,赵振兴,等.加氢脱硫催化剂与反应机理的研究进展[J].分子催化,2006,20(4):372-383.
[5] 罗驹华.铁镍纳米合金的制备与表征[J].化学研究与应用,2008,20(8):1018-1020.
[6] Chen Y C,Zheng F C,Min Y L,et al.Synthesis and Properties of Magnetic FeNi3Alloyed M icro-chains Obtained by Hydrothermal Reduction[J].Solid State Sci,2012,14(7):809-813.
[7] Liu L J,Guan JG,ShiW D,et al.Facile Synthesis and Growth Mechanism of Flowerlike Ni-Fe A lloy Nanostructures[J]. J Phys Chem C,2010,114(32):13565-13570.
[8] Zhou X M,Wei X W.Single Crystalline FeNi3Dendrites:Large Scale Synthesis,Formation Mechanism,and Magnetic Properties[J].Cryst Grow th Des,2009,9(1):7-12.
[9] 庄玉贵.纳米级氢氧化镍电极材料的研究进展[J].电源技术,2007,131(5):425-428.
[10] Zhang Z T,Zhao B,Hu L M.PVP Protective Mechanism of Ultrafine Silver Powder Synthesized by Chemical Reduction Processes[J].JSolid State Chem,1996,121(1):105-110.
[11] Sui X M,Liu Y H,Shao C L,et al.Structural and Photo-luminescent Properties of ZnO Hexagonal Nanoprisms Synthesized by M icro-emulsion with Polyvinyl Pyrrolidone Served as Surfactant and Passivant[J].Chem Phy Lett,2006,424(4/6):340-344.
[12] Li F,Ding Y,Gao P X,et al.Single-crystal Hexagonal Disks and Rings of ZnO:Low Temperature,Large-scale Synthesis and Growth Mechanism[J].Angew Chem Int Ed,2004,116(39):5350-5354.
[13] 张军,李莉莉,王修才,等.反相微乳液法制备纳米NiB非晶态合金及其催化NaBH4水解制氢[J].河南科技大学学报:自然科学版,2013,34(3):91-95.
TQ423;O614
A
1672-6871(2014)05-0100-05
国家自然科学基金项目(21076063);河南省科技攻关基金项目(102102210170);洛阳市科技攻关基金项目(1101030A);洛阳市矿产资源化工重点实验室建设基金项目(1003016A)
姚海瑞(1989-),女,河南信阳人,硕士生;张 军(1964-),男,河南漯河人,教授,博士,硕士生导师,研究方向为无机功能材料.
2013-12-30

