白细胞介素-6与胃癌易感性的相关研究
李湘楚,熊建光,程正位,吴 娟 ,刘启胜
咸宁市中心医院消化内科,湖北咸宁437000
胃癌是世界上最常见的恶性肿瘤之一,在全球范围内,胃癌发病率位居恶性肿瘤的第四位,其死亡率位居第二位,仅次于肺癌。据估计,在2008年全球约有100万新发胃癌病例,其中70%的胃癌病例发生在发展中国家,大约50%以上的新发胃癌病例在中国[1]。众所周知,幽门螺杆菌(H.pylori)感染被认为是胃癌的一个重要的危险因素,全球大约有50%的人感染H.pylori,但在感染者中只有约1%的人发展为胃癌[2]。因此,胃癌的发展不是由单一因素导致,它是环境、遗传及其他多因素共同作用的结果。
白细胞介素-6(interleukin-6,IL-6)是一种多功能的细胞因子,在体内可对多种细胞功能产生影响,其宿主遗传学基因的不稳定性能够增加促癌基因的激活及肿瘤的抑癌基因失活,最终导致肿瘤的生长[3]。临床研究发现胃癌患者的血清中,肿瘤组织的IL-6水平显著性增高[4]。因此,推测IL-6基因多态性可能对肿瘤的易感性起到了重要的作用。有研究结果发现IL-6 174G/C和IL-6 572G/C单核苷酸多态性的G到C突变能够影响IL-6的基因转录,因而肿瘤组织中的IL-6水平显著性的高于对照组[5]。本地为胃癌高发地区,IL-6 174G/C和IL-6 572G/C基因多态性与胃癌风险相关关系尚不清楚,另外,IL-6 174G/C和IL-6 572G/C基因多态性是否与H.pylori感染有交互作用也尚不清楚。本研究的目的是评价本地区IL-6 174G/C和IL-6 572G/C基因多态性与胃癌风险的相关关系,以及IL-6基因多态性与H.pylori感染和吸烟的交互作用。
1 资料与方法
1.1 一般资料 选取2008年1月-2011年5月咸宁市中心医院新发胃癌246例,男152例,女94例,平均年龄(55.7±8.3)岁。所有患者均由病理所证实。纳入同一时间在咸宁市中心医院体检的非肿瘤患者作为对照组,共274例,男179例,女95例,平均年龄(56.3±8.5)岁。所纳入的对照组经过体检证实无任何肿瘤病史。胃癌组和对照组的人口学特征均由自行设计的问卷,采用一对一问卷方式收集相关信息,包括性别、年龄、吸烟和饮酒情况。
1.2 幽门螺杆菌检测 纳入的病例组和对照组均提取静脉血2 ml,分离血清,-20℃低温保存。采用酶联免疫吸附法(ELISA)测定血清H.pylori IgG,实验结果判定均按照试剂盒说明书进行。
1.3 DNA提取及分型 所有研究对象空腹抽取静脉血5 ml,12 000 rpm离心2 min。将DNA溶液转入1.5 ml EP管中,-20℃保存备用。采用TIANamp blood DNA kit(天根生化科技有限公司,北京,中国)试剂盒提取人白细胞DNA。采用琼脂糖凝胶电泳法判定DNA提取是否成功。
IL-6 174G/C和-572G/C位点引物采用Sequenom公司Assay Design 3.1 Software软件进行设计。IL-6 174G/C正向引物为5'-GGAGTC ACA CAC TCC ACC T-3'反向引物为 5'-CTG ATT GGA AAC CTTATT AAG-3'。IL-6 572G/C 正向引物为 5'-CTA AGT GGG CTG AAG CAG GT-3',反向引物为 5'-TCA TGG GAA AAT CCC ACA TT-3'。采用聚合酶反应-限制性片段长度多态性分析(PCR-RFLP)方法测定IL-6 174G/C和IL-6 572G/C的基因分型。PCR扩增按照以下条件进行:反应体系为 20 μl,包括基因组 DNA 200 ng,dNT 1.0 μl,引物各 100 pmol,Taq DNA polymerase(0.2 U/μl)0.2 μl,10 × Ex Taq Buffer 5 μl,DNA 模板 1.0 μl。PCR扩增反应条件为94℃预变性5 min,然后94℃变性30 s、64℃退火30 s、72℃延伸进行60 s,总共重复进行35个循环。产物在4℃情况下保存,经过2%琼脂堂凝胶电泳后,采用溴乙锭染色检测PCR扩增反应结果。
1.4 统计学分析 采用SPSS 16.0统计学软件(SPSS Inc,Chicago,IL,USA)进行统计分析。计量资料采用±s表示,计数资料采用频数和百分比表示。病例组和对照组临床资料比较采用χ2检验和t检验。基因型频率采用频数和百分比表示,对照组基因型是否符合Hardy-Weinberg平衡采用χ2检验。OR和95%CI用作评估IL-6 174G/C和IL-6 572G/C基因多态性与胃癌风险的相关关系。在调整混杂因素后,采用多变量条件Logistic回归分析模型评价IL-6 174G/C和IL-6 572G/C基因多态性与胃癌风险的相关性,按照是否感染H.pylori进行分层分析评价IL-6 174G/C和IL-6 572G/C基因多态性与H.pylori的交互作用。
2 结果
2.1 基本情况 纳入的病例组和对照组的性别和年龄差异无统计学意义(P>0.05),两组具有可比性。吸烟能显著性的增加患胃癌的风险(P<0.05),H.pylori阳性感染能显著性的增加患胃癌的风险(P<0.05,见表1)。
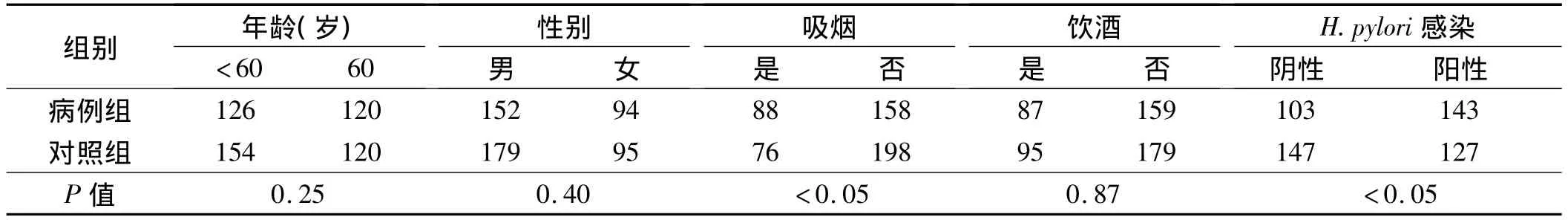
表1 病例组和对照组人口学特征Tab1 Demographic characteristics of case group and the control group
2.2 IL-6 174G/C和IL-6 572G/C基因频率分布及比较 IL-6 174GG、GC和CC基因型在病例组频率为63.4%、21.5%和15.0%,在对照组中频率为71.9%、18.2%和9.9%,该基因频率分布在两组中差异有统计学意义(χ2=5.73,P <0.05)。IL-6 572GG、GC 和CC基因型在病例组频率为51.6%、30.9%和17.5%,在对照组中频率为57.3%、28.1%和14.6%,两组基因频率分布差异无统计学意义(χ2=1.78,P>0.05)。Hardy-Weinberg平衡分析结果发现IL-6 572G/C基因型在对照组中符合Hardy-Weinberg平衡(χ2=4.64,P>0.05,见表2)。
以IL-6 174GG基因型作为参照,携带IL-6 174C等位基因能显著性的增高胃癌发病风险,未调整的OR(95%CI)为1.48(1.01~2.17)。调整性别、年龄、吸烟、饮酒和 H.pylori感染等混杂因素后,携带 IL-6 174CC基因型和C等位基因型能够显著性的增加胃癌发病风险,OR(95%CI)分别为1.88(1.07~3.48)和1.56(1.14~2.52)。本研究并未发现IL-6 572G/C基因多态性与胃癌发病风险的相关关系(见表3)。

表2 IL-6 174G/C和IL-6 572G/C基因频率分布及Hardy-Weinberg平衡[例数(%)]Tab2 Gene frequencies and Hardy-Weinberg equilibrium between IL-6 gene-174G/C and 572G/C [n(%)]

表3 IL-6 174G/C和IL-6 572G/C基因多态性与胃癌发病相关关系Tab3 The association between the IL-6 gene polymorphisms and risk of gastric cancer
研究还进一步分析了IL-6基因多态性与H.pylori感染及吸烟的交互作用。在H.pylori阳性感染患者中,携带IL-6 174GC和CC基因型能显著性增加患胃癌的发病风险,OR(95%CI)分别为1.41(1.05~2.16)和1.89(1.13~3.40),两者有交互作用(P<0.05)。在吸烟人群中,携带IL-6 174GC和CC基因也能显著性的增加患胃癌的发病风险,OR(95%CI)分别为1.37(0.94~2.30)和1.92(1.17~3.51)。在非吸烟人群中,这两个基因型并不能增加患胃癌的发病风险。而对于IL-6 572G/C基因多态性,无论在H.pylori感染人群中还是吸烟人群中,均未发现IL-6 572G/C基因多态性与胃癌发病风险有相关关系(见表4)。注:1:调整性别、年龄、吸烟和饮酒;2:调整性别、年龄、饮酒和H.pylori感染。

表4 IL-6 174G/C和IL-6 572G/C基因多态性与H.pylori感染和吸烟交互作用Tab4 The association among the IL-6 gene polymorphisms with H.pylori infection and smoking
3 讨论
胃癌是在环境因素、生物因素及遗传因素共同作用下,长时间相互作用多步骤发展而导致的[6],并非所有胃癌高风险的人群都会患胃癌,而只有一小部分人发病,说明了在相同的环境因素下,遗传因素决定了个体对胃癌的易感性。本研究探讨了IL-6 174G/C和IL-6 572G/C基因多态性与胃癌发病风险的相关性,研究结果发现IL-6 174CC基因型能显著性的增加胃癌发病风险。
IL-6位于第7号染色体,含有5个外显子和4个内含子,它是一种多效性细胞因子,在炎症、骨代谢和肿瘤的发生和发展过程中起到了重要的作用[7]。在转录起始位点上游第174个碱基的启动子区域存在影响血清细胞因子水平的C-G转变的基因多态性[8]。此基因多态性会在DNA转录、翻译过程中产生差异,从而导致个体发病的易感性差异。体内和体外的实验结果发现IL-6 174C/G基因多态性可以调控IL-6基因的转录和表达过程,导致个体对疾病的易感性差异[9]。IL-6基因多态性导致了IL-6水平增高,反映了IL-6在疾病、组织和环境等方面均具有特异性的表达和调控[10]。而IL-6 174G/C基因多态性被证实与多种疾病有相关关系,包括多发性骨髓瘤、肝癌和子宫内膜异位症等疾病[11]。本研究结果表明 IL-6 174G/C基因多态性与胃癌发病风险有显著关系。
到目前为止有8个关于IL-6 174G/C基因多态性与胃癌发病风险的相关性的研究,其中3个在亚洲人群中研究,5个在西方人群中研究[12]。在英国、美国的3个研究均发现IL-6 174G/C基因多态性与胃癌风险无相关关系[13]。在巴西的研究结果表明IL-6 174G等位基因能够增加患胃癌的风险,而在芬兰的研究结果却发现IL-6 174G等位基因会降低患胃癌的风险[14]。而在亚洲的3个研究中,只有1个中国的研究结果表明IL-6 174G等位基因与C等位基因相比,能显著性的降低胃癌的发病风险[15]。本研究发现IL-6 174C等位基因能显著性的增加胃癌的发病风险,与上述研究不一致,表明IL-6基因多态性存在种族的差异性,在不同的人群和不同的环境中,IL-6对疾病具有特异性的表达和调控。同时在本研究中,在H.pylori阳性感染者中IL-6 174C等位基因能显著性增加胃癌发病风险,而在非感染者中并未发现这种相关性。说明血清及胃黏膜组织中的IL-6水平在H.pylori阳性感染者中明显增加,IL-6多态性参与了胃黏膜损伤的病理过程。
因此,本研究结果表明IL-6 174G/C基因多态性可能具有促进胃癌发生和发展的作用,IL-6 174C等位基因能显著性的增加胃癌的发病风险。IL-6 174G/C基因多态性可以作为胃癌遗传学的检测指标,用于胃癌易感个体的生物学指标。
[1]Zhao P,Dai M,Chen W,et al.Cancer trends in China[J].Jpn J Clin Oncol,2010,40(4):281-285.
[2]Parsonnet J,Friedman GD,Orentreich N,et al.Risk for gastric cancer in people with CagA positive or CagA negative Helicobacter pylori infection [J].Gut,1997,40(3):297-301.
[3]Shi TY,Zhu ML,He J,et al.Polymorphisms of the Interleukin 6 gene contribute to cervical cancer susceptibility in Eastern Chinese women[J].Hum Genet,2013,132(3):301-312.
[4]Tang LP,Cho CH,Hui WM,et al.An inverse correlation between Interleukin-6 and select gene promoter methylation in patients with gastric cancer[J].Digestion,2006,74(2):85-90.
[5]Matsuo K,Oka M,Murase K,et al.Expression of interleukin 6 and its receptor in human gastric and colorectal cancers[J].J Int Med Res,2003,31(2):69-75.
[6]Bonegui P,Meneses-González F,Correa P,et al.Risk factors for gastric cancer in Latin America:a meta-analysis[J].Cancer Causes Control,2013,24(2):217-231.
[7]Hirano T.Interleukin-6 and its relation to inflammation and disease[J].Clin Immunol Immunopathol,1992,62(1 Pt 2):S60-S65.
[8]Terry CF,Loukaci V,Green FR.Cooperative influence of genetic polymorphisms on interleukin 6 transcriptional regulation [J].J Biol Chem,2000,275(24):18138-18144.
[9]Testa R,Olivieri F,Bonfigli AR,et al.Interleukin-6-174 G>C polymorphism affects the association between IL-6 plasma levels and insulin resistance in type 2 diabetic patients [J].Diabetes Res Clin Pract,2006,71(3):299-305.
[10]Pereira DS,Garcia DM,Narciso FM,et al.Effects of 174 G/C polymorphism in the promoter region of the interleukin-6 gene on plasma IL-6 levels and muscle strength in elderly women[J].Braz J Med Biol Res,2011,44(2):123-129.
[11]Magalhães JF,Cortinhas AJ,Albuguergue CM,et al.Interleukin-6 gene-174G>C and-636G>C promoter polymorphisms and prostate cancer risk[J].Mol Biol Rep,2013,40(1):449-455.
[12]Deans C,Rose-Zerilli M,Wigmore S,et al.Host cytokine genotype is related to adverse prognosis and systemic inflammation in gastro-oesophageal cancer[J].Ann Surg Oncol,2007,14(2):329-339.
[13]El-Omar EM,Rabkin CS,Gammon MD,et al.Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphisms[J].Gastroenterology,2003,124(5):1193-1201.
[14]Kamangar F,Abnet CC,Hutchinson AA,et al.Polymorphisms in inflammation-related genes and risk of gastric cancer(Finland)[J].Cancer Causes Control,2006,17(1):117-125.
[15]Zhao Y,Xiao Y,Gao F,et al.Relativity research on the association between the interleukin-6 gene polymorphisms and risk of gastric cancer in Wuwei area of Gansu Province [J].Clin J Med Offic,2010,38(1):25-27.

