细粒棘球蚴B抗原对1型糖尿病牙龈白细胞介素-2、白细胞介素-4表达的影响
哈德丽娅·加帕尔,伊力多斯·艾合他木夫,阿依甫汗·阿汗
(新疆医科大学第一附属医院VIP内科三科,乌鲁木齐 830054)
·基础研究·
细粒棘球蚴B抗原对1型糖尿病牙龈白细胞介素-2、白细胞介素-4表达的影响
哈德丽娅·加帕尔,伊力多斯·艾合他木夫,阿依甫汗·阿汗
(新疆医科大学第一附属医院VIP内科三科,乌鲁木齐 830054)
目的研究细粒棘球蚴B抗原(EgB)对链脲佐菌素(STZ)诱导的1型糖尿病(T1DM)模型小鼠牙龈组织中白细胞介素-2(IL-2)及白细胞介素-4(IL-4)表达产生的影响。方法雌性10周龄STZ诱导的T1DM模型小鼠20只,随机分为2组,每组10只,处理组给予EgB 100μg/10 g连续5 d腹腔注射,对照组给予同等剂量0.9%氯化钠注射溶液腹腔注射,取其牙龈组织,用荧光定量聚合酶链反应(FQ-PCR)检测牙龈中IL-2、IL-4 mRNA表达。结果IL-2 mRNA在EgB处理组较对照组表达明显下降(P<0.05);IL-4 mRNA在EgB处理组较对照组表达明显上升(P<0.05)。结论EgB处理STZ诱导的T1DM模型小鼠,使其牙龈中IL-2 mRNA表达降低,IL-4 mRNA表达升高,影响T1DM免疫应答机制。
糖尿病,1型;牙龈炎;白细胞介素2;白细胞介素4;细粒棘球绦虫;疾病模型,动物
图1 IL-2、IL-4及β-actinPCR扩增产物电泳图
肝细胞生长因子联合撷沙坦对自发险高血压大鼠心肌细胞凋亡的影响
EgB为细粒棘球绦虫(又称包虫)包囊液中主要成分,具有很强免疫源性,目前多数研究认为其通过抑制T淋巴细胞发挥诱导免疫耐受作用,感染EgB后宿主体内嗜酸性粒细胞及IgE、IgG1和IgG4水平均增高已被研究证明,提示EgB感染引导免疫调节向利于细粒棘球绦虫寄生的Th2方向移动[1]。
1型糖尿病(T1DM)是自身免疫性疾病,由T细胞介导,其病程中影响免疫病理的为Th1/Th2细胞亚群失衡及其引起的细胞因子改变[2]。牙龈炎为T1DM第六位的并发症[3],其本身并不引起牙龈炎,但可促进牙龈炎的发生发展[4]。已有实验通过对糖尿病大鼠与正常大鼠牙周组织CD4、CD8的检测,发现糖尿病大鼠牙周组织CD4、CD8升高,提示糖尿病大鼠牙周组织细胞免疫功能可能发生改变,存在免疫调节功能和T细胞活化异常[4]。
应用免疫干预手段达到阻止胰岛的自身免疫过程,预防或减轻T1DM对靶器官的损害,成为当今研究的一大热点。近年来的研究发现,在蠕虫感染率较高的发展中国家T1DM发病率较低,而在蠕虫感染率较低的发达国家T1DM发病率较高,蠕虫感染较低T1DM发病率已由动物实验得以证实[5]。本研究建立链脲佐菌素(STZ)诱导的T1DM模型小鼠,结合包虫病为本地区特色寄生虫病,从国际该领域前沿探讨EgB是否影响T1DM牙龈组织IL-2、IL-4表达水平,从而调控Th1/Th2亚群的平衡,从细胞因子表达水平探索EgB是否可从免疫干预和免疫耐受的角度减轻T1DM对牙龈组织的损害提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性20只清洁小鼠,体质量(20.0±2.0)g,购于新疆医科大学第一附属医院动物中心。
1.1.2 试剂 STZ(美国sigma公司,临用前以pH4.5柠檬酸缓冲液配制)、浓度为0.54 mg/L的EgB(由包虫病研究所惠赠)、Trizol(美国Invitrogen公司)、DEPC(美国sigma公司)、5×TBE电泳缓冲液(临用前稀释成0.5×TBE缓冲液使用)、Goldviewna II型核酸染色液(博大泰克生物基因技术有限责任公司,北京)、琼脂糖(西班牙BIOWEST公司)、50 bp marker(广东东盛生物科技有限公司,用于电泳分析)、反转录试剂盒(美国Promega公司)、琼脂糖凝胶DNA回收试剂盒(百泰克生物技术有限公司DP1062,北京)、2×Taq PCR Master Mix(天根生化)、荧光定量试剂盒(美国Invitrogen公司)、PCR引物(由生工生物工程股份有限公司合成,上海)、SYBR premix EX TAP(Tli RNaseH Plus)(大连TaKaRa)。
1.1.3 引物的设计与合成 在Genebank中找到β-actin、IL-2mRNA、IL-4mRNA全基因序列,应用Primer5软件进行分析,由上海生物工程公司设计与合成。
1.1.4 实验仪器 高速大容量多管离心机(上海安亭科学仪器厂,型号:LXJ-2B),电泳仪(美国BIO RAD),凝胶成像仪(AIphaImager HP),核酸蛋白定量仪(BioPhotometer Plus)、实时荧光定量仪(美国BIO RAD,IQ5),PCR扩增仪(美国BIO RAD,C1000)。
1.2 方法
1.2.1 实验分组 雌性6~8周龄清洁小鼠20只,饲养于新疆医科大学第一附属医院动物房内(SPF级),购置的小鼠于动物房内常规条件下饲养1周使其适应环境,1周后20只小鼠按50 mg·kg-1·d-1的剂量连续5 d腹腔注射STZ诱导T1DM发病(注射前禁食8 h,不禁水),血糖值超过16.7mmol/L且次日复测仍为此水平,提示小鼠T1DM模型造模成功(20只小鼠两次血糖监测均超过16.7 mmol/L)。随机编号分组:(1)EgB处理组:10只,给予EgB,浓度为0.54 mg/L,100μg/10 g经腹腔注射,连续给药5 d;(2)对照组:10只,给予同等剂量0.9%氯化钠注射溶液经腹腔注射,连续给药5 d。
1.2.2 样本的收集与保存 40周末采用颈椎脱臼法处死小鼠,取其牙龈组织,用盐水清洗用铝后箔包裹编号,快速投入液氮至-80℃冰箱冻存待用。
1.2.3 总RNA的提取 Trizol一步法——按每100 mg牙龈组织加入1mL Trizol试剂比例加入Trizol试剂至放有组织块的匀浆器中,按Trizol试剂说明书操作提取牙龈总RNA。将抽提出的RNA按100倍稀释,核酸蛋白定量仪测定A260/A280(单位:OD)比值检验纯度(测定比值在1.8~2.0之间用于PCR);并记录RNA浓度。

表1 引物序列
1.2.4 cDNA的制备 20μL反应体系:①下列混合物在Microtube管内配制:2μL dNTP Mixture(10 mM each)、1μL Oligo(dT)s Primer(0.5μg/μL)、1μg总RNA(根据RNA浓度计算每个样本RNA取用量)加上Nuclear-Free Water至10μL;②在PCR仪上进行变性、退火反应:65℃5 min,4℃forever;③Microtube管置离心机离心数秒使混合液聚集于管底部;④在上述变性、退火后的反应液里加入2μL Reverse Transcription 10×Buffer、0.5μL RNasin Inhibitor、15μL AMV Reverse Transcriptase(0.65 μg/μL)、4μL Mgcl2(25 mM),加上Nuclear-Free Water至20μL;⑤在PCR仪上反转录,条件如下:30℃10min,42℃15min,95℃5min,4℃forever,终止反应,得到cDNA,于-20℃冰箱冻存。
1.2.5 PCR扩增 20μL PCR反应体系包括:上下游引物各0.5μL、2μL cDNA模板、2×Taq PCR Master Mix 10μL、DEPC水7μL,依次加入上述PCR试剂到相应PCR管中,于PCR仪上扩增目的基因。PCR反应条件:94℃预变性3 min,94℃变性60 s,退火60 s(各基因相对应的退火温度见表1),72℃延伸30 s,72℃再次延伸5 min,共35个循环。
1.2.6 凝胶电泳分析及切胶回收 取5μL PCR扩增产品与1μL上样缓冲液混合均匀,于2%琼脂糖凝胶、0.5×TBE电泳缓冲液中,105 V/95 mA电泳40 min,在紫外灯下观察,用凝胶成像仪拍照分析。PCR产物通过琼脂糖凝胶电泳分离后,按琼脂糖凝胶DNA回收试剂盒说明切胶回收分离纯化PCR产物,并作为DNA标准品。
1.2.7 FQ-PCR DNA样本按101~105copies/μL浓度梯度稀释制作成标准品作为阳性模板,同时以不加模板PCR体系为阴性对照,每个样本行3次FQ-PCR反应平行重复实验。反应体系20μL:荧光染料SYBRGreenI 10μL,上下游引物各0.5μL,模板2μL,补水至20μL。反应条件:95℃3 min,95℃10 s,退火30 s(各基因所对应的退火温度见表1),65~95℃10 s,共35次循环。由FQ-PCR仪自动绘制扩增曲线及熔解曲线,产物通过熔解曲线证实。反应结束后,标准曲线由PCR仪附带的软件进行分析并自动生成。用得到的标准曲线,将EgB处理组(n=10)和对照组(n=10)小鼠样本,按上述的反应体系及反应条件进行FQ-PCR。反应结束后用Biorad IQ5 System数据分析软件进行分析,为消除提取标本、反转录和FQ-PCR的差异,以同一标本IL-2/β-actin比值及IL-4/β-actin比值作为评价IL-2、IL-4mRNA表达水平指标。
1.3 统计学处理 采用Excel表格录入所有数据,用SPSS 17.0统计软件包进行统计分析,定量资料两组均数的比较采用独立样本t检验分析,检验水准(α=0.05)。
2 结果
2.1 PCR扩增产物的鉴定 IL-2、IL-4及β-actin目的片段未见非特异型扩增,电泳鉴定结果见图1。
2.2 线性范围与特异性 10倍稀释的IL-2 mRNA标准品线性范围为101~105copies/μL,扩增效率为107.7%,相关系数R2=0.908;IL-4 mRNA标准品线性范围为101~105copies/μL,扩增效率为93.2%,相关系数R2=0.912;β-actin标准品线性范围为101~105copies/μL,扩增效率为93.9%,相关系数R2=0.922;提示管家基因β-actin与目标基因IL-2、IL-4可以在宽广范围内进行准确定量。溶解曲线均显示单一峰形,提示反应特异性好,符合标准品制备的要求;空白对照反应未检测出目的片段荧光信号,表明反应体系无污染。
2.3 FQ-PCR检测结果 用FQ-PCR检测目地基因表达,IL-2 mRNA在EgB处理组表达量显著低于对照组中的表达量(P<0.05);IL-4 mRNA在EgB处理组表达量显著高于对照组中的表达量(P<0.05),见表2。
表2 EgB对STZ诱导的T1DM模型小鼠牙龈IL-2mRNA、IL-4 mRNA表达的调节作用(±s,copy number/g)
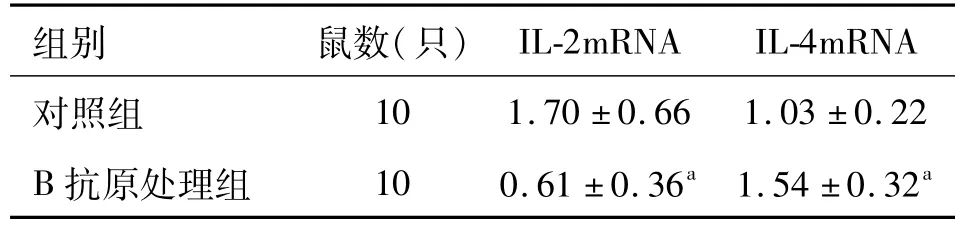
表2 EgB对STZ诱导的T1DM模型小鼠牙龈IL-2mRNA、IL-4 mRNA表达的调节作用(±s,copy number/g)
注:与对照组比较,aP<0.05
3 讨论
研究[6-7]证实,调节性T细胞的功能、数量和效应性T细胞与调节性T细胞的比例失调与T1DM的发生密切相关,CD4+Th1细胞过度激活与CD8+T细胞缺陷在T1DM病理改变中起重要作用[8]。T淋巴细胞是机体重要的免疫细胞群,在维持机体正常免疫功能和保护机体免受各种病原体感染方面起重要作用[9],按照细胞表面分化群(CD)不同,T淋巴细胞可分为CD4+和CD8+两个亚群,分别介导细胞免疫和体液免疫应答。生理状态下,CD8+T细胞能抑制CD4+T细胞的增殖,在免疫耐受的维持中具有重要作用[10]。糖尿病状态下,抑制性CD8+T细胞减少、失活,使免疫调节失控,促进CD4+细胞对胰岛β细胞的免疫损伤,加速糖尿病发生发展。Th1/Th2细胞是初始型CD4+T细胞,即CD4+T辅助性前体细胞,为在抗原刺激和多种信号传递综合作用下发生功能性分化的结果[11]。通常情况下,Th1、Th2细胞彼此调节相互抑制,处于动态平衡状态。异常生理状态下,Th0细胞分化功能障碍引起Th1/Th2细胞亚群失衡,表现为相应的飘移性Th1或Th2疾病。IL-2、TNF-α和INF-γ主要由Th1产生,正向调节细胞免疫应答;IL-13、IL-10、IL-5和IL-4等主要由Th2型细胞产生,促进体液免疫应答[12]。IL-2和IL-4分别是Th1、Th2细胞特征性细胞因子,其分泌水平的变化基本上代表了Th1/Th2细胞分化方向。细胞因子失衡导致免疫调节紊乱是T1DM发病的关键作用机制,主要包括Th1型细胞因子过度分泌和Th2型细胞因子分泌减少,多试验结果提示,在全身多个脏器组织中均可发现上述细胞因子表达水平异常。有研究显示,EgB可使外周单个核细胞产生Th1/Th2细胞因子比值改变,倾向于病理免疫相关的Th2;可使健康者外周血CD4+数量降低,CD8+数量增多,向Th2转变[13]。
本研究采用EgB处理STZ诱导建立的T1DM小鼠模型,以β-actin基因作内参照,经FQ-PCR检测IL-2、IL-4mRNA在EgB处理组与对照组表达的绝对差异,通过细胞因子表达的改变推断EgB对T1DM牙龈组织免疫调节功能产生的影响。研究结果显示:EgB处理牙龈组织IL-2 mRNA表达量较对照组明显下降;而EgB处理牙龈组织IL-4 mRNA表达量较对照组明显上调。IL-2又称T细胞生长因子,主要由CD4+T细胞产生,位居免疫调节的中心地位,其表达水平可反映患者CD4+T细胞数量和活性异常,目前对于IL-2在T1DM发病中的作用说法不一。对NOD小鼠研究发现,不仅有IL-4表达缺陷同时有IL-2分泌水平低下,与患者外周血细胞培养上清液中IL-2水平低下相一致。同时有大量研究表明,T1DM患者或发病动物血清中IL-2水平显著高于正常水平。本研究结果证实EgB可能抑制了T1DM病程中发生的Th1细胞型反应,从而下调IL-2mRNA在牙龈组织的表达,这与Nicoletti设计的非免疫源性可溶性IFN-γ受体,能使IL-2水平下降,从而预防T1DM的发生[14]结果相似。但对于IL-2在糖尿病患者或患病动物牙龈组织中表达水平的有无改变,本人尚未搜索到相关研究报道,故对于EgB处理可上调IL-2 mRNA在牙龈组织的表达量,是否视为在牙龈组织中体现的保护作用,尚需进一步验证。IL-4对T1DM的研究发现,外源性给予IL-4可逆转NOD小鼠胸腺和T细胞的体外不应答,并在整体水平上阻止NOD小鼠T1DM的发生,行抗IL-4抗体处理后可完全阻止这种保护作用,证实了IL-4是保护性细胞因子。对2周龄NOD小鼠连续10周IL-4治疗可预防胰岛炎及T1DM发生,提示IL-4保护功能机制可能是通过调节自身反应性炎症因子的趋化和促进Th2细胞的增殖实现的[15]。本实验EgB处理可使IL-4 mRNA在牙龈组织表达明显上调,提示EgB可能激活了Th2细胞型反应。有研究显示IL-4质量浓度下降,可致牙周袋进一步加深,提示IL-4是参与牙槽骨吸收破坏的重要细胞因子[16]。综上,EgB上调IL-4 mRNA在牙龈组织的表达可视为其对T1DM牙龈组织的保护作用。
(本文图1见插图3-2)
[1] 李亦梅.包虫病所致过敏性休克患者免疫学保护性因素的研究[DB/OL].(2012-04-28).http://d.g.wanfangdata.com.cn/Thesis_Y2046070.aspx.
[2] Roland T.Insulin dependent diabetes mellitus[J].Cell 1996,85(1):29l-297.
[3] 高荣寰.132例老年人糖尿病与牙周病相互关系的临床观察[J].中华老年口腔医学杂志,2009,7(5):282-282.
[4] 冯二玫.糖尿病大鼠牙周组织病理改变的机制研究[DB/OL].(2012-12-31).http://d.g.wanfangdata.com.cn/Thesis_Y1770174.aspx.
[5] 邹玖明.日本血吸虫感染对小鼠实验性1型糖尿病的影响[DB/OL].(2007/07/25).http://d.g.wanfangdata.com.cn/Thesis_Y961048.aspx.
[6] Sun Y,Qiao J,Lu CZ,et a1.Increase of circulating CD4+CD25+T cells in myasthenia gravis patients with stability and thymectomy[J].Clin Immunol,2004,l12(3):284-289.
[7] Balandina A,Lecart S,Dartevelle P,et a1.Functional defect of regulatory CD4+CD25+T cells in the thymus of patients with autoimmune myasthenia gravis[J].Blood,2005,105(2):735-741.
[8] 邹晓蕾.CD4+/CD8+T细胞分型及T-bet/GATA3基因表达与1型糖尿病相关性研究[DB/OL].(2009-12-31).http://d.g.wanfangdata.com.cn/Thesis_D064357.aspx.
[9] Tanaka S,Isoda F,Ishlhara Y.Tlymphopaenia in relationto bodymass index and TNF-alpha in human obesity:adequate weight reduction can be corrective[J].Clin Edocrinol,2001,54(3):347-354.
[10]孙明谨,曾玉琴,李雪峰,等.糖尿病患者T、B细胞亚群的研究[J].中国现代医学杂志,2005,15(22):3455-3457.
[11]王美红,陈同辛.转录因子T-bet在Th1/Th2分化中的作用及意义[J].上海免疫学杂志,2003,23(5):359-361.
[12]Rabinovitch A,Suarez-Pinzon WL.Roles of cytokines in the pathogenesis andtherapy of type 1 diabetes[J].Cell Biochem Biophys,2007,48(2/3):159-163.
[13]张亚楼,卢晓梅,张琰.细粒棘球蚴囊液对外周血淋巴细胞的影响[J].中国寄生虫病防治杂志,2005,18(2):124-126.
[14]Nicoletti F,Zaccone P,Di Marco R.The effects of a nonimmunogenic form ofmurine soluble interferon-gamma receptor on the development of autoimmune diabetes in the NOD mouse[J].Endocrinology,1996,137(12):5567-5575.
[15]郭清华,张志利,何目芬,等.IL-4对NOD鼠l型糖尿病的免疫干预治疗[J].中国糖尿病杂志,2001,9(2):105-108.
[16]周艳红,武云霞.慢性牙周炎患者龈沟液中白细胞介素-4的检测和意义[J].国际口腔医学杂志,2008,35(6):617-620.
Effect of Echinococcus granulosus antigen B on the expression of IL-2 and IL-4 in the gingival tissues of
streptozotocin(STZ)-induced type 1 diabetic mouse model
Hadeliya Jiapaer,Yiliduosi Aihetamofu,Ayifuhan Ahan
(The Third VIPDepartmentof InternalMedicine,the First Affiliated Hospitalof Xinjiang Medical University,Urumqi 830054,China)
ObjectiveTo study the effect of Echinococcus antigen B(EgB)on the expression of IL-2 and IL-4 in the gingival tissues of streptozotocin(STZ)-induced type 1 diabetic mouse model.MethodsA total of 20 ten-week-old female STZ-induced type 1 diabetic mouse were randomly divided into 2 groups,with 10 mouse in each group.Themouse in the treatmentgroup was injected intraperitonealy with EgB(100μg/10g)for5 consecutive days,and themouse in he control group were injected with 0.9%sodium chloride with the same dose.The gingival tissues were collected,and the expression IL-2,IL-4 mRNA was determined by FQ-PCR.Result The levelof IL-2mRNA in the treatment group was significantly lower than thant in the control group(P<0.05);The level of IL-4mRNA in the EgB treated group was significantly increased compared with the control group(P<0.05).ConclusionThe expression of IL-2 is decreased and the level of IL-4 is increased in the gingival tissues of streptozotocin(STZ)-induced type 1 diabetic mousemodel treated with EgB.
Diabetes Mellitus,Type 1;Gingivitis;Interleukin-2;Interleukin-4;Echinococcus granulosus;Disease Models,Animal
R587.1
A
10.3969/J.issn.1672-6790.2014.03.018
2014-02-18)
新疆维吾尔自治区自然科学基金(2010211B21)
哈德丽娅·加帕尔,硕士在读,Email:kadirya.j@gmail.com

