叉头框C2和Vimentin蛋白在胃癌中的表达及意义
孙稳莲
叉头框C2和Vimentin蛋白在胃癌中的表达及意义
孙稳莲
目的 探讨人叉头框C2(FOXC2)和Vimentin蛋白在胃癌组织中的表达和意义。方法 采用免疫组化S-P法检测65例胃癌组织及20例正常胃黏膜中FOXC2和Vimentin的表达,分析两种蛋白与胃癌临床特征之间关系的相关性。结果 胃癌组织中FOXC2和Vimentin均呈现高表达,FOXC2和Vimentin在胃癌组织中的阳性表达率分别为41.53%(27/65)和35.38%(23/65)。FOXC2在中晚期胃癌的表达率为58.62%(17/29),明显高于早期胃癌表达率27.78%(10/36)(P=0.012;FOXC2在有淋巴结转移组中的表达率为55.88%(19/34),明显高于无淋巴结转移组表达率29.03%(9/31)(P=0.018)。Vimentin在中晚期胃癌的表达率为51.72%(15/29),明显高于早期胃癌表达率22.22%(8/36)(P=0.013);在有淋巴结转移组的表达率为41.17%(14/34),高于无淋巴结转移组表达率 19.35%(6/31)(P=0.014)。胃癌组织中FOXC2和Vimentin的表达成正相关(P=0.037)。结论 FOXC2和Vimentin可能参与上皮细胞间质转化过程,在胃癌转移中扮演重要角色。
胃肿瘤;FOXC2;Vimentin;EMT
胃癌是全世界最常见的恶性肿瘤之一,居全球癌症发病率和死亡率的第2位[1],虽经过多年的研究,胃癌的发病机制仍不清楚。叉头框C2(forkhead box C2,FOXC2)属forkhead转录因子家族的一员。有研究表明,FOXC2在上皮细胞-间质细胞转变(epithlial-mesenchymal transition,EMT)过程中,促进间质细胞的转化,对EMT起着关键的调节作用[2-3]。而上皮性癌细胞的浸润和转移过程与EMT十分相似,拟通过免疫组化法检测胃癌组织中FOXC2和Vimentin的表达情况,探索胃癌的高度恶性行为是否与EMT有关。
1 资料与方法
1.1 一般资料 选择2008年1月~2013年6月经病理证实胃癌手术患者65例的标本作为研究对象。其中,男48例,女17例;年龄30~81岁;有淋巴转移34例,无淋巴转移为31例。另取20例健康者正常胃黏膜组织作为阴性对照。
1.2 方法
1.2.1 试剂 抗FOXC2多克隆抗体购于Abcam公司,抗Vimentin单克隆抗体购于福建迈新公司,SP(SP Kit Rabbit)免疫组化试剂盒和浓缩型DAB(Diaminobenzidine)试剂均购自北京中杉试剂公司。
1.2.2 实验方法 按SP免疫组化试剂盒说明书进行。标本常规10%中性甲醛溶液固定,石蜡包埋制片,4m切片脱蜡水化,于枸橼酸钠缓冲液(pH6.0)中微波抗原修复,过氧化物酶阻断内源性过氧化物酶活性,非免疫性动物血清阻断非特异性反应,分别滴加山羊抗人FOXC2多抗和鼠抗人Vimentin单抗,4℃过夜,37℃复温1h后滴加二抗,DAB (Diaminobenzidine)显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树脂封片,镜检。
1.2.3 结果判定[1]FOXC2与Vimentin均主要表达在细胞质内,以细胞质内明显着色及强着色为阳性细胞,计数5个高倍镜视野,阳性细胞数<5%为阴性,≥5%为阳性,判定过程由2名经验丰富的病理医生负责。
1.3 统计学方法 采用SPSS17.0 统计分析软件进行数据分析,计数资料采用率和百分比表示,两组间计数资料比较采用χ2或Fisher确切概率法,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 FOXC2和Vimentin的表达情况 FOXC2及Vimentin在胃癌组织中表达较强,胞内颗粒粗大;在正常胃黏膜组织中表达较弱,颗粒细小。FOXC2在胃癌组织中的阳性表达率为41.53%(27/65),Vimentin在胃癌组织中的阳性表达率为35.38%(23/65)。
2.2 FOXC2和Vimentin的表达与临床生物学行为的关系FOXC2在中晚期胃癌的表达率为58.62%(17/29),明显高于早期胃癌表达率27.78%(10/36)(P=0.012);FOXC2在有淋巴结转移组中的表达率为55.88%(19/34),明显高于无淋巴结转移组表达率29.03%(9/31)(P=0.018)。FOXC2的过表达与年龄、性别、分化程度是否有关,差异无统计学意义(见表1)。
Vimentin在中晚期胃癌的表达率为51.72%(15/29),明显高于早期胃癌表达率22.22%(8/36)(P=0.013);在有淋巴结转移组的表达率为41.17%(14/34),高于无淋巴结转移组表达率19.35%(6/31)(P=0.014),差异均有统计学意义。而Vimentin的过度表达与年龄、性别、分化程度是否有关,差异无统计学意义(见表 1)。
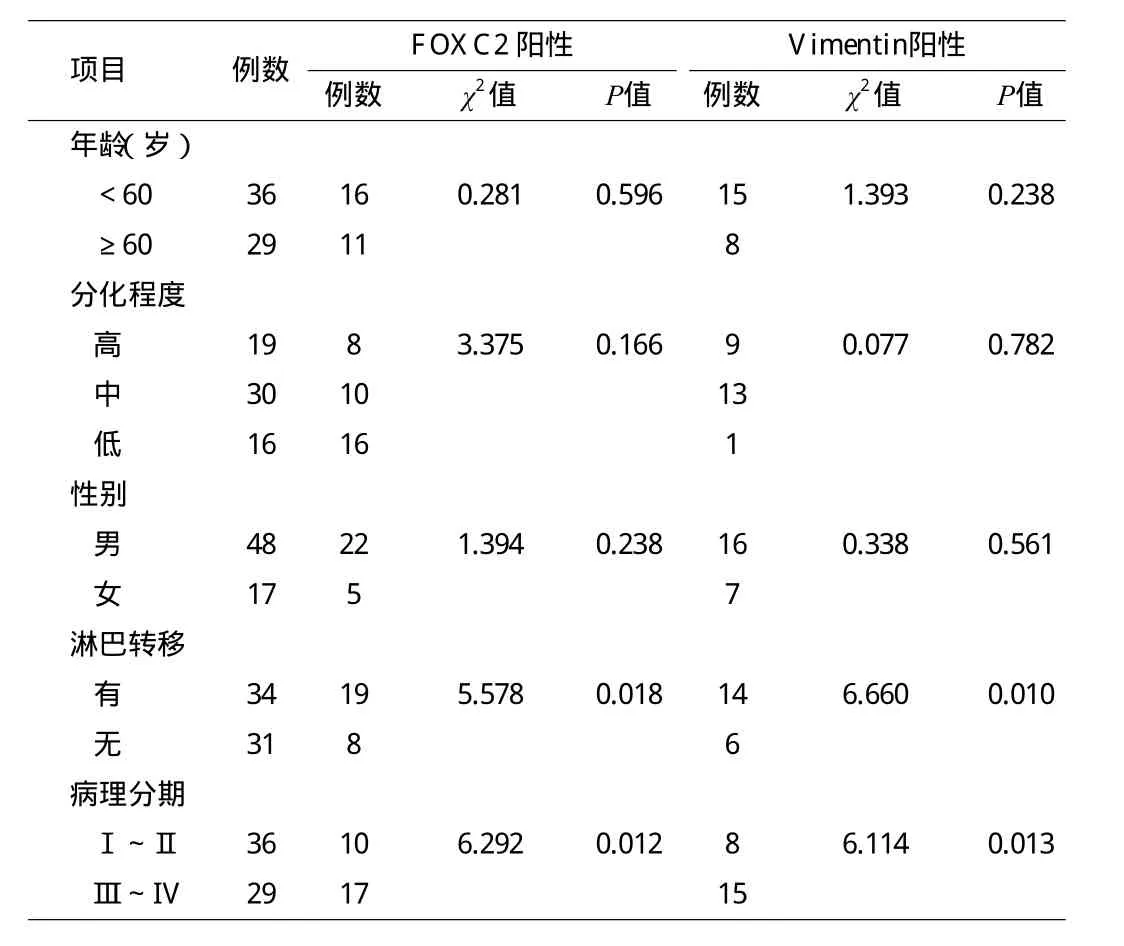
表1 FOXC2和Vimentin的表达与胃癌临床病理指标的关系
2.3 FOXC2和Vimentin表达的关系 FOXC2阳性表达的胃癌组织中,Vimentin的阳性表达为66.67%,FOXC2阴性表达的胃癌组织中,Vimentin的阳性表达为23.40%,两者成正相关(P=0.405,P=0.037,见表 2)。

表2 FOXC2和Vimentin的相关性(例)
3 讨论
虽然现阶段的流行病学调查发现,不同地区胃癌的发病率均较前有所下降,但全球每年仍有超过93万的病例确诊胃癌,尽管治疗方案越来越多,每年仍至少有70万的胃癌患者死亡。在我国对胃癌进行了多年的基础和临床研究,但其发病机制仍不完全清楚。有研究发现,EMT在各种上皮细胞来源的恶性肿瘤的侵袭转移过程中发挥了重要作用[1]。EMT为暂时而快速的细胞表型可逆性改变,上皮细胞之间的紧密连接消失或者减少,上皮细胞失去其极性并改变其细胞骨架(间质成分增加),细胞运动、迁延、抗凋亡能力提高[3]。EMT可以改变肿瘤细胞的表型,从而提高肿瘤细胞浸润和转移的能力[4]。参与EMT中的蛋白分子众多,如β-Catenin、Paxillin、Vimentin、slug等[5],其中代表间质细胞的Vimentin由于其高度的选择性表达受到广泛的研究。
FOXC2属于FOXC亚族,经过多年研究发现,它不仅参与调节胚胎的发育,如血管、淋巴管的生成等[6],还与肥胖、胰岛素抵抗、糖尿病等代谢性疾病相关[7]。近年来的研究还发现,FOXC2与肿瘤的浸润和远处转移密切相关,在乳腺基底细胞癌、子宫内膜癌等肿瘤中呈现高表达,其表达量与肿瘤分期及恶性程度呈正相关,这可能与FOXC2启动EMT促进上皮细胞转化并转移有关[8]。本实验结果显示,FOXC2在胃癌组织伴淋巴结转移组及晚期病例中呈高表达,提示其可能通过上述途径参与胃癌的发展。
Vimentin是一种中间丝蛋白,是连接细胞膜与核膜之间的重要骨架蛋白。Vimentin主要表达于间叶组织细胞,如内皮细胞、成纤维细胞、巨噬细胞、淋巴细胞等,是EMT中的一个重要因子。目前大量报道显示,Vimentin在许多上皮性肿瘤,尤其是低分化癌中异常表达,可能与肿瘤细胞的浸润和转移有关。本实验结果显示,Vimentin在胃癌组织伴淋巴结转移组及晚期病例中呈高表达,提示其可能参与胃癌的发展。又有报道称,Vimentin的过度表达还与肝细胞癌、乳腺癌及结肠癌的高度恶性和不良预后有着明显的联系[9-11];还在Vimentin在膀胱癌中表达异常增加。因此,Vimentin可能作为评估上皮性肿瘤有无转移的指标之一[12]。
本实验还表明,FOXC2和Vimentin的表达呈正相关,随着胃癌的恶性程度增高,FOXC2及Vimentin表达均增加,促进上皮细胞向间质细胞转化。研究结果表明,EMT在结肠癌、乳腺癌、肺癌、肝癌等多种癌症的浸润及转移中起着重要作用[13]。通过本实验发现,FOXC2及Vimentin参与胃癌的EMT过程,促进肿瘤细胞浸润和转移,这可能为继续探索胃癌发病机制提供了新的思路,也为胃癌的诊断及预后判断提供了新的指标。
[1] Filomena A,Saieva C,Lucchetti V,et al.Gastric Cancer surveillance in a high-risk population in Tuscany(Central Italy):preliminary results[J].Digestion,2011,84(1):70-77.
[2] Meine GC,Rota C,Dietz J,et al.Relationship between cag A-positive helicobacter pylori infection and risk of gastric cancer:a case control study in porto alegre.RS.Brazil[J].Arq Gastroenterol,2011,48(1):41-75.
[3] Savagner P,The epithelial-mesenchymal transition(EMT)phenomenon[J].Ann Oncol,2010,21(Suppl 7):S89-92.
[4] Kokkinos MI,Wafai R,Wong MK,et al.Vimentin and epithelial mesenchymal transition in human breast cancer-ob-servations in vitro and in vivo[J].Cells Tissues Organs,2007,185(1-3):191-203.
[5] 洪伦.上皮-间质转化及相关microRNA分子与肿瘤的恶性行为的研究进展[J].中国癌症杂志,2011,21(9):725-730.
[6] Hayashi H,Sano H,Seo S,et al.The FOXC2 transcription factor regulates angiogenesis via induction of integrin beta3 expression[J].J Biol Chem,2008,283(35):23791-23800.
[7] 彭晓韧,邹大进.脂肪组织FOXC2表达水平与肥胖和胰岛素抵抗的关系[J].医学研究生学报,2008,21(6):614-618.
[8] Mani SA,Yang J,Brooks M,et al.Mesenchyme forkhead(FOXC2) plays a key role in metastasis and is associated with aggressive basal-like breast cancers[J].Proc Natl Acad Sci USA,2007,104(24):10069-10074.
[9] 周顺,贾筱琴,喻春钊,等.上皮间质转化相关蛋白在肝细胞肝癌组织中的表达鉴定及其小分子RNA表达谱的研究[J].中华实验外科杂志,2011,28(1):68-71.
[10] Dandachi N,Hauser-Kronberger C,More E,et al.Co-ex-pression of tenascin-C and vimentin in humen breast Cancer cells indicates phenotypic transdifferentiation during tumour progression:correlation with histopathological parameters,hormone receptors.and oncoproteins[J].J Pathol,2001,193(2):181-189.
[11] 吴共发,胡洁,王雅娟,等.结直肠癌与其淋巴结转移癌及结直肠癌细胞上皮-间质转化的对比研究[J].中国癌症杂志,2011,21(4):251-255.
[12] Baumgart E,Cohen MS,Silva Neto B,et al.Identification and prognostic significance of an epithelial-mesenchymal transition expression profile in human blader tumors[J].Clin Cancer Res,2007,13(6):1685-1694.
[13] Sabbah M,Emami S,Redeuilh G,et al.Molecular signature and therapeutic perspective of the epithelial to mesenchymal transitions in epithelial cancers[J].Drug Resist Updat,2008,11(4-5):123-151.
10.3969/j.issn.1009-4393.2014.3.011
云南 655400 云南省宣威市中医医院(孙稳莲)

