晚期非小细胞肺癌EGFR蛋白磷酸化、基因突变与EGFR-TKI疗效相关性的研究
王芬王洁白桦王书航王树滨申东兰
1.北京大学深圳医院肿瘤科,广东 深圳 518036;
2.北京肿瘤医院胸部肿瘤内科,北京 100036
晚期非小细胞肺癌EGFR蛋白磷酸化、基因突变与EGFR-TKI疗效相关性的研究
王芬1王洁2白桦2王书航2王树滨1申东兰1
1.北京大学深圳医院肿瘤科,广东 深圳 518036;
2.北京肿瘤医院胸部肿瘤内科,北京 100036
背景与目的:近年来以吉非替尼和厄洛替尼为代表的表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKI),因其在晚期非小细胞肺癌(advanced non-small cell lung cancer,NSCLC)治疗中独特的临床疗效和较低的不良反应而备受关注。尽管EGFR基因突变是目前认为最确切的预测EGFR-TKI疗效的指标,但与临床疗效间并非“全或无”的关系,提示仍有其他机制参与其中。本研究旨在探讨晚期NSCLC组织标本中EGFR磷酸化酪氨酸1068(EGFR-pTyr1068)、1173(EGFR-pTyr1173)表达与EGFR基因突变的关系,及其在EGFR-TKI治疗中的疗效预测价值。方法:采用变性高效液相色谱法(denaturing high performance liquid chromatography,DHPLC)检测205例晚期NSCLC患者组织中EGFR基因突变(19、21外显子突变)情况;并采用免疫组化方法检测其EGFR-pTyr1068、EGFR-pTyr1173表达。结果:晚期NSCLC患者组织中EGFR-pTyr1068和1173表达阳性率分别为80.0%(164/205)、57.6%(95/165);其表达与临床病理特征(年龄、性别、病理类型、吸烟状态、疾病分期)无相关性。全组EGFR基因突变率为44.9%(92/205),与吸烟状态有关(P=0.024),而与其他临床病理特征(性别、年龄、病理类型、疾病分期)无关。EGFR基因突变与EGFR-pTyr1068表达呈弱相关性(P<0.001),与EGFR-pTyr1173无相关性(P=0.297)。EGFR基因突变型患者EGFR-TKI治疗的客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)和中位无进展生存期(progress free survival,PFS)分别为48.3%(43/89)、80.9%(72/89)和8.8个月(95%CI:6.11~11.42),均明显高于EGFR基因野生型患者[16.2%(17/105)、56.2%(59/105)和2.1个月,95%CI:0.89~3.24],差异有统计学意义(P<0.001,P<0.001,P=0.024);EGFR-pTyr1068表达阳性患者ORR和DCR分别为37.7%(58/154)和74.7%(115/154),均明显高于表达阴性患者[5.0%(2/40)和40.0%(16/40)],差异有统计学意义(P<0.001)。EGFR-pTyr1068表达阳性患者中位PFS为7.0个月,较表达阴性患者(1.2个月)明显延长,差异有统计学意义(P<0.001)。而EGFR-pTyr1173表达与EGFR-TKI疗效呈负相关性,EGFR-pTyr1173阳性者ORR、DCR和PFS分别为27.8%(25/90)、64.4%(58/90)和4.8个月,显著低于阴性患者[37.9%(25/66)、83.3%(55/66)和7.7个月,P=0.123,P=0.007,P=0.016]。以EGFR基因突变状态分层进行亚组分析显示,在EGFR基因野生型患者中,EGFR-pTyr1068表达阳性率为69.0%(69/100),EGFR-pTyr1068表达阳性和阴性患者ORR分别为23.2%(16/69)和3.2%(1/31),DCR分别为69.6%(48/69)和35.5%(11/31),差异均有统计学意义(P=0.010,P=0.001);EGFR-pTyr1068表达阳性患者中位PFS为3.6个月,较表达阴性患者(1.2个月)明显延长,差异有统计学意义(P<0.001)。16例EGFR-pTyr1068阳性表达且对EGFRTKI有效患者,中位PFS为15.6个月(95%CI:7.28~23.9)。多因素分析显示,EGFR-pTyr1068是EGFR基因野生型患者EGFR-TKI治疗的独立疗效预测因子(OR=0.24,95%CI:0.16~0.37,P<0.001)。结论:EGFR-pTyr1068可作为晚期NSCLC患者接受EGFR-TKI治疗的有效预测因子,尤其对从EGFR基因野生型患者中筛选EGFR-TKI治疗有效者具有重要作用。
晚期非小细胞肺癌;表皮生长因子受体磷酸化酪氨酸;表皮生长因子受体基因突变;表皮生长因子受体酪氨酸激酶抑制剂;预测因子
肺癌是目前世界上发病率和死亡率最高的恶性肿瘤之一,严重威胁人类健康。以吉非替尼和厄洛替尼为代表的表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)靶向治疗在取得明显疗效的同时又避免伤害正常细胞[1-2],越来越被肿瘤医师和广大患者所认同。2004年Lynch等[3]和Paez等[4]分别报道了EGFR基因突变与EGFR-TKI疗效的关系,之后的多组前瞻性临床研究均证实EGFR基因突变是EGFR-TKI疗效的有效预测因子[5-6],并由此奠定了晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)一线治疗选择的新策略-基于EGFR基因突变状态与组织学类型的策略选择。
EGFR是一种相对分子质量为170×103的穿膜糖蛋白,在细胞信号传导通路中起重要作用。EGFR一旦被激活,可导致肿瘤细胞内酪氨酸激酶活化和受体自身磷酸化,后者通过Ras-Raf-MAPK、JAK-STAT和PI3K-Akt等信号传导途径将信号传递到核内,从而促使细胞增殖、血管生成、转移和抑制细胞凋亡[7-12]。EGFR-TKI通过与ATP竞争性结合EGFR的胞内部分直接抑制EGFR酪氨酸激酶并减少EGFR自身磷酸化,导致细胞生长停滞和促进凋亡[13]。研究表明,EGFR基因突变可持续活化EGFR酪氨酸激酶,并使受体自身磷酸化[3,14-15],提示EGFR酪氨酸磷酸化对活化后EGFR在细胞内信号调控至关重要。目前国内外对肺癌EGFR磷酸化发生率报道不一致,其与EGFR基因突变的关系各个报道亦相差甚远,且尚无大样本的研究探讨磷酸化EGFR与EGFR-TKI临床疗效的关系。本研究回顾性分析晚期NSCLC患者组织标本中EGFR磷酸化酪氨酸1068(EGFR-pTyr1068)和1173(EGFR-pTyr1173)表达与EGFR基因突变、拷贝数的关系,并探讨其对晚期NSCLC患者,尤其EGFR野生型患者接受EGFR-TKI治疗的疗效预测价值。
1 资料和方法
1.1 患者资料
收集2003年1月—2010年6月北京肿瘤医院胸部肿瘤内科收治的205例ⅢB和Ⅳ期NSCLC患者的临床资料。所有患者均进行组织EGFR基因突变和EGFR-pTyr1068检测,165例患者同时进行EGFR-pTyr1173检测。194例患者接受EGFRTKI治疗(148例接受吉非替尼250 mg/d治疗;57例接受厄洛替尼150 mg/d治疗),直至疾病进展或出现难以耐受的不良反应或患者拒绝用药,其中54例为一线治疗。中位随访时间为9.4个月(0.4~77.2个月)。
1.2 方法
1.2.1 D N A提取与变性高效液相色谱法(denaturing high performance liquid chromatography,DHPLC)检测EGFR突变
按照E.Z.N.A FFPE DNA试剂盒(购自美国OMEGA公司)说明书提取DNA后,PCR扩增EGFR第19、21外显子,引物设计见表1。PCR反应体系为25 μL,其中模板cDNA 1.5 μL,10×PCR缓冲液1.5 μL,dNTP 0.375 μL,上、下游引物各0.15 μL,Taq酶0.15 μL,dH2O 11.2 μL。PCR反应条件:95 ℃预变性5 min,94 ℃变性30 s,56 ℃退火50 s,72 ℃延伸30 s;循环45次后,72 ℃延伸10 min。扩增产物经2.5%琼脂糖凝胶100 V电泳30 min后,溴化乙锭染色摄片进行扩增产物鉴定。用WAVE核苷酸片段分析系统(购自美国Transgenomic公司)进行DHPLC分析,色谱柱为DNA Sep分析柱,流动相为0.1 mol/L N-三乙基乙酰胺(TEAA,色谱纯)和不同浓度的乙腈梯度洗脱液,由控制软件WAVE Maker根据待测DNA序列自动生成乙腈梯度和柱温,以0.9 mL/min流速测定,检测器为紫外分光光度计(260 nm)。阳性结果判断:外显子19的突变类型为15~18 bp碱基删除突变,利用DHPLC在50 ℃非变性条件下对片段长度进行测定,野生型产物为151 bp,删除突变产物由于片段较短(136~133 bp)会先于野生型产物出现而与野生型峰明显分离。外显子21的突变类型为L858R置换突变,采用部分变性温度进行测定,先将PCR产物变性复性处理,若存在突变会形成杂合双链,其退火温度低于纯合双链,61 ℃部分变性条件下可将2种产物分离。将测序验证为外显子19删除突变阳性以及外显子21置换突变阳性的冰冻标本作为阳性对照,以注射用水作为空白对照进行DHPLC检测。前期我们实验室工作已经提示DHPLC法与测序法相比,灵敏度、特异度高[22],故本研究结果仅用DHPLC法检测EGFP突变。

表1 EGFR基因引物序列Tab. 1 EGFR gene primer sequence
1.2.2 免疫组化学法检测组织EGFR磷酸化酪氨酸表达
本研究采用Cell Signaling Technology (Danvers,MA)公司的EGFR磷酸化酪氨酸抗体:EGFR-pTyr1068(Cad no.2236)和EGFR-pTyr1173(Cad no.4407)。采用链菌素亲生物素-过氧化物酶法(SP法)进行免疫组化染色。切片脱蜡至水,置于1 mmol/L EDTA(pH=8.0)抗原修复液中,用高压锅加热至喷气后改为400 W 10 min,缓慢冷却至室温。用PBS洗涤后,按试剂盒说明进行EGFR磷酸化酪氨酸的免疫组化染色。实验以PBS代替一抗作为阴性对照,以该公司提供的EGFR磷酸化酪氨酸阳性切片(Cad no.8102)为阳性对照。切片经显色和苏木精复染后,采用双盲法对每张切片在高倍镜(×400)下计数10个视野。染色结果根据细胞质和细胞膜着色的阳性细胞百分率和阳性染色程度评价。着色细胞占计数细胞百分率≤5%为0分;>5%~<20%为1分;≥20%~<50%为2分;≥50%为3分。再结合染色强度,无色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。染色强度和着色细胞百分率的乘积即为其最后评分:总分<2为阴性,≥2为阳性。
1.2.3 疗效评价
依据RECIST标准进行疗效评价,分为完全缓解(complete response,CR);部分缓解(partial response,PR);疾病进展(progressive disease,PD)和疾病稳定(stable disease,SD)。以CR+PR计算客观缓解率(objective response rate,ORR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)。无疾病进展时间(progress free survival,PFS)定义为从第一次EGFR-TKI给药至疾病进展或死亡。总生存期(overall survival,OS)定义为开始口服EGFR-TKI治疗至患者死亡或末次随访时间。数据截止日尚生存的患者或在研究中失访的患者,将以最后一次随访日期结尾数值进行分析。末次随访时间截止至2010年6月,有7例(3.4%)失访,85例(42.9%)死亡。
1.3 统计学处理
采用统计学软件SPSS 16.0进行统计学处理。EGFR基因突变和EGFR磷酸化检测结果与临床特征、EGFR-TKI疗效采用χ2检验;多因素分析用logistic回归方法分析。生存分析采用Kaplan-Meier法,P<0.05为差异有统计学意义。
2 结 果
2.1 临床病理特征
入组205例患者中99例为男性,74例为吸烟或有吸烟史者,中位年龄61岁(28~84岁)。169例腺癌患者,168例为Ⅳ期患者。临床病理特征见表2。
2.2 生物标志物与EGFR-TKI疗效关系分析
2.2.1 EGFR基因突变
EGFR基因突变阳性率为44.9%(92/205),其中19外显子突变阳性率为24.4%(50/205),21外显子突变阳性率为17.1%(35/205),7例患者同时具有19和21外显子突变(3.4%,图1)。EGFR基因突变与吸烟状态有关,非吸烟者具有更高的EGFR基因突变率(P=0.024),而与其他临床病理特征(性别、年龄、病理类型、疾病分期)无关(P>0.05,表3)。
在194例接受EGFR-TKI治疗的患者中,51例为一线治疗,其余为二线或多线治疗。63例患者PD,71例SD,60例PR,无CR患者。EGFR基因突变型患者ORR和DCR均明显高于野生型[ORR:48.3%(43/89) vs 16.2%(17/105);DCR:80.9%(72/89) vs 56.2%(59/105)],差异均有统计学意义(P均<0.001)。将EGFR基因突变与临床病理特征进行多因素分析发现,EGFR基因突变是EGFR-TKI疗效的独立预测因子(OR=0.18,95%CI:0.09~0.38,P<0.001)。以EGFR-TKI治疗线数分层进行亚组分析显示,无论EGFR-TKI作为一线还是二线及多线治疗,EGFR基因突变型ORR均高于野生型[一线ORR:59.1%(13/22) vs 24.1%(7/29);二线及多线ORR:46.9%(30/65) vs 14.1%(10/73)],差异均有统计学意义(P=0.012,P<0.001,表4)。同样,EGFR基因突变型患者PFS显著长于野生型(中位PFS:8.8个月vs 2.1个月,P=0.024,图2)。
2.2.2 EGFR磷酸化酪氨酸1068表达
E G F R-p T y r 1 0 6 8表达阳性率为80.0%(164/205),其表达与临床病理特征(年龄、性别、病理类型、吸烟状态、疾病分期)均无明显相关性(图3,表3)。

表2 205例患者临床病理特征Tab. 2 Clinicopathologic characteristics of 205 patients
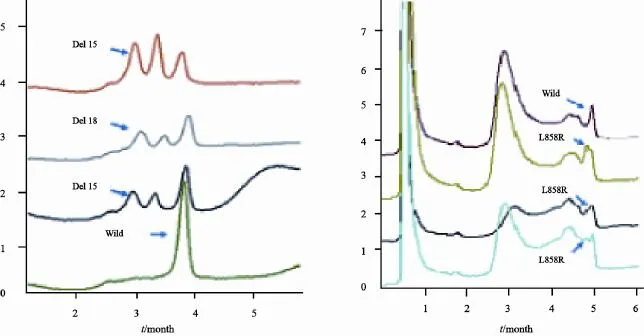
图1 EGFR 19、21外显子突变DHPLC峰图Fig. 1 EGFR 19 exon, 21 exon mutation by DHPLC
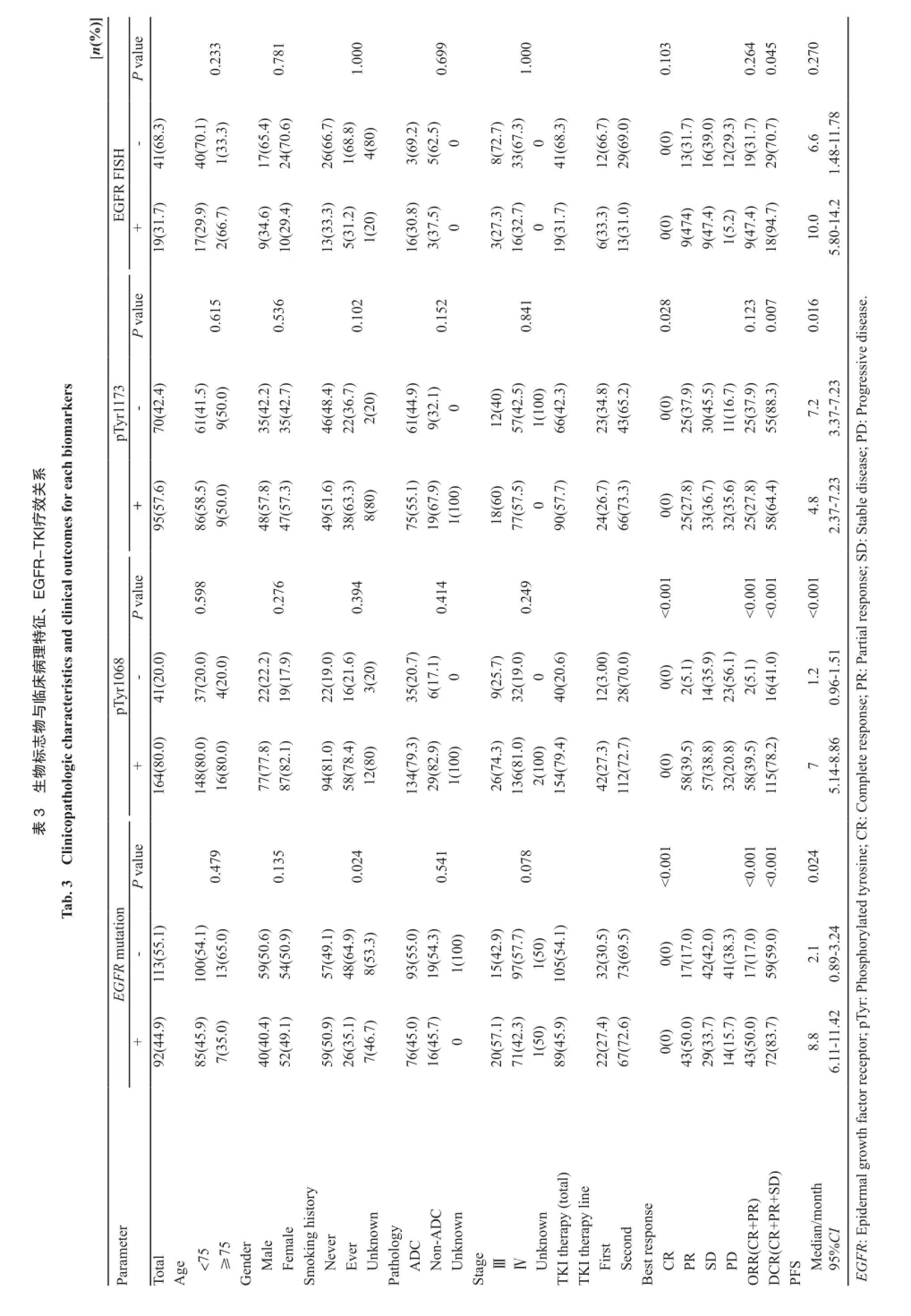
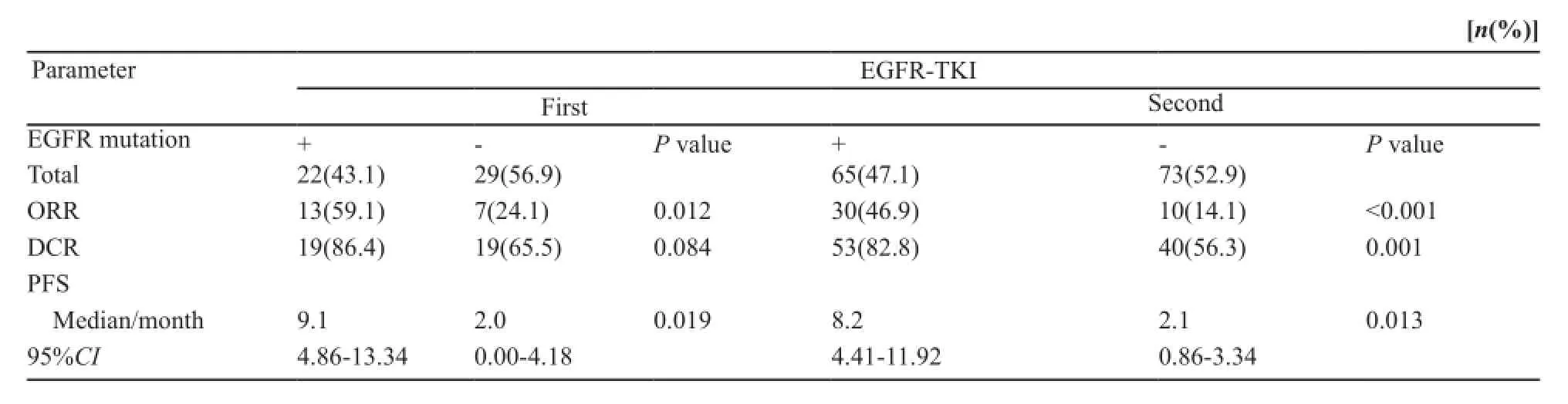
表4 EGFR基因突变与EGFR-TKI疗效关系Tab. 4 Relationship between EGFR mutation and EGFR-TKI ef fi cacy
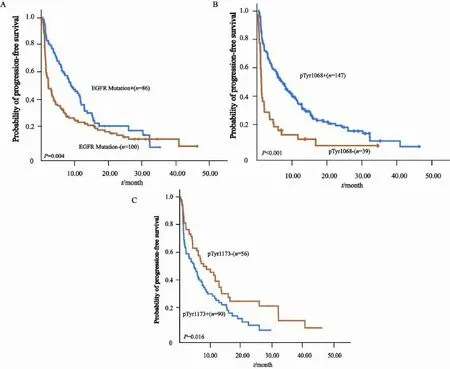
图2 不同生物标志物与PFS生存曲线图Fig. 2 Progress free survival curves according to each biomarker
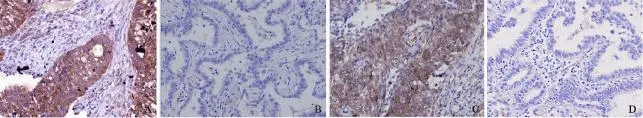
图3 免疫组化学检测EGFR磷酸化酪氨酸表达Fig. 3 EGFR phosphorylation at tyrosine 1068 (pTyr1068) and 1173 (pTyr1173) by IHC
对EGFR-pTyr1068表达与EGFR-TKI疗效关系分析显示,两者呈显著正相关。在接受EGFR-TKI治疗的患者中,EGFR-pTyr1068表达阳性患者ORR和DCR分别为37.7%(58/154)和74.7%(115/154),均明显高于表达阴性患者[5.0%(2/40)和40.0%(16/40)],差异均有统计学意义(P均<0.001,表2)。EGFR-pTyr1068表达阳性患者中位PFS为7.0个月,较表达阴性患者(1.2个月)明显延长,差异有统计学意义(P<0.001,图2)。多因素分析显示,EGFR-pTyr1068表达是EGFR-TKI的ORR(OR=0.24,95%CI:0.16~0.37,P<0.001)和PFS(HR=0.21,95%CI:0.13~0.34,P<0.001)的独立影响因素。
以EGFR基因突变状态分层进行亚组分析显示(表5,图4),在EGFR基因野生型患者中,EGFR-pTyr1068表达阳性率为69%(69/100)。EGFR-pTyr1068表达阳性和表达阴性患者ORR分别为23.2%(16/69)和3.2%(1/31),DCR分别为69.6%(48/69)和35.5%(11/31),差异均有统计学意义(P=0.010,P=0.001);EGFR-pTyr1068表达阳性患者中位PFS为3.6个月,较表达阴性患者(1.2个月)明显延长,差异有统计学意义(P<0.001)。在EGFR基因野生型患者中,EGFRTKI治疗17例达到PR,其中16例EGFR-pTyr1068表达阳性;SD患者53例,48例EGFR-pTyr1068表达阳性,进一步分析显示,16例EGFR-pTyr1068表达阳性,且对EGFR-TKI治疗有效患者的中位PFS为15.6个月(95%CI:7.28~23.9,图5)。多因素分析显示,EGFR-pTyr1068是EGFR基因野生型患者EGFR-TKI治疗的独立疗效预测因子(HR=0.17,95%CI:0.08~0.34,P<0.001)。
2.2.3 EGFR磷酸化酪氨酸1173表达
E G F R-p T y r 1 1 7 3表达阳性率为57.6%(95/165),其表达与临床病理特征(年龄、性别、病理类型、吸烟状态、疾病分期)均无明显相关性(图3,表2)。
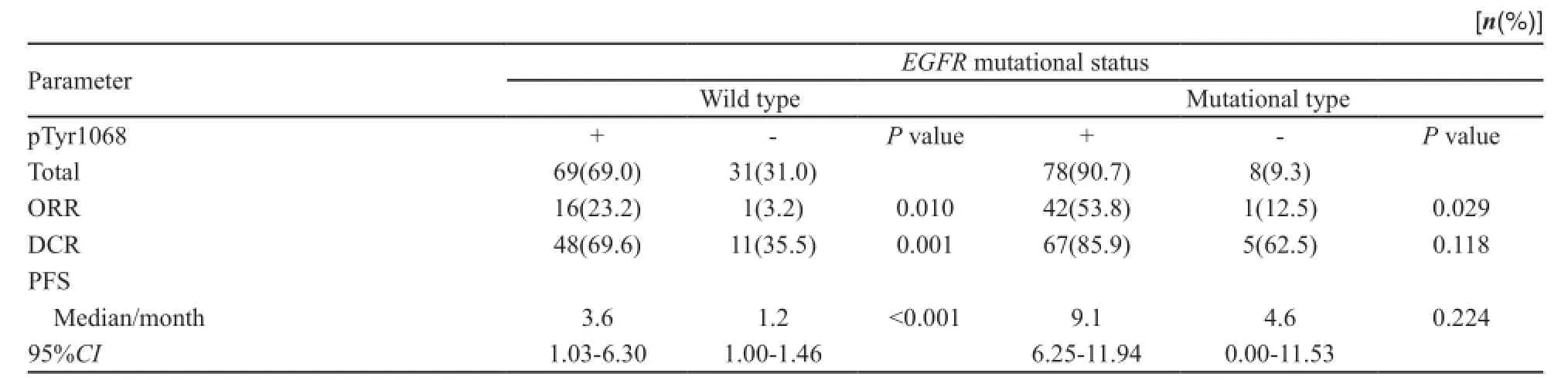
表5 以EGFR基因突变状态分层分析EGFR-pTyr1068与EGFR-TKI疗效关系Tab. 5 Relationship between EGFR-pTyr1068 and EGFR-TKI ef fi cacy strati fi ed by EGFR mutational status
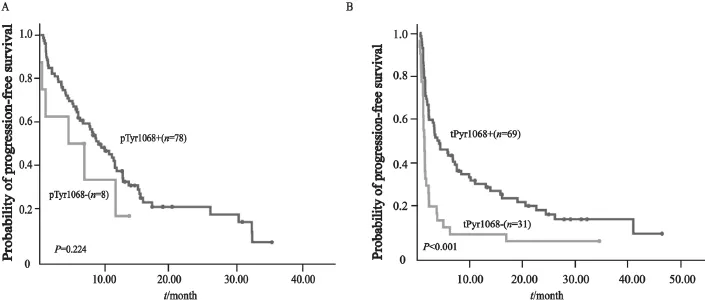
图4 以EGFR基因突变状态分层不同亚组PFS生存曲线图Fig. 4 Progression-free survival curves strati fi ed by EGFR mutational status
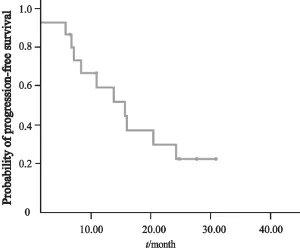
图5 16例EGFR基因野生型且pTyr-1068表达阳性对EGFRTKI有效者PFS生存曲线图Fig. 5 Progress free survival curves of 16 patients’ response to EGFR-TKI with EGFR wild status and pTyr1068 positive
对EGFR-pTyr1173表达与EGFR-TKI疗效关系分析显示,两者呈负相关,即EGFR-pTyr1173表达阴性者具有更好的疗效和更长的PFS。尽管在ORR方面EGFR-pTyr1173表达阳性患者与表达阴性者差异无统计学意义[27.8%(25/90) vs 37.9%(25/66),P=0.123],但与EGFR-pTyr1173表达阳性和表达阴性患者DCR分别为64.4%(58/90)和88.3%(58/66),差异有统计学意义(P=0.007)。EGFR-pTyr1173表达阳性患者中位PFS为4.8个月,较EGFR-pTyr1173表达阴性患者(7.7个月)明显缩短(P=0.009,图2)。
2.3 生物标志物间相互关系分析
EGFR-pTyr1068表达与EGFR基因突变呈弱相关,在EGFR基因突变型和野生型患者中,EGFR-pTyr1068表达阳性率分别为92.3%(84/91)和70.8%(80/113),差异有统计学意义(P<0.001);EGFR-pTyr1173表达与EGFR基因突变和EGFR-pTyr1068表达均无明显相关性(表6)。将3组生物标志物进行组合分析显示,同时具有EGFR突变阳性、EGFR-pTyr1068表达阳性和EGFR-pTyr1173表达阴性者对EGFR-TKI具有最好的疗效和生存获益[ORR为66.7%(20/30),DCR为96.7%(29/30),中位PFS为12.8个月,P<0.001,表7]。但这一结果因例数少缺乏说服力。

表6 EGFR基因突变与磷酸化EGFR表达间关系Tab. 6 Relationship between EGFR mutation and EGFR phosphorylations
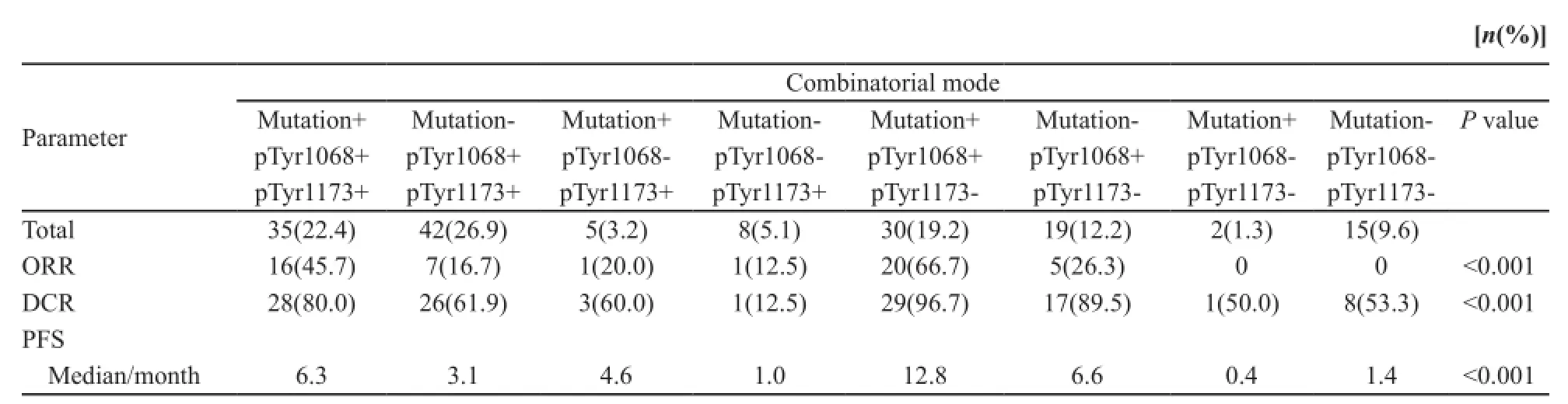
表7 生物标志物组合分析Tab. 7 Combinatory analysis of biomarkers
3 讨 论
蛋白质磷酸化是信号传导过程中的重要事件,在细胞生长、增殖、分化特别是细胞转化和肿瘤的发生、发展起重要作用,是细胞癌变的重要表现之一,可能是细胞增殖、分化的关键。目前研究已经确认EGFR的5个自身磷酸化位点,均位于EGFR细胞内区羧基端亚区的194个氨基酸残基上。其中,酪氨酸(Tyr)1068、1148和1173被称为主要位点;而Tyr992和1086被称为次要位点[16]。其他磷酸化位点还包括Tyr845、1045等。研究证明许多癌基因的编码产物是酪氨酸蛋白,它被酪氨酸激酶磷酸化后被激活形成磷酸化酪氨酸蛋白。酪氨酸磷酸化是蛋白质翻译修饰的一种形式,虽然磷酸化的酪氨酸在整个蛋白中浓度较低,但在信号传导过程中起了关键作用[17]。酪氨酸磷酸化所介导的信号传导途径具有多向性,包括细胞增殖、迁移、分化和内环境的稳定,下游信号的级联反应取决于不同位点磷酸化。干扰EGFR磷酸化能抑制下游事件的发生,如导致细胞周期阻滞和延缓肿瘤生长[8]。体外细胞系研究显示,当EGFR基因突变时,表皮生长因子(epidermal growth factor,EGF)配体诱导的EGFR磷酸化表达水平具有显著差异,而总EGFR表达无明显差异[18-19]。在EGFR-TKI敏感型细胞系中磷酸化EGFR蛋白表达明显增加,总EGFR蛋白却无此变化。基于磷酸化EGFR是EGFR的活性形式,本研究回顾性分析晚期NSCLC患者组织标本中活化EGFR即磷酸化EGFR表达与EGFR基因突变的关系,并探讨其表达对晚期NSCLC患者,尤其EGFR基因野生型患者接受EGFR-TKI治疗的疗效预测价值。结果显示EGFR基因突变与EGFR-pTyr1068磷酸化表达呈弱相关性,而与EGFR-pTyr1173表达无关,与国外研究报道一致[20-22],提示EGFR基因突变最初可能通过改变EGFR-pTyr1068磷酸化水平继而影响细胞内信号传导。
本研究发现肿瘤组织标本中E G F R-pTyr1068表达能有效预测EGFR-TKI疗效,在所有接受EGFR-TKI治疗的患者中,EGFR-pTyr1068表达阳性者ORR和PFS均优于表达阴性者。并且EGFR-pTyr1068对EGFR-TKI的预测作用并非隶属于或伴随于EGFR基因突变,而是独立存在。以EGFR基因突变状态分层进行亚组分析显示,在EGFR基因野生型患者中,EGFRTKI治疗17例达到PR,其中16例EGFR-pTyr1068表达阳性;在53例获得SD的患者中,48例EGFR-pTyr1068表达阳性。这组EGFR-pTyr1068表达阳性的患者PFS较阴性者差异有统计学意义(中位PFS:3.6个月 vs 1.2个月,P<0.001)。即EGFR-pTyr1068表达可以从EGFR基因野生型的患者中再筛选出94.1%(16/17)对EGFR-TKI敏感、81.4%(48/59)可从EGFR-TKI治疗中获得疾病稳定的患者。提示EGFR-pTyr1068表达可能成为EGFR基因突变的补充筛选遗漏。
正如体外细胞系研究证实,EGFR胞内段磷酸化位点常作为一系列蛋白分子的停泊位点并激活下游级联信号反应[11,20],pTyr1068位点与激活Akt信号有关[11,23-24],因而成为EGFR活化的标志。Helfrich等[25]研究显示不单在EGFR突变型细胞系株(H3255),而且在吉非替尼敏感的野生型细胞株(H322和Calu3)中均发现pTyr1068高表达,同时高表达者对吉非替尼亦更敏感。Amann等[26]研究发现在吉非替尼敏感细胞株中存在EGFR持续磷酸化,突变型细胞株的磷酸化水平明显高于野生型细胞株。这些实验结果说明EGFR磷酸化可以不依赖于EGFR基因突变而被激发并激活下游信号传导。本研究发现EGFR基因野生型患者亦可EGFR磷酸化高表达,也许可解释为何10%~20%无EGFR基因突变的患者仍对吉非替尼或厄洛替尼有效。
Hijiya等[27]对另一个磷酸化位点Tyr1173进行研究显示,其表达与吉非替尼疗效无关。Emery等[28]研究却发现EGFR-TKI治疗中pTyr1173高表达者具有更长的TTP。本研究与此相反,pTyr1173表达与靶向治疗疗效呈负相关,pTyr1173表达阳性者PFS更短,预后更差。pTyr1173主要为Shc提供停泊位点而与MAPK信号通路活化有关,提示MAPK信号通路异常调节可能使晚期NSCLC患者对EGFR-TKI治疗抵抗。已有临床研究发现MAPK信号活化可能对肿瘤细胞具有抗凋亡和导致吉非替尼耐药的作用[29],但需要更多研究加以证实。
本研究结果证实,EGFR基因突变是EGFRTKI疗效和生存的强烈预测因子;EGFR-pTyr1068表达对从EGFR野生型患者中筛选EGFR-TKI治疗有效者具有潜在的意义。此外,本组EGFR野生型患者的ORR高于文献报道[19,30-31]。可能原因为:①本研究为国内单中心研究,入组者均为中国大陆患者;②本研究入组的大部分患者均以一线治疗前或手术时所获取的组织学标本检测EGFR基因突变状态,而非利用EGFR-TKI治疗前的即时标本进行检测。前期的化疗可能改变EGFR基因突变状态,使之难以正确反映EGFR-TKI二、三线治疗前EGFR基因突变的真实状态;③肿瘤组织内及原发肿瘤和转移灶之间的异质性影响EGFR基因检测及其临床预测作用。
综上所述,EGFR-pTyr1068可能作为晚期NSCLC患者接受FR-TKI治疗的有效预测因子,尤其对从EGFR野生型患者中筛选EGFR-TKI治疗有效者具有重要作用,但尚需前瞻性、多中心的研究验证,使晚期NSCLC患者个体化EGFR-TKI治疗的预测更为精准。
[1] SHEPHERD F A, RODRIGUES P J, CIULEANU T, et al. Erlotinib in previously treated non-small-cell lung cancer[J]. N Engl J Med, 2005, 353(2): 123-132.
[2] KIM E S, HIRSH V, MOK T, et al. Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase Ⅲ trial [J]. Lancet, 2008, 372(9652): 1809-1818.
[3] LYNCH T J, BELL D W, SORDELLA R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J]. N Engl J Med, 2004, 350(21): 2129-2139.
[4] PAEZ J G, JANNE P A, LEE J C, et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy [J]. Science, 2004, 304(5676): 1497-1500.
[5] HAN S W, KIM T Y, HWANG P G, et al. Predictive and prognostic impact of epidermal growth factor receptor mutation in non-small-cell lung cancer patients treated with gefitinib[J]. J Clin Oncol, 2005, 23(11): 2493-2501.
[6] PAO W, MILLER V, ZAKOWSKI M, et al. EGF receptor gene mutations are common in lung cancers from ''never smokers'' and are associated with sensitivity of tumors to gefitinib anderlotinib [J]. Proc Natl Acad Sci U S A, 2004, 101(36): 13306-13311.
[7] HANAHAN D, WEINBERG R A. The hallmarks of cancer[J]. Cell, 2000, 100(1): 57-70.
[8] HYNES N E, LANE H A. ERBB receptors and cancer: the complexity of targeted inhibitors [J]. Nat Rev Cancer, 2005, 5(5): 341-354.
[9] SCHULZE W X, DENG L, MANN M. Phosphotyrosine interactome of the ErbB-receptor kinase family [J]. Mol Syst Biol, 2005, 1: 8.
[10] GAZDAR A F, MINNA J D. Inhibition of EGFR signaling: all mutations are not created equal [J]. PLoS Med, 2005, 2(11): e377.
[11] SCHLESSINGER J. Common and distinct elements in cellular signaling via EGF and FGF receptors [J]. Science, 2004, 306(5701): 1506-1507.
[12] YARDEN Y. The EGFR family and its ligands in human cancer. signalling mechanisms and therapeutic opportunities[J]. Eur J Cancer, 2001, 37 Suppl 4: S3-8.
[13] WAKELING A E, GUY S P, WOODBURN J R, et al. ZD1839 (Iressa): an orally active inhibitor of epidermal growth factor signaling with potential for cancer therapy [J]. Cancer Res, 2002, 62(20): 5749-5754.
[14] HAN S W, HWANG P G, CHUNG D H, et al. Epidermal growth factor receptor (EGFR) downstream molecules as response predictive markers for gefitinib (Iressa, ZD1839) in chemotherapy-resistant non-small cell lung cancer [J]. Int J Cancer, 2005, 113(1): 109-115.
[15] PARRA H S, CAVINA R, LATTERI F, et al. Analysis of epidermal growth factor receptor expression as a predictive factor for response to gefitinib (‘Iressa’, ZD1839) in nonsmall-cell lung cancer [J]. Br J Cancer, 2004, 91(2): 208-212.
[16] BISHAYEE S. Role of conformational alteration in the epidermal growth factor receptor (EGFR) function [J]. Biochem Pharmacol, 2000, 60(8): 1217-1223.
[17] ZWICK E, BANGE J, ULLRICH A. Receptor tyrosine kinases as targets for anticancer drugs [J]. Trends Mol Med, 2002, 8(1): 17-23.
[18] CAPPUZZO F, MAGRINI E, CERESOLI G L, et al. Akt phosphorylation and gefitinib efficacy in patients with advanced non-small-cell lung cancer [J]. J Natl Cancer Inst, 2004, 96(15): 1133-1141.
[19] CAPPUZZO F, LIGORIO C, JANNE P A, et al. Prospective study of gefitinib in epidermal growth factor receptor fluorescence in situ hybridization-positive/phospho-Aktpositive or never smoker patients with advanced non-smallcell lung cancer: the ONCOBELL trial [J]. J Clin Oncol, 2007, 25(16): 2248-2255.
[20] SORDELLA R, BELL D W, HABER D A, et al. Gefitinibsensitizing EGFR mutations in lung cancer activate antiapoptotic pathways [J]. Science, 2004, 305(5687): 1163-1167.
[21] OKABE T, OKAMOTO I, TAMURA K, et al. Differential constitutive activation of the epidermal growth factor receptor in non-small cell lung cancer cells bearing EGFR gene mutation and amplification [J]. Cancer Res, 2007, 67(5): 2046-2053.
[22] OKAMOTO I, KENYON LC, EMLET D R, et al. Expression of constitutively activated EGFRvIII in non-small cell lung cancer [J]. Cancer Sci, 2003, 94(1): 50-56.
[23] PURVIS J, ILANGO V, RADHAKRISHNAN R. Role of network branching in eliciting differential short-term signaling responses in the hypersensitive epidermal growth factor receptor mutants implicated in lung cancer [J]. Biotechnol Prog, 2008, 24(3): 540-553.
[24] MOSCATELLO D K, HOLGADO-MADRUGA M, GODWIN A K, et al. Frequent expression of a mutant epidermal growth factor receptor in multiple human tumors [J]. Cancer Res, 1995, 55(23): 5536-5539.
[25] HELFRICH B A, RABEN D, VARELLA-GARCIA M, et al. Antitumor activity of the epidermal growth factor receptor (EGFR) tyrosine kinase inhibitor gefitinib (ZD1839, Iressa) in non-small cell lung cancer cell lines correlates with gene copy number and EGFR mutations but not EGFR protein levels[J]. Clin Cancer Res, 2006, 12(23): 7117-7125.
[26] AMANN J, KALYANKRISHNA S, MASSION P P, et al. Aberrant epidermal growth factor receptor signaling and enhanced sensitivity to EGFR inhibitors in lung cancer [J]. Cancer Res, 2005, 65(1): 226-235.
[27] HIJIYA N, MIYAWAKI M, KAWAHARA K, et al. Phosphorylation status of epidermal growth factor receptor is closely associated with responsiveness to gefitinib in pulmonary adenocarcinoma [J]. Hum Pathol, 2008, 39(3): 316-323.
[28] EMERY I F, BATTELLI C, AUCLAIR P L, et al. Response to gefitinib and erlotinib in non-small cell lung cancer: a restrospective study [J]. BMC Cancer, 2009, 9: 333.
[29] ZIMMER S, KAHL P, BUHL T M, et al. Epidermal growth factor receptor mutations in non-small cell lung cancer influence downstream Akt, MAPK and Stat3 signaling [J]. J Cancer Res Clin Oncol, 2009, 135(5): 723-730.
[30] HAN S W, KIM T Y, JEON Y K, et al. Optimization of patient selection for gefitinib in non-small cell lung cancer by combined analysis of epidermal growth factor receptor mutation, K-ras mutation, and Akt phosphorylation [J]. Clin Cancer Res, 2006, 12(8): 2538-2544.
[31] YANG C H, YU C J, SHIH J Y, et al. Specific EGFR mutations predict treatment outcome of stage ⅢB/Ⅳ patients with chemotherapy-naive non-small-cell lung cancer receiving first-line gefitinib monotherapy [J]. J Clin Oncol, 2008, 26(16): 2745-2753.
Relationship between EGFR protein phosphorylation, EGFR mutation and EGFR-TKI ef fi cacy in advanced non-small cell lung cancer
WANG Fen1, WANG Jie2, BAI Hua2, WANG Shu-hang2, WANG
Shu-bin1, SHEN Dong-lan1
(1.Department of Oncology, Peking University Shenzhen Hospital, Shenzhen Guangdong 518036, China; 2.Department of Thoracic Oncology, Beijing Cancer Hospital, Beijing 100036, China)
WANG Fen E-mail: bonjourwf@gmail.com
Background and purpose: EGFR-TKI (EGFR-tyrosine kinase inhibitors), represented by ge fi tinib and erlotinib, have exhibited signi fi cant antiproliferative effects against non-small cell lung cancer (NSCLC) with low toxicity. EGFR gene mutation was discovered to be a predictive biomarker for EGFR-TKI treatment. Although the ef fi cacy of EGFR-TKI is limited to EGFR wild-type patients, it is still noticeable suggesting that some other mechanisms are responsible for it. The current study is aimed at evaluating the expression of phosphorylated EGFR in advanced NSCLC, investigating its relationship with EGFR mutations and EGFR-TKI ef fi cacy. Methods: EGFR gene mutations were detected by denaturing high performance liquid chromatography (DHPLC) in 205 stageⅢB-ⅣNSCLC patients. The expressions of phosphorylated tyrosine 1068 (pTyr1068) and 1173 (pTyr1173) were detected by immunohistochemistry. Results: The positive expressions of pTyr1068 and pTyr1173 were 80.0% (164/205) and 57.6% (95/165) respectively. None of them were related to clinical pathological characteristics (age, gender, pathological type, smoking status, disease stage). EGFR gene mutation rate was 44.9% (92/205), which was only related to smoking status (P=0.024) compared to other clinical pathological characteristics. EGFR gene mutations were poorly related to pTyr1068 expression (P<0.001) and not related to pTyr1173 expression (P=0.297). The objective response rate (ORR), disease control rate (DCR), and progressive free survival (PFS) of EGFR-TKI treatment in patients with EGFR mutations were 48.3% (43/89), 80.9% (72/89) and 8 months (95%CI: 6.11-11.42) respectively, which were signi fi cantly higher than that of EGFR wild-type patients [ORR=16.2% (17/105, P<0.001); DCR=56.2% (59/105, P<0.001); Median PFS: 2.1 months, (95%CI: 0.89-3.24; P=0.001)]. Superior ORR: DCR and PFS appeared in patients with pTyr1068 positive expression compared to negative [ORR: 37.7% (58/154) vs 5.0% (2/40, P<0.001); DCR: 74.7% (115/154) vs 40.0% (16/40, P<0.001); Median PFS: 7.0 months vs 1.2 months, P<0.001)]. Inversely, the patients with pTyr1173 positive expression had lower ORR, DCR and shorter PFS [ORR: 27.8% (25/90) vs 37.9% (25/66, P=0.123); DCR: 64.4% (58/90) vs 83.3% (55/66, P=0.007); Median PFS: 4.8 months vs 7.7 months (P=0.016)]. In subgroup of EGFR wild-type patients, positive expression of pTyr1068 was 69.0% (69/100). EGFR wild-type patients with pTyr1068 positive expression had a prolonged PFS and elevated ORR and DCR compared to negative [median PFS: 3.6 months vs 1.2 months (P<0.001); ORR: 23.2% vs 3.2% (P=0.010); DCR: 69.6% vs 35.5% (P=0.001)]. Sixteen patients with pTyr1068 positive expression who responded to EGFR-TKI treatment in this subgroup had a remarkable PFS [median PFS: 15.6 months (95%CI: 7.28-23.9)]. Multiple factor analysis showed that the expression of pTyr1068 was an independence predictor factor for EGFR-TKI treatment (OR=0.24, 95%CI: 0.16~0.37, P<0.001). Conclusion: Phosphorylation at Tyr1068 of EGFR might be a potential predictive factor for clinical response and survival of EGFR-TKI treatment in patients with advanced NSCLC, especially in EGFR wild-type patients.
Advanced non-small-cell lung cancer; Epidermal growth factor receptor phosphorylation; Epidermal growth factor receptor mutation; Epidermal growth factor receptor-tyrosine kinase inhibitors; Predictive factor.
10.3969/j.issn.1007-3969.2014.09.004
R734.2
A
1007-3639(2014)09-0657-12
2014-02-27
2014-04-30)
王芬 E-mail:bonjourwf@gmail.com

