蛋鸡感染H9N2AIV后输卵管不同部位病毒的分布及病理组织学观察
陈占莉,曹晓蕾,唐 超,江跃德,黄晶晶,李 涛,王秋珍,伍成奇,王晶钰
(西北农林科技大学动物医学院,陕西杨凌 712100)
蛋鸡感染H9N2AIV后输卵管不同部位病毒的分布及病理组织学观察
陈占莉,曹晓蕾,唐 超,江跃德,黄晶晶,李 涛,王秋珍,伍成奇,王晶钰*
(西北农林科技大学动物医学院,陕西杨凌 712100)
为探索H9N2AIV感染蛋鸡致输卵管功能异常的机理,对蛋鸡感染H9N2亚型AIV后输卵管不同部位病毒载量与病理变化进行检测与观察。以H9N2亚型AIV人工感染非免疫蛋鸡,在感染后3、5、7 d分别采取鸡输卵管组织,real-time PCR检测感染鸡输卵管组织中AIV病毒载量,同时HE染色后观察病理组织学变化。结果表明,real-time PCR从鸡输卵管膨大部、峡部、子宫部和阴道部均检出了禽流感病毒,其中以膨大部和子宫部病毒载量最高,分别达5.27×104拷贝/μL±3.55×103拷贝/μL和5.52×104拷贝/μL±3.14×103拷贝/μL。组织病理学观察发现蛋鸡感染H9N2亚型AIV后输卵管膨大部、峡部和子宫部病变明显。观察到上皮细胞脱落坏死,炎性细胞浸润腺体,腺体间隙变大甚至溶解,腺体组织充血出血。本研究证实蛋鸡感染H9N2亚型AIV后输卵管组织中AIV病毒载量与其病理变化存在明显的正相关。
鸡输卵管;H9N2亚型禽流感病毒;病理变化;病毒载量
鸡输卵管是鸡蛋形成的重要器官,依据其结构与功能分为漏斗部、膨大部、峡部、子宫部和阴道部5个部分。其中膨大部的分泌物形成鸡蛋的蛋白和系带,峡部的分泌物形成鸡蛋的内外壳膜,而子宫部是蛋壳形成的场所[1]。鸡输卵管发生炎症、水肿、出血等病变,其功能异常将会对鸡蛋的形成产生影响[2]。禽流感病毒(Avain influenza virus,AIV)感染蛋鸡群除发生死亡、引起宿主免疫抑制外,还可造成蛋鸡群产蛋量下降30%~80%,产退色蛋、畸形蛋、砂皮蛋、软壳蛋,受精率及孵化率下降,病程持续时间长的可达月余[3]。发病鸡剖检可见生殖系统出现卵泡变形充血,甚至破裂,腹腔内有破裂的卵黄出现卵黄性腹膜炎;输卵管出血,内有白色黏稠的分泌物,甚至粘连,有成型蛋滞留产道[4]。多年来,国内外研究主要集中在AIV对家禽呼吸系统和消化系统的致病方面[5],有关蛋鸡感染AIV致鸡输卵管功能异常的机理研究鲜有报道。
本试验用低致病性H9N2亚型AIV人工感染非免疫蛋鸡,感染后不同时间采取鸡输卵管组织,用实时荧光定量PCR(real-time PCR)检测感染鸡输卵管组织不同部位中AIV病毒载量,通过HE染色观察其病理组织学变化。探讨蛋鸡感染H9N2亚型AIV后输卵管组织中病毒载量与病理变化的关系,以期为蛋鸡感染H9N2亚型AIV后发生产蛋异常机理提供试验依据。
1 材料与方法
1.1 材料
1.1.1 毒株与试验用动物 H9N2亚型AIV(A/chicken/Shaanxi/11/2012)毒株,从一只病死鸡中分离得到,并由西北农林科技大学畜禽疫病防治与畜产品安全实验室鉴定保存[6]。25周龄非免产蛋高峰期罗曼蛋鸡(H9N2禽流感病毒HI抗体≤2Log2)、10日龄SPF鸡胚由杨凌绿方生物工程有限公司提供。
1.1.2 主要试剂 苏木素、伊红染液购自碧云天生物技术研究所;SuperScript III Platinum SYBR Green One-Step qRT-PCR、pMDTM19-T vector Cloning试剂盒购自宝生物工程(大连)有限公司;DH5α感受态细胞由西北农林科技大学畜禽疫病防治和畜产品安全实验室保存。
1.2 方法
1.2.1 H9N2亚型AIV人工感染非免疫蛋鸡及临床症状观察 将保存于-80℃的H9N2亚型AIV保存液复苏做1 000倍稀释,0.1mL接种10日龄SPF鸡胚尿囊腔,37℃温箱孵育,接种72h后无菌收集尿囊液。血凝试验测定其血凝价为27~8,置-80℃保存备用。用前测定EID50。模仿自然感染通过滴鼻、点眼(106.83EID50/mL/只)攻毒25周龄眼观健康、经禽流感病毒抽检呈阴性的非免蛋鸡9只,同时设3只为对照组。对照组与感染组严格隔离饲养,蛋鸡自由采食及饮水。鸡舍严格消毒,并将排泄物进行无害化处理。每天观察感染蛋鸡临床症状,并于感染后第3、5、7天分别颈部放血处死3只蛋鸡,对照组蛋鸡于第7天处死,分离并采取输卵管。将采集的鸡输卵管组织按5个部位分别分成两组,第1组立即保存于液氮中备用,第2组40g/L多聚甲醛溶液固定24h后制作石蜡切片。
1.2.2 引物的设计及合成 参考GenBank中H9N2亚型AIV的 M基因的核酸序列(KC767262)[6],利用Oligo 6.0软件,设计引物,所设计的特异性上、下游引物序列分别为:5′-TTCTAACCGAGGTCGAAAC-3′;5′-AAGCGTCTACGCTGCAGTCC-3′。预 计 扩 增 片段长度为229bp,由上海英骏生物工程有限公司合成。
1.2.3 阳性重组质粒的制备 按照Trizol法提取H9N2亚型AIV RNA,立即将提取的RNA反转录成cDNA,以cDNA为模板PCR扩增M基因片段。20g/L琼脂糖凝胶电泳观察结果,纯化回收PCR阳性产物。将纯化的PCR产物与pMDTM19-T vector连接并转化DH5α感受态细胞进行克隆。经琼脂糖凝胶电泳鉴定为阳性的菌液按高纯质粒小量提取试剂盒说明书提取质粒并PCR扩增,EcoRⅠ 和SalⅠ双酶切鉴定质粒。将PCR和双酶切鉴定均为阳性的菌液送南京金斯瑞生物技术有限公司测序。鉴定为阳性的克隆质粒命名为pMD-M,作为构建H9N2亚型AIV M基因标准曲线的阳性标准品。
1.2.4 标准曲线的建立 阳性标准品pMD-M连续10倍梯度稀释,选101~106稀释度作为real-time PCR模板,制作标准曲线。反应体系为20μL:阳性标准品pMD-M 2μL,SYBR Green Reaction Mix 10 μL,dd H2O 10μL,上、下游引物各0.5μL。最佳扩增反应程序为:95℃5min;94℃15s,55℃20s,72℃50s,共40个循环。每次试验均设立1个空白对照,当空白对照为阴性时,试验有效[7]。
1.2.5 Real-time PCR 检测 H9N2亚型 AIV 感染蛋鸡输卵管不同部位组织中禽流感病毒载量 将保存于液氮中的输卵管组织按Trizol法提取RNA。立即将提取的RNA反转录成cDNA,并测定cDNA浓度。将各部位稀释成相同的浓度,作为real-time PCR检测的模板。反应体系与条件同1.2.4。
1.2.6 蛋鸡感染H9N2亚型AIV后输卵管不同部位病理组织学观察 将固定好的鸡输卵管组织常规方法制作石蜡切片,HE染色观察其病变[2]。
1.2.7 试验数据 统计分析 采用Excel 2007处理数据,SPSS 17.0统计软件中的 One-way ANOVA过程进行单因子方差分析,以P<0.01为差异显著性标准,结果表示为平均数±标准差。
2 结果
2.1 H9N2亚型AIV M基因RT-PCR扩增
以H9N2亚型AIV cDNA为模板,PCR扩增获得229bp条带,与预期片段大小一致(图1)。
2.2 M基因的克隆
将扩增的M基因PCR产物回收后与pMDTM19-T vector连接,转化DH5α感受态细胞,挑取白色菌落提取质粒;阳性质粒经EcoRⅠ 和SalⅠ双酶切鉴定,得到2 692bp和229bp的两个条带,与预期结果相符。本试验成功克隆了5株AIV的M基因(图2)。重组质粒pMD-M测序结果显示序列正确,无突变。
2.3 标准曲线的建立
以10倍梯度稀释重组质粒pMD-M为模板进行real-time PCR扩增,根据DNA拷贝数和Ct值绘制标准曲线(图3)。Real-time PCR对 H9N2亚型AIV M基因的扩增效率(E)为93%;标准曲线的相关系数(R2)为0.9901,该值接近1;产物Ct值与浓度之间的线性关系好,并且在102~107拷贝/反应范围内有很好的线性关系。结果说明本试验构建的标准曲线能够准确地对待检测产物进行扩增。
2.4 H9N2亚型AIV感染鸡输卵管组织中AIV载量的测定
参照标准曲线由Ct值计算得病毒载量,N/A代表未检测到病毒。从表1可以得出鸡输卵管5个部位除漏斗部未检测到禽流感病毒外,其他4个部位都检测出了禽流感病毒。而且病毒载量有一定的差异性,其中膨大部和子宫部差异不显著(P>0.05),峡部和阴道部差异不显著(P>0.05),而漏斗部和膨大部、峡部、子宫部、阴道部差异极显著(P<0.01)。
2.5 蛋鸡感染H9N2亚型AIV临床症状及病变
蛋鸡于攻毒后第3天出现精神沉郁、脸部水肿、采食量下降等临床症状;部分蛋鸡产蛋量下降、产软壳蛋;剖检未见明显病理变化。攻毒后第5天,试验组蛋鸡只有1只鸡产软壳蛋,其余均停止产蛋;且蛋鸡精神极度沉郁、采食量极少、卧地不起;剖检发现输卵管发炎、水肿。攻毒后第7天,蛋鸡均停止产蛋;剖检发现输卵管出血,内有大量黏液性物质,有一条输卵管中有成型蛋滞留。
2.6 H9N2亚型AIV感染蛋鸡输卵管不同部位病理组织学观察

图1 H9N2亚型AIV M基因RT-PCR扩增Fig.1 RT-PCR products of M gene of H9N2subtype
蛋鸡感染H9N2亚型AIV后,输卵管组织主要受损伤的部位为膨大部、峡部和子宫部,病理学观察可见上皮细胞脱落坏死,腺体间隙变大、有炎性细胞侵入腺体、腺体组织充血出血。漏斗部和阴道的病变不明显。
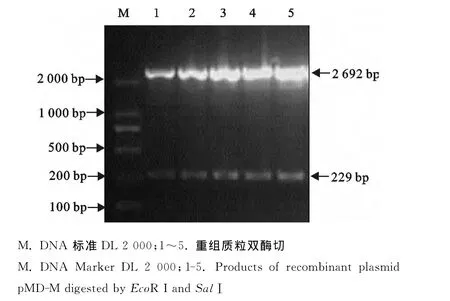
图2 M基因重组质粒的酶切鉴定Fig.2 Identification of M gene recombinant plasmid by restriction endonuclease digestion
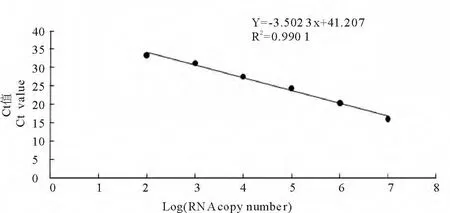
图3 Real-time PCR标准曲线Fig.3 The standard curve of real-time PCR

表1 感染鸡输卵管组织中禽流感病毒载量的real-time PCR测定Table 1 The viral load detection results of real-time PCR in tissue of 9hen oviducts
2.6.1 漏斗部病理变化 可见轻度的上皮细胞脱落及炎性细胞侵润(图4)。A1为对照组蛋鸡输卵管漏斗部。A2、A3、A4分别为攻毒后第3、5、7天试验组蛋鸡输卵管漏斗部的病理组织变化。A1显示漏斗部的浆膜被覆单层纤毛柱状上皮,由纤毛细胞和分泌细胞组成,其固有层内有管状腺。A2中未显示明显的病理变化。A3中b显示腺体中有少量的腺上皮细胞脱落。A4中a显示有柱状上皮细胞脱落坏死,c显示管状腺中有炎性细胞侵润。
2.6.2 膨大部病理学变化 可见有大量的上皮细胞脱落坏死、炎性细胞侵入腺体、腺上皮细胞脱落及腺体溶解(图5)。B1为对照组蛋鸡输卵管膨大部。B2、B3、B4分别为攻毒后第3、5、7天试验组蛋鸡输卵管膨大部的病理组织变化。B1显示膨大部具有密生腺管浆膜被覆单层纤毛状或假复层纤毛柱状上皮,由柱状上皮细胞和分泌细胞组成。B2中a显示有大量的柱状上皮细胞脱落甚至坏死。B3中a显示有大量的柱状上皮细胞脱落坏死以致浆膜层断裂;b显示腺上皮细胞脱落。B4中a显示绒毛减少,浆膜层断裂;b显示腺上皮细胞脱落坏死,腺体间隙变大;c显示管状腺中有大量的炎性细胞侵润以致腺体轮廓不清。
2.6.3 峡部病理学变化 显微观察可见浆膜上皮断裂,腺体溶解(图6)。C1为对照组蛋鸡输卵管峡部。C2、C3、C4分别为攻毒后第3、5、7天试验组蛋鸡输卵管峡部的病理组织变化。C1显示峡部纵行浆膜褶含有很多次级褶,肌层发达。C2种b显示腺上皮细胞脱落坏死。C3中d显示有大量的腺体溶解,部分腺体消失。C4中a显示绒毛减少,浆膜层断裂;d显示腺体溶解致其轮廓不清。

图4 漏斗部病理组织学变化(HE染色,400×)Fig.4 Histopathological lesions of infundibulum (HE staining,400×)
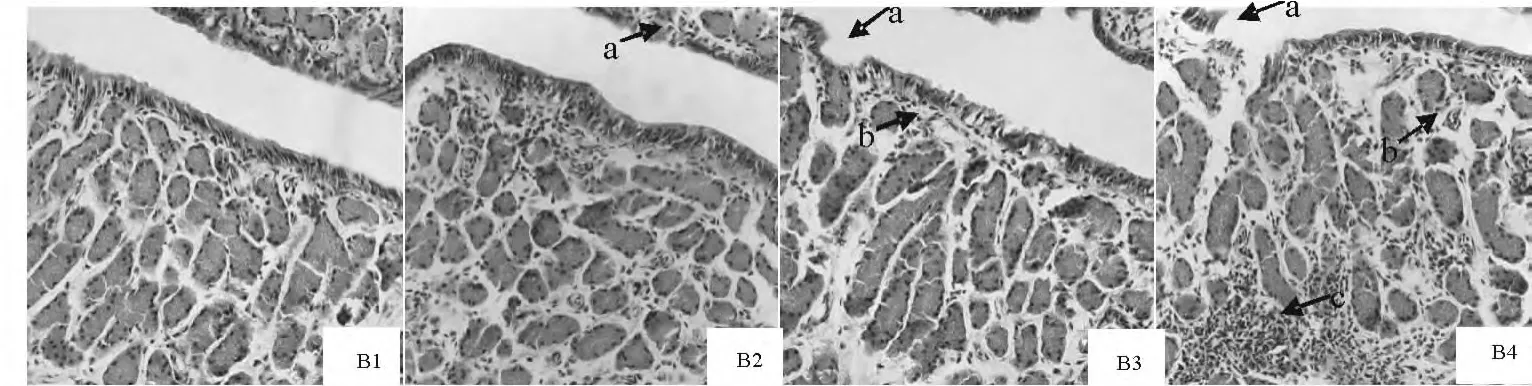
图5 膨大部病理组织学变化(HE染色,400×)Fig.5 Histopathological lesions of magnum (HE staining,400×)

图6 峡部病理组织学变化(HE染色,400×)Fig.6 Histopathological lesions of isthmus(HE staining,400×)
2.6.4 子宫部病理学变化 主要病变为浆膜上皮断裂,腺体溶解,组织充血出血(图7)。D1为对照组蛋鸡输卵管子宫部。D2、D3、D4分别为攻毒后第3、5、7天试验组蛋鸡输卵管子宫部的病理组织变化。D1显示为浆膜被覆假复层纤毛柱状上皮,由纤毛细胞和分泌细胞组成。固有层内有短而细的分支管状腺。D2种a显示绒毛减少;d显示腺体溶解、轮廓不清。C3中e显示腺体中组织充血与出血。D4中a显示绒毛减少,浆膜层断裂;d显示腺体轮廓不清。2.6.5 阴道部病理学变化 观察可见轻度的上皮细胞脱落(图8)。E1为对照组蛋鸡输卵管阴道部。E2、E3、E4分别为攻毒后第3、5、7天试验组蛋鸡输卵管阴道部的病理组织变化。E1显示固有层内有少量单管状腺,其肌层发达。E2中未显示明显的病理变化。E3和E4显示有上皮细胞脱落坏死。

图7 子宫部病理组织学变化(HE染色,400×)Fig.7 Histopathological lesions of uterus(HE staining,400×)

图8 阴道部病理组织学变化(HE染色,400×)Fig.8 Histopathological lesions of vagina(HE staining,400×)
3 讨论
H9N2亚型AIV感染蛋鸡可致其产蛋量下降,病愈后难以恢复原有水平;产畸形蛋、软壳蛋、沙壳蛋;病鸡输卵管发炎、出血、水肿,管内有白色胶冻样或干酪样物质[8-9]。本试验人工感染蛋鸡H9N2亚型AIV,感染3d后蛋鸡产蛋量下降、产软壳蛋,5d后停止产蛋。蛋鸡剖检发现输卵管壁发炎,管腔中黏膜脱落、内有大量脓性分泌物,其中有2只蛋鸡输卵管萎缩,1只蛋鸡输卵管有成型蛋滞留。该试验结果与文献报道一致。
Real-time PCR检测方法已广泛应用于mRNA的表达研究、测定单核苷酸(SNPs)的多态性及检测DNA 的拷贝数等[10]。目前,real-time PCR 方法已被成功地应用于AIV的流行病学调查、诊断及检测研究[11-14]。Zhu Z等[7]采用 SYBR Green-based real time RT-PCR检测方法对2013年发生的H7N9 AIV进行了检测,为H7N9AIV的快速诊断奠定了基础。万春和等[15]通过SYBR Green实时荧光定量RT-PCR方法对蛋鸭中H9N2亚型AIV进行了特异性强、重复性良好的检测。本研究通过设计AIV M基因引物建立标准曲线,对H9N2亚型AIV感染蛋鸡输卵管组织中AIV病毒载量进行了定量分析。试验结果显示蛋鸡输卵管5个部位除漏斗部未检测到禽流感病毒外,其他4个部位都检测到禽流感病毒,且病毒载量有一定的差异性。其中膨大部和子宫部病毒载量最高且差异不显著(P>0.01),峡部和阴道部病毒载量次之且差异不显著(P>0.01),而漏斗部和膨大部、峡部、子宫部、阴道部差异极显著(P<0.01)。
Sae Silva M等[2]证实高致病性禽流感病毒能够致蛋鸡生殖道组织损伤并发生明显病理变化。本试验通过HE染色发现H9N2亚型AIV感染蛋鸡,输卵管主要受损伤的部位是膨大部、峡部和子宫部,而伞部和阴道部只见有少量上皮细胞脱落。膨大部有大量柱状上皮细胞脱落甚至坏死以致浆膜层断裂,腺上皮细胞脱落、腺体间隙变大,腺体中有大量的炎性细胞侵润以致腺体轮廓不清。膨大部是蛋白形成的场所[16],故其受到损害输卵管分泌物异常即出现炎症。峡部有部分腺体溶解消失。子宫部腺体溶解、轮廓不请,腺体组织充血、出血。峡部的分泌物形成鸡蛋的内外壳膜[1],子宫部主要参与蛋壳的形成[17]。H9N2亚型AIV感染对子宫部及峡部的损伤会导致蛋壳及壳膜不能正常形成,这可能是蛋鸡感染流感病毒后产软壳蛋和沙皮蛋等劣质蛋的原因之一。漏斗部和阴道部在鸡蛋的生成过程中分别提供受精场所及产出的通道,并不参与鸡蛋的形成。可见,AIV感染蛋鸡对输卵管的损伤主要在对鸡蛋生成过程起重要作用的部位。
本试验对蛋鸡感染流感病毒后输卵管不同部位病理变化与病毒载量相关性进行了研究。结合real-time PCR检测结果与HE染色,发现病毒载量检出多的部位发生明显的组织病理学变化,即蛋鸡感染H9N2亚型AIV后输卵管不同部位组织病理变化与流感病毒载量存在明显的正相关。蛋鸡感染H9N2亚型AIV后输卵管组织中病毒的侵入导致组织损伤是蛋鸡在临床上出现产蛋量下降、产劣质蛋的重要原因。
[1]沈霞芬.家畜组织学与胚胎学[M].北京:中国农业出版社,2007:246-247.
[2]Sae Silva M,Rissi D R,Pantin-Jackwood M,et al.Highpathogenicity avian influenza virus in the reproductive tract of chickens[J].Vet Pathol,2013,50(6):956-960.
[3]赵继勋.我国禽流感的流行情况及其防控[J].中国家禽,2013,35(18):35-36.
[4]孙泉云,陈 琦,夏炉明.H9N2亚型禽流感流行现状[J].动物医学进展,2011,32(10):107-111.
[5]Bano S,Naeem K,Malik S A.Evaluation of pathogenic potential of avian influenza virus serotype H9N2in chickens[J].Avian Dis,2003,47(3):817-822.
[6]Wang J Y,Ren J J,Liu W H,et al.Complete genome sequence of a new H9N2avian influenza virus isolated in China[J].Genome Announ,2013,1(3):e00261-13.
[7]Zhu Z,Fan H,Qi X,et al.Development and evaluation of a SYBR green-based real time RT-PCR assay for detection of the emerging avian influenza A (H7N9)virus[J].PLoS One,2013,8(11):e80028.
[8]陆国庆,路卫星,王景春.H9N2亚型禽流感的流行动态及其防制策略[J].上海畜牧兽医通讯,2013 20(2):51-53.
[9]罗 玲,胡薛英,程国富,等.H9N2亚型禽流感病毒人工感染蛋鸡的组织病理学研究[J].中国预防兽医学报,2004,26(4):259-265.
[10]Qian W P,Tan Y Q,Chen Y,et al.Rapid quantification of semen hepatitis B virus DNA by real-time polymerase chain reaction[J].World J Gastroenterol,2005,11(34):5385-5389.
[11]胡 涛,滕巧泱,申伟霞,等.H9N2亚型禽流感病毒荧光定量PCR方法的建立及初步应用[J].中国动物传染病学报,2013,52(2):121-127.
[12]秦智锋,吕建强,肖性龙,等.禽流感 H5,H7,H9亚型多重实时荧光RT-PCR检测方法的建立[J].病毒学报,2006,22(2):131-136.
[13]Li P Q,Zhang J,Muller C P,et al.Development of a multiplex real-time polymerase chain reaction for the detection of influenza virus type A including H5and H9subtypes[J].Diagn Microbiol Infect Dis,2008,61(2):192-197.
[14]Ong W T,Omar A R,Ideris A,et al.Development of a multiplex real-time PCR assay using SYBR Green 1chemistry for simultaneous detection and subtyping of H9N2influenza virus type A[J].J Virol Meth,2007,144(1-2):57-64.
[15]万春和,林 甦,施少华,等.H9亚型鸭源禽流感病毒SYBR Green实时荧光定量RT-PCR快速检测方法的建立[J].福建农业学报,2010,25(4):387-391.
[16]李 晶.鸡输卵管发生的形态学研究[D].吉林延边:延边大学基础兽医学系,2006.
[17]陈耀星.兽医组织学彩色图谱[M].北京:中国农业大学出版社,2007:223-224.
Distribution and Pathological Observation Avain Influenza Virus H9N2in Hen Oviducts
CHEN Zhan-li,CAO Xiao-lei,TANG Chao,JIANG Yue-de,HUANG Jing-jing,LI-Tao,WANG Qiu-zhen,WU Cheng-qi,WANG Jing-yu
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yanglin,Shaanxi,712100,China)
In order to explore the mechanism about the abnormal function of hens oviduct,the viral loads were detected and histologic changes were observed in hens oviduct infected with H9N2AIV.Hens were infected with H9N2AIV experimentally.Tissue samples of the hen oviducts were collected at 3,5,and 7 days post-inoculation.real-time PCR was used to detect the AIV viral loads and HE staining was employed to observe the histopathological lesions in the hen oviducts.The results showed that the AIV viral loads in hen oviducts were detected.The viral loads in magnum and uterus were higher,5.27×104±3.55×103copies/μL and 5.52×104±3.14×103copies/μL respectively.Obvious pathological lesions were presented in magnum,isthmus and uterus.Epithelial villus fell off,broad hemorrhage,inflammatory cell invasion and gland necrosis were observed in hen oviducts.This study showed that the viral loads were positively correlated with the histopathological lesions in hen oviducts.
H9N2avian influenza virus;hen oviduct;pathological lesion;viral load
S852.659.5
A
1007-5038(2014)11-0056-06
2014-05-10
国家自然科学基金项目(31272577)
陈占莉(1985-),陕西榆林人,硕士研究生,主要从事动物疫病防控研究。*通讯作者

