不同菌种对豆粕中水苏糖、棉子糖的发酵降解与检测技术研究
付亭亭 綦文涛 李爱科, 刘建学 梁新晓 贠婷婷 王永伟
(河南科技大学食品与生物工程学院1,洛阳 471000)
(国家粮食局科学研究院2,北京 100037)
豆粕中的棉籽糖和水苏糖分别占大豆可溶性糖类的5.2%~15.8%和12.1%~35.2%[1],因其能够引起动物尤其是幼龄动物的胀气、腹泻、腹痛等症状[2],同时很难通过简单的加热或加工除去[3],而极大的限制了豆粕的推广应用。目前,公认最有前景的方法是通过酶降解或微生物发酵等生物技术手段进行消减或者彻底去除。微生物发酵豆粕时所产生的丰富酶系,不仅能将豆粕中的水苏糖和棉籽糖降解为可供微生物利用的单糖[4],而且也可将豆粕中的其他抗营养因子降解。因此,相关研究也越来越受到关注。目前豆粕中棉籽糖和水苏糖的常用检测方法多为HPLC法,但已报道的HPLC法还存在检测时间较长,精度不够等问题,不适合于日常快速检测。除此之外,发酵豆粕还存在很多的不足,如在动物上的应用研究还不够细致,发酵产品的差异也比较大,所采用菌种多种多样,但功效不明确等。因此,优良菌种的筛选,不同菌种的抗营养因子降解效果检验和标准化的产品评价方法仍是发酵豆粕下一步研究的重点。
基于上述问题,本研究在建立准确、快速水苏糖和棉籽糖检测方法的基础上,以豆粕为来源,通过固态发酵的方法,以微生物的增殖活性、发酵豆粕的感官评价及水苏糖和棉籽糖的降解情况等为评价指标,筛选出具有应用潜力的优良菌株和复配方案,为发酵豆粕的准确评价和稳定产品的开发打下基础。
1 材料与方法
1.1 试剂与仪器
YPD培养基:酵母膏5 g,蛋白胨10 g,葡萄糖20 g,蒸馏水 1 L,115℃灭菌25 min。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1 L,121℃灭菌25 min。
MRS培养基:牛肉膏10 g,蛋白胨10 g,葡萄糖20 g,酵母浸膏5 g,磷酸钾2 g,柠檬酸氢二铵2 g,无水乙酸钠 5 g,Tween 80 1 mL,硫酸镁 0.58 g,硫酸锰 0.25 g,蒸馏水1 L,pH 6.2~6.8,115℃灭菌30 min。
牛肉膏蛋白胨酪蛋白选择培养基:氯化钠5 g,干酪素3 g,10%乳酸适量,琼脂20 g,蛋白胨10 g,牛肉膏3 g,蒸馏水1 L,121℃灭菌25 min。
棉籽糖标准品:经科宏达;水苏糖标准品:TIC公司,2种糖纯度均大于98%。乙腈为色谱纯试剂:Dikma公司;Milli-Q50超纯水处理器:Millipore公司。
UV-2102紫外-可见分光光度计:美国尤尼柯仪器有限公司;PRX-350B智能人工气候箱:宁波海曙赛福实验仪器厂;HSP-400生化培养箱:哈尔滨东联电子技术开发有限公司;Mini Spain高速离心机:美国Eppendorf;粉碎机:天津市泰斯特仪器有限公司;60目分样筛:浙江上虞市公路仪器厂;高效液相色谱系统:Waters。
1.2 试验方法
1.2.1 HPLC检测水苏糖和棉籽糖方法的建立
1.2.1.1 色谱条件的建立
采用Waters 2410示差折光检测器,色谱柱采用日本岛津公司Inertsil NH2柱(4.6 mm×250 mm i.d.,5μm);流动相为乙腈∶水为 65∶35(V/V);流速1.0 mL/min;柱温35℃,检测器温度为40℃。
1.2.1.2 水苏糖和棉籽糖检测线性范围的确定
配制 2.00、2.50、4.00、5.00、6.00、8.00、10.00 mg/mL的棉籽糖标准品溶液和4.00、8.00、10.00、12.00、16.00、20.00、40.00 mg/mL的水苏糖标准品溶液。根据测定的峰面积(A,mV/s)和对应的糖质量浓度(c,mg/mL)进行线性回归,分别得到棉籽糖和水苏糖的标准曲线方程。
1.2.1.3 HPLC测定
吸取10.50 mg/mL的水苏糖和2.00 mg/mL的棉籽糖标准品溶液,重复进样5次,以测得的峰面积(A,mV/s)为指标,测定检测方法的重现性[5]。
取供试样品5份,每份1.50 g,按照样品提取工艺处理,检测所建色谱条件用于样品检测时的可重复性[6]。
1.2.1.4 HPLC检测法的回收率试验
取已知含量的样品1.00 g,分别定量加入水苏糖和棉籽糖标准品,按照样品处理方法处理样品,进样测定并计算,计算水苏糖和棉籽糖的平均加样回收率。
1.2.2 菌种的筛选和鉴定
1.2.2.1 菌种的来源
本试验所使用的菌种一部分来源于实验室保藏菌种,另一部分从豆粕中筛选而来。
1.2.2.2 菌种的筛选
取豆粕样品10.0 g,放入带有玻璃珠的三角瓶中,加90mL生理盐水,震摇20 min,使样品与生理盐水充分混合均匀。之后将悬液制成10-9~10-1不等的稀释度样品液,然后将其涂布在牛肉膏蛋白胨酪蛋白培养基上,置于30℃培养箱中,培养1~3 d,观察[7]。从其中挑选出能够在培养基上生长且能够产生透明水解圈的菌株。以产蛋白酶能力为指标,筛选出可用菌株。
1.2.2.3 菌种的鉴定
通过显微镜下菌体观察、芽孢检测以及16S rRNA序列分析来鉴定菌种名称。
1.2.2.4 菌种的生长曲线测定方法
将菌种分别从斜面固体培养基接种于相应的液体培养基中,并于30℃(酵母菌)、37℃(枯草芽孢杆菌和屎肠球菌)200 r/min摇床培养,每隔2 h取样,测定培养液的OD600,使用未接种的培养液做空白对照。
1.2.3 豆粕的固态发酵工艺
准确称取豆粕 45 g,以 9∶0.5∶0.5(豆粕∶玉米粉∶麸皮)的比例加入麸皮和玉米粉,以15%的接种量,料水比为1∶0.8,30℃发酵48 h后,50℃干燥3 h,粉碎过筛即可。
1.2.4 发酵豆粕感官分析
豆粕经过上述条件发酵后,通过眼观、鼻闻等方法对发酵豆粕的颜色、气味及黏度。称取10.00 g样品于平皿中进行感官评价,评价标准参考 NY/T 22182012中对发酵豆粕中的要求。
1.2.5 样品处理
称取过60目筛的样品0.15 g,准确至0.000 1 g,加入50%的乙腈1.5mL,超声辅助提取45 min,温度为40℃。以4 000 r/min离心10 min,取上清液经0.45μm滤膜过滤[8]。用 HPLC分析其中水苏糖和棉子糖的含量。
1.2.6 数据处理
数据处理采用EXCEL和SPSS 17.0统计分析软件进行处理,各组间均数差异性比较采用的是One-Way ANOVA方法,显著性水平P<0.05。水苏糖和棉子糖含量分析采用的是Waters公司Empower 2色谱工作站,测定出目标峰峰面积之后,带入标准曲线计算其含量。
2 结果与分析
2.1 HPLC检测水苏糖和棉籽糖方法的建立
2.1.1 水苏糖和棉籽糖HPLC检测方法的有效性
图1为水苏糖和棉子糖标准品的HPLC色谱图,由图1可见本研究所建立的色谱条件可以使水苏糖和棉子糖标准品有效分离,分离效果良好,二者的出峰时间(Retention Time,RT)分别为12.6、8.6 min,整个分析过程可在15 min内完成。
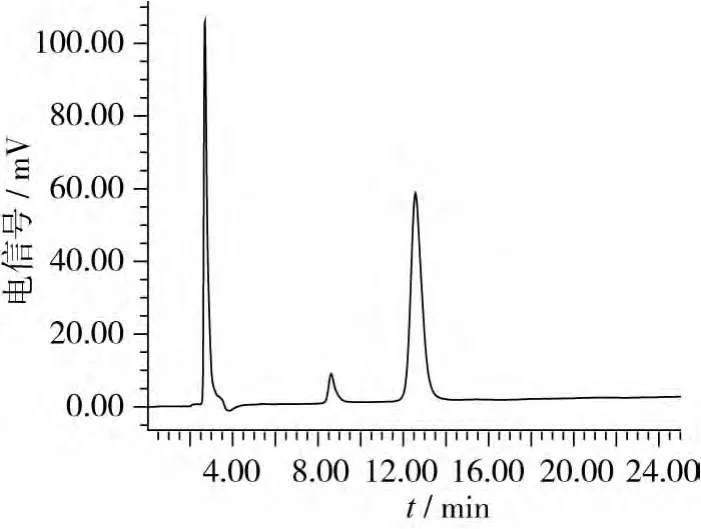
图1 水苏糖和棉籽糖标准品色谱图
2.1.2 HPLC检测水苏糖和棉籽糖的线性范围
以峰面积(A,mV/s)为横坐标,浓度(c,mg/mL)为纵坐标制作标准曲线,得到图2和图3。图2和图3分别为水苏糖和棉子糖的标准曲线。对所得数据进行线性回归,分别得到水苏糖和棉籽糖的标准曲线方程为:
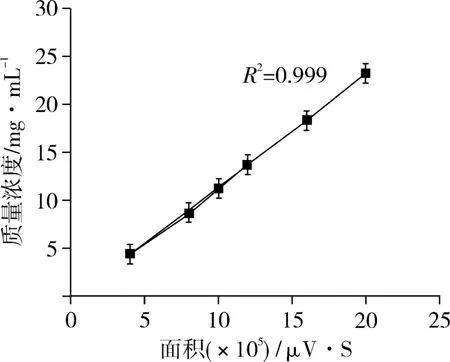
图2 水苏糖标准曲线

图3 棉籽糖标准曲线
水苏糖线性方程:c=8×10-6A+0.380
棉籽糖线性方程:c=9×10-6A+0.269
结果表明:棉籽糖的检测范围为2.00~10.00 mg/mL,水苏糖的检测范围为 4.00~40.00 mg/mL,且棉籽糖和水苏糖在其检测范围内线性良好。
2.1.3 HPLC检测水苏糖和棉籽糖的精密度
吸取10.50 mg/mL的水苏糖和2.00 mg/mL的棉籽糖标准品溶液,重复进样5次[9],以测得的峰面积(A,mV/s)为指标,得水苏糖的 RSD为 0.89%(n=5),棉籽糖的 RSD为0.81%(n=5)。
2.1.4 HPLC检测水苏糖和棉籽糖的回收率
取已知含量的样品1.00 g,分别定量加入水苏糖和棉籽糖标准品,按照样品处理方法处理样品,进样测定并计算,得出水苏糖的平均加样回收率为95.68%,棉籽糖的平均加样回收率为95.08%,试验结果见表1。
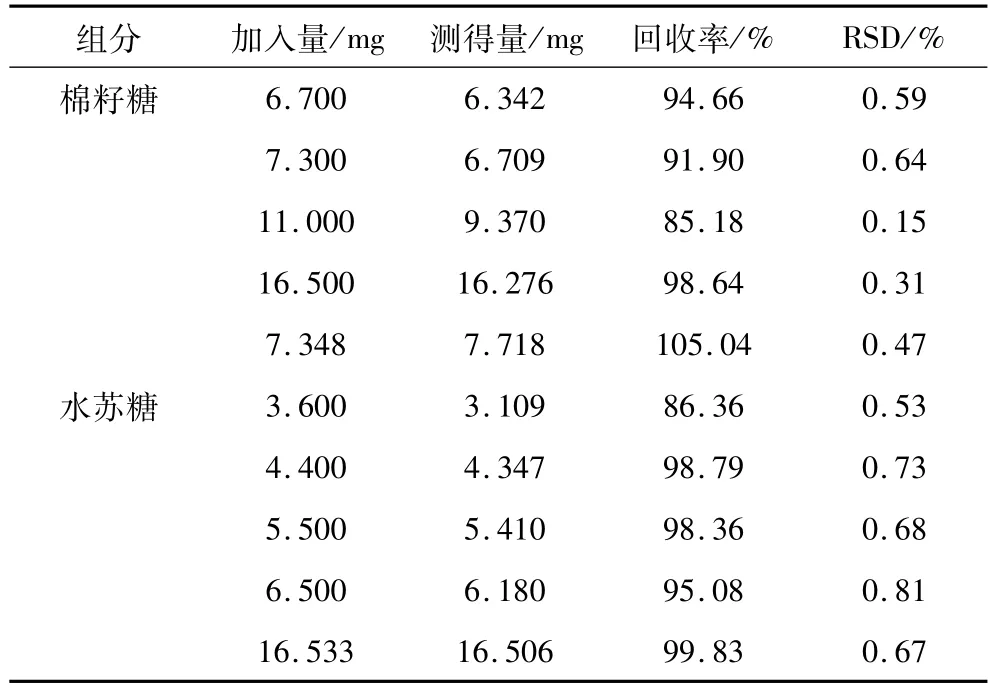
表1 方法回收率(n=5)
由以上数据可以得出,本试验所采用的HPLC检测水苏糖和棉籽糖方法适合于水苏糖和棉籽糖的准确、快速定量。
2.2 菌种的筛选和鉴定
2.2.1 菌种的筛选
优良的菌种是固态发酵豆粕的基础,而菌株的蛋白酶活性的高低是利用其进行固态发酵所要考虑的首要因素。本研究以产蛋白酶能力和固态发酵时微生物细胞的增殖能力为考核指标,通过稀释平板涂布法筛选出具有应用潜力的发酵豆粕菌株。表2为初步筛选出的6株菌的菌落形态。其中菌株A1和B1呈光滑圆润的乳白色菌落形态,并能够形成显著的蛋白水解圈(如图4),具有很好的蛋白酶生成能力。

表2 分离纯化菌株在培养基上的菌落形态
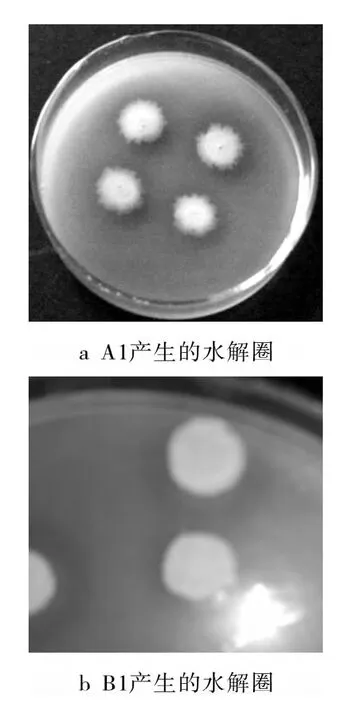
图4 A1和B1产生的水解圈

图5 A1和B1的生长曲线
以牛肉膏培养基为培养基质,每隔2小时取样,绘制了A1和B1的生长曲线。由图5可知,菌株A1和B1在液体培养基中生长的延迟期均较短,且生长速率较高。其中,A1和B1的对数生长期分别在2~20 h和2~14 h,生长稳定期分别为20 h和14 h。因此,A1和B1的最佳接种龄分别为16~20 h和10~14 h。
为了进一步考察A1和B1能否充分的利用豆粕生长繁殖,对这两株菌发酵豆粕前后的活菌数进行了测定,结果见图6。
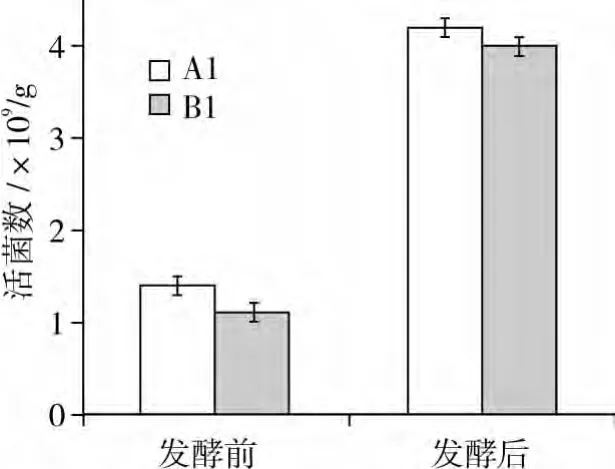
图6 A1和B1发酵豆粕前后活菌数
从图6可以得出,发酵前后菌株A1和B1的活菌数分别增加了3.6倍和3倍。因此,所筛得菌株均可以利用豆粕作为底物生长繁殖。
2.2.2 菌种的鉴定
将筛得菌株的16S rRNA基因序列分析测序结果通过BLAST与GenBank里收录的细菌16S rRNA基因序列进行对比,发现菌株A1与枯草芽孢杆菌(Bacillus subtilis)同源相似度达到了99.0%;B1与屎肠球菌(Enterococcus faecium)的同源相似度达到了99.0%。根据两株细菌的显微形态及菌落形态,结合16S rRNA序列分析,确定菌株A1和B1分别为枯草芽孢杆菌(Bacillus subtilis)和屎肠球菌(Enterococcus faecium)。
A1的16S rRNA基因序列分析部分碱基片段如图7所示。


图7 A1菌株部分DNA序列
B1的16S rRNA基因序列分析部分碱基片段如图8所示。


图8 B1菌株部分DNA序列
2.3 不同菌种发酵豆粕的感官评价与水苏糖、棉子糖降解分析
由于混合菌种发酵同时具有提高蛋白含量,弥补单一菌种发酵的不足,降低抗营养因子等多重优点,因此在发酵豆粕领域混合菌种发酵较单一菌种发酵更具有优势。本研究采用实验室保存菌株(包括产朊假丝酵母(CU1)、8605酵母粉)和筛选菌株枯草芽孢杆菌和屎肠球菌分别进行了豆粕单一菌种和混合菌种固态发酵,在对发酵后产品进行感官评价的基础上,利用本研究所建立方法,测定了发酵后豆粕中的水苏糖和棉籽糖的降解情况,结果如表3所示。
通过感官性状的分析发现,本试验所采用的菌株发酵豆粕后均为黄色或浅黄色。屎肠球菌或产朊假丝酵母单一菌种发酵后豆粕均具有酸香味,两者混合发酵后酸香味更加浓郁。由于筛选的菌种屎肠球菌和枯草芽孢杆菌均有高产蛋白酶活性,因此发酵后豆粕黏度较大。产朊假丝酵母、枯草芽孢杆菌以及屎肠球菌混合发酵后,豆粕不仅颜色金黄,酸香味浓郁,而且黏度较大,符合优质发酵豆粕的感官要求。
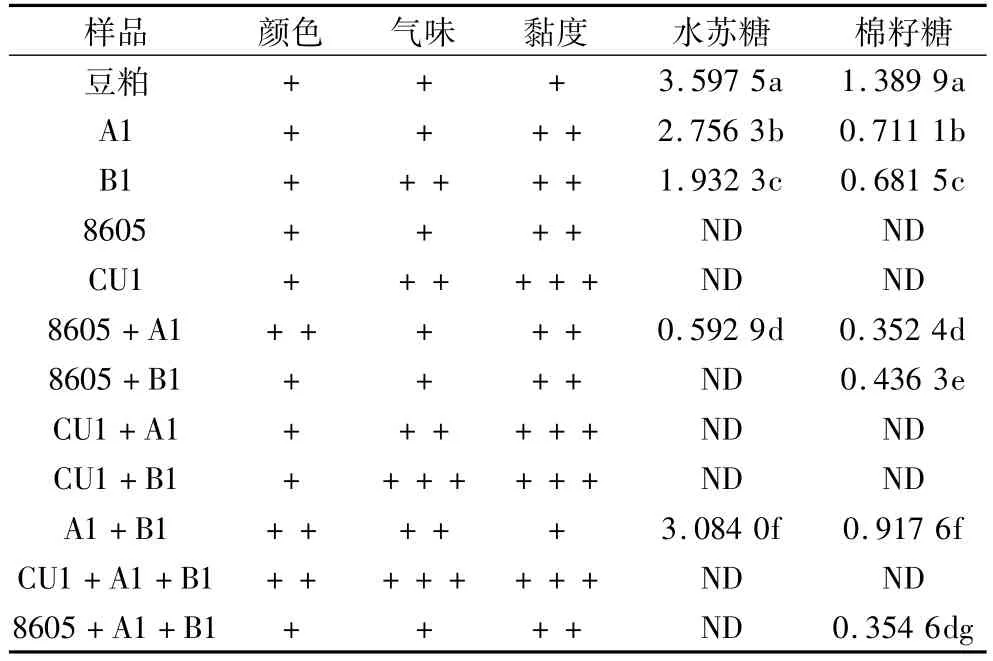
表3 豆粕及发酵豆粕的产品评价结果/%(n=5)
在对发酵豆粕进行感官评价之后,使用上述建立色谱条件,对发酵豆粕中的水苏糖和棉籽糖进行检测,发现发酵豆粕中的水苏糖和棉籽糖能与样品中的其他组分在20 min内有效分离,且峰形较好,如图9和图10所示。所得RSD为1.95%(n=5),表明所建检测方法可以准确的用于发酵豆粕中水苏糖和棉子糖的检测分析。
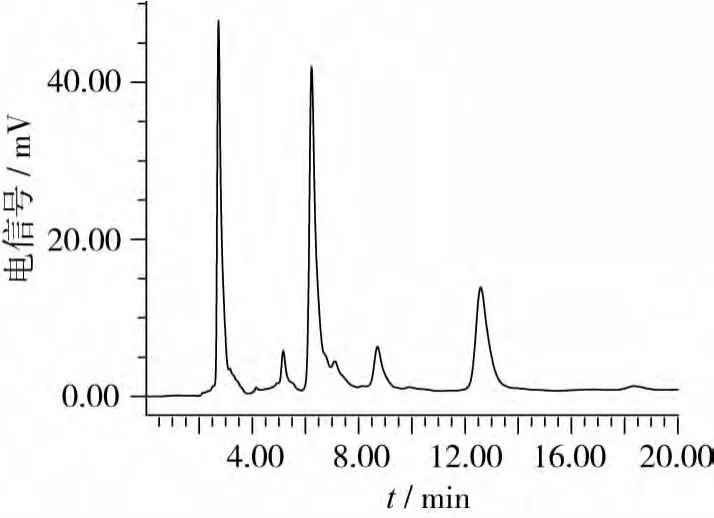
图9 发酵前样品色谱图
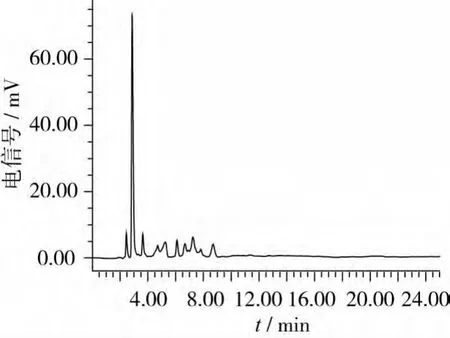
图10 发酵后样品色谱图
从表3中可知,酵母菌CU1和8605单一菌种发酵后可将豆粕中的水苏糖和棉籽糖完全降解。这一结果与 Cavazzoni等[10]的研究结果一致。Cavazzoni证明了假丝酵母能够在以棉籽糖为唯一碳源的矿物培养基中产生A和B 2种α-半乳糖苷酶,其中A型在pH和温度适宜的情况下能将培养基中的棉籽糖完全降解。产朊假丝酵母混合枯草芽孢杆菌或屎肠球菌所得发酵豆粕具有良好的感官性状,并且其中水苏糖和棉子糖等抗营养因子完全降解。与之相比,酵母8605在与枯草芽孢杆菌和屎肠球菌混合发酵时,能将水苏糖完全降解,棉籽糖部分降解。这可能是因为枯草芽孢杆菌或屎肠球菌竞争抑制了酵母的生长,而枯草芽孢杆菌的生长繁殖过程不需要糖的存在,其对糖的利用率很低,因此当酵母与枯草芽孢杆菌混合发酵豆粕时,对低聚糖的降解没有单纯使用酵母发酵的效果好。
屎肠球菌发酵豆粕的过程中,优先利用较容易吸收的蔗糖,之后会部分的分解利用水苏糖[11],在整个发酵过程中,随着屎肠球菌的生长繁殖培养基的pH会逐渐减少到5.0以下,而Mital等[12]证明了乳酸菌所产生的α-半乳糖苷酶类的活性范围在pH 4.5~8.0,这就导致了豆粕中的水苏糖和棉籽糖被部分分解,而不是被完全降解。
由于多菌种混和发酵豆粕后,不同微生物产生的混合酶系丰富,能将豆粕中大分子的蛋白降解为小分子的寡肽,使豆粕中的抗营养因子,如胰蛋白酶抑制因子、脲酶、水苏糖、棉籽糖以及抗原蛋白等被完全降解,显著提高了豆粕的适口性和消化率[13]。然而多菌种混合发酵的综合作用是单一菌种所不能完成的,因此混合菌种发酵豆粕更具有应用潜力。
3 结论
3.1 建立了20 min内能将发酵豆粕中的水苏糖和棉籽糖准确检测HPLC法,在该方法下水苏糖和棉籽糖的检测限分别为4.00~40.00 mg/mL和2.00~10.00 mg/mL,平均加样回收率分别为95.68%和95.08%,满足对豆粕中水苏糖和棉籽糖的检测要求,适合于发酵豆粕的日常检测。
3.2 筛选出了具有发酵豆粕应用潜力的枯草芽孢杆菌和屎肠球菌。并对不同菌种单一菌种和混合菌种发酵后豆粕中水苏糖和棉籽糖的降解效果进行了评价,结果表明酵母菌CU1和8605单菌发酵后可将豆粕中的水苏糖和棉籽糖完全降解。枯草芽孢杆菌和屎肠球菌单一菌种发酵后可将水苏糖和棉籽糖部分降解。
[1]Rackis J J,Honig D J,Sessa D J,et al.Flavor and flatulence factors in soybean protein products[J].Journal of Agricultural and Food Chemistry,1970,18(6):977-982
[2]Songré-Ouattara L T,Mouquet-Rivier C,Icard-Verniere C,et al.Enzyme activities of lactic acid bacteria from a pearlmillet fermented gruel(ben-saalga)of functional interest in nutrition[J].International Journal of Food Microbiology,2008,128(2):395-400
[3]王金斌,马海乐,段玉清,等.混菌固态发酵豆粕生产优质高蛋白饲料研究[J].中国粮油学报,2009,24(2):120-124
[4]Mital B K,Steinkraus K H.Utilisation of oligosaccharides by lactic acid bacteria during fermentation of soy milk[J].Journal of Food Science,1975,40(1):114-118
[5]尹俊发,杨更亮,李志伟,等.高效液相色谱-蒸发光散射检测法测定草石蚕根茎中的水苏糖[J].分析化学,2003,31(12):1409-1412
[6]朱建华,杨晓泉.反相液相色谱法同时测定大豆制品中的功能性低聚糖-水苏糖和棉籽糖[J].粮油加工与食品机械,2005(11):75-76
[7]熊涛,刘剑飞,宋苏华.发酵豆粕分泌蛋白酶的兼性厌氧型菌株的筛选与鉴定[J].食品科学,2011,32(9):193-197
[8]Hou A,Chen P,Shi A,et al.Sugar variation in soybean seed assessed with a rapid extraction and quantification method[J].International Journal of Agronmy,2009(11):1-8
[9]王晓岩,郝再彬,邱丽娟.HPLC法快速检测大豆籽粒中大豆低聚糖的含量[J].食品科技,2010,35(7):287-290
[10]Cavazzoni V,Adami A,Craveri R.α-Galactosidase from the yeast Candida javanica[J].Applied Microbiology and Biotechnology,1987,26(6):555-559
[11]Doblado R,Frias J,Muñoz R,etal.Fermentation of Vigna sinensis var.carilla flours by naturalmicroflora and Lactobacillus species[J].Journal of Food Protection,2003,66(12):2313-2320
[12]Mital B K,Steinkraus K H.Utilisation of oligosaccharides by lactic acid bacteria during fermentation of soy milk[J].Journal of Food Science,1975,40(1):114-118
[13]樊春光,尹清强,王鹏,等.发酵豆粕的生产现状及产品质量评定研究[J].江西农业学报,2012,24(7):156-159.
——全棉籽的加工与利用

