肝细胞癌和慢性乙型肝炎患者血清sFRP-1和β-catenin水平及临床意义*
李 蕾,薛如意,沈锡中
·肝癌·
肝细胞癌和慢性乙型肝炎患者血清sFRP-1和β-catenin水平及临床意义*
李 蕾,薛如意,沈锡中
目的探讨肝细胞癌(hepatocellular carcinoma,HCC)和慢性乙型肝炎(chronic hepatitis B,CHB)患者血清分泌型卷曲相关蛋白-1(secreted frizzled-related proteins,sFRP-1)和β-catenin水平及临床意义。方法采用ELISA法检测36例HCC、36例CHB和36例正常人血清sFRP-1和β-catenin水平,应用Spearman相关分析,分析血清sFRP-1和β-catenin水平与年龄、丙氨酸氨基转移酶(ALT)、白蛋白和总胆红素等的相关性。结果HCC和CHB患者血清sFRP-1水平分别为(1136.28±332.43)pg/ml和(1194.53±156.84)pg/ml,均显著低于正常人[(1477.26±563.12)pg/ml,P<0.05];HCC患者血清β-catenin水平为(527.2±20.9)pg/ml,显著高于正常人和CHB患者[分别为(369.8±21.5)pg/ml和(374.0±8.3)pg/ml,P<0.05];HCC和CHB患者血清sFRP-1和β-catenin水平与年龄、ALT、白蛋白、总胆红素无显著相关性。结论肝细胞癌和慢性乙型肝炎患者血清sFRP-1降低,而肝细胞癌患者血清β-catenin水平升高。
肝细胞癌;慢性乙型肝炎;分泌型卷曲相关蛋白-1;β-catenin
Wnt/β-catenin信号通路是细胞发育和生长调节的一个关键途径,β-catenin是该通路的效应分子,该通路异常激活可以导致肿瘤和纤维增生等疾病的发生[1]。已有研究证实,经典与非经典的Wnt信号途径均参与肝纤维化的形成[2,3],而在20%~90%HCC患者显示经典的Wnt/β-Catenin信号通路被持续激活[4]。Wnt信号通路抑制因子分泌型卷曲相关蛋白-1(secreted frizzled-related protein 1,sFRP-1)作为Wnt信号通路的一个负调节蛋白,在肿瘤形成及调控细胞调亡等方面亦发挥重要作用[5]。目前sFRP-1/β-catenin通路在慢性乙型肝炎及肝细胞癌发病中的作用机制仍不清楚。本研究检测了CHB和HCC患者血清sFRP-1和β-catenin水平,并分析其与CHB和HCC常见实验室指标的关系,以探讨其判断肝脏疾病进展的临床价值。
1 资料与方法
1.1 病例选择自2007年1月~2010年12月在我院门诊及住院的HCC患者36例,均为男性,年龄30~60岁,平均年龄(43±14)岁,经临床、影像学检查及术后病理学检查证实。CHB患者36例[(均为男性,年龄30~60岁,平均年龄(40±15)岁]。CHB诊断符合慢性乙型肝炎防治指南(2010年版)[6]标准。以HBsAg阴性、肝肾功能正常的36例男性健康体检者为对照组[年龄30~60岁,平均年龄(36±12)岁]。被研究者签署知情同意书,本研究经中山医院伦理委员会备案。
1.2 血清sFRP-1和β-catenin水平检测采用ELISA法(上海武昊经贸有限公司提供试剂,美国USCNK公司生产)。以Bio-rad比色仪在450nm处测吸光度值,参照标准曲线计算其浓度值。
2 结果
2.1 肝功能情况3组人群主要肝功能指标见表1。
表1 3组人群主要肝功能指标(±s)比较
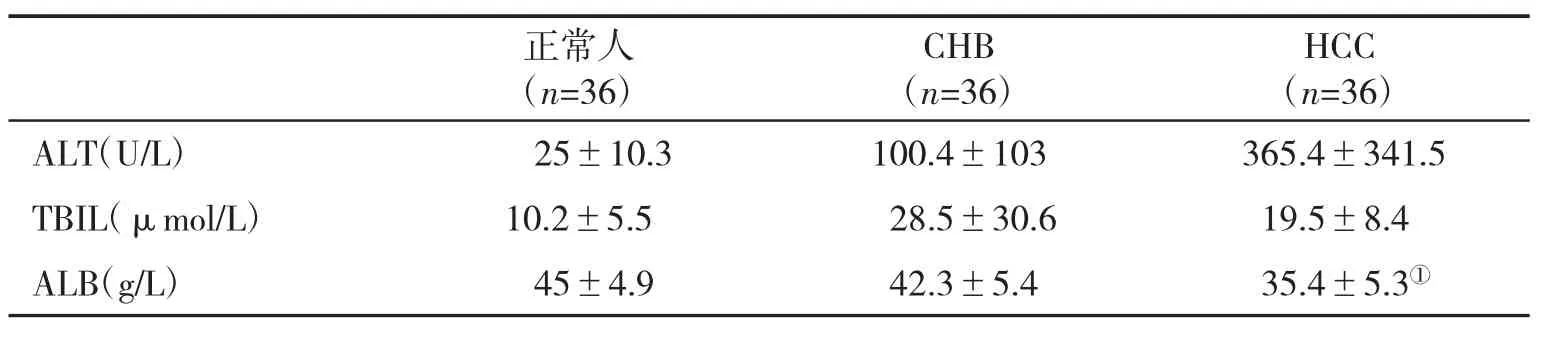
表1 3组人群主要肝功能指标(±s)比较
与另两组比,①P<0.01
2.2 肝病患者血清sFRP-1及β-catenin的水平根据标准曲线,通过对OD值的换算得出各组别sFRP-1、β-catenin的表达水平。HCC组和CHB组的血清sFRP-1显著低于正常组(P<0.05),而CHB组和HCC组血清sFRP-1水平无显著差异;HCC组中β-catenin水平显著高于正常组及CHB组(表2)。
表2 3组人群血清sFRP-1和β-catenin水平(pg/mL,±s)比较

表2 3组人群血清sFRP-1和β-catenin水平(pg/mL,±s)比较
与正常人比,①P<0.05;与CHB比,②P<0.05
2.3 血清sFRP-1和β-catenin水平与其他指标的相关性分析在CHB和HCC患者,未发现血清sFRP-1或β-catenin水平与年龄、ALT、白蛋白、总胆红素具有相关性(资料未列出)。
3 讨论
近年来,研究发现Wnt信号通路在细胞转运、细胞凋亡及生物发育等生命过程中发挥重要作用[7,8],其异常活化与多种人类疾病及肿瘤[9,10]的发生密切相关,已经成为肿瘤发病机制研究的热点。同时,在肝纤维化等慢性肝病及肝癌发病中也发现Wnt信号异常持续激活,提示该途径在肝脏病理生理过程中有着重要的作用[11]。
越来越多的研究表明,分泌型Wnt受体拮抗剂sFRPs家族成员在Wnt信号传导中发挥重要作用,其可以在细胞外阻断异常的Wnt信号通路,从而抑制肿瘤细胞的增殖和诱导肿瘤细胞凋亡[12]。sFRPS通过竞争性结合Wnt配体,阻止Wnt信号传导入细胞,是Wnt信号通路的负调控因子,在肝脏肿瘤的发生发展中也起到了重要的作用。Shih YL等[13]发现在原发性肝癌组织SFRP-1表达广泛下调,其启动子在肝癌组织中甲基化程度明显高于肝硬化、肝炎及正常肝组织,认为sFRP-1可能通过经典wnt信号途径抑制肝肿瘤细胞的生长。
β-catenin是连环蛋白家族中的一员,具有介导细胞黏附及信号转导的双重功能。β-catenin是Wnt通路的效应分子,其可通过核膜进入到细胞核内,与转录因子Tcf/Lef结合,激活Wnt途径靶基因,如c-myc和cyclin D1,调节细胞的增殖,参与肿瘤的形成[14]。Sangkhathat等[15]通过在肝癌细胞内转染siRNAs引起细胞内β-catenin表达下降,从而达到抑制肝癌细胞增殖的作用。
肝纤维化是指肝脏内弥漫性的、过量的细胞外基质沉积,是许多慢性肝病的共同病理学过程。肝星状细胞(hepatic stellate cell,HSC)激活是肝纤维化发生的中心环节。近年来一些研究开始关注经典的Wnt信号通路在HSC激活过程中的作用。Myung等[2]研究发现sFRP可抑制HSC激活并抑制Collagen α1和α-SMA生成。葛文松等[16]研究发现,阻断Wnt/β-Catenin信号通路可抑制HSC增殖,促进其凋亡,减少胶原分泌。
本研究采用ELISA法检测了HCC和CHB患者血清sFRP-1和β-Catenin水平的变化,发现HCC患者血清sFRP-1显著低于正常人,与既往研究相符,提示sFRP-1在肝肿瘤发生中发挥抑癌作用,并可能在肝肿瘤组织中发生表观遗传学改变而表达降低或缺失,其具体分子机制有待进一步研究。CHB患者血清sFRP-1亦显著低于正常人,其是否参与了HSC激活及凋亡等机制尚待进一步研究。本研究亦发现HCC组织存在β-catenin高表达,提示β-catenin的异常积聚可能在肝癌发生中起重要作用。随着Wnt信号通路拮抗剂sFRP1在肝癌组织中表达的逐渐减弱,β-catenin的异常表达增高,表明sFRP1的低表达可能是导致β-catenin异常高表达的因素之一。
Wnt传导通路与肝癌的发生、发展密切相关。信号抑制蛋白sFRP1的表达减弱可能是导致β-catenin在细胞质和细胞核内积聚以及Wnt信号活化的原因之一,其潜在的临床价值值得深入研究。关于对经典Wnt信号通路在肝脏病发病中的作用研究,尚有许多基础机制需要阐明,有许多问题仍需要探讨。
[1]Surendran K,Mccaul SP,Simon TC.Arole for Wnt-4 in renal fibrosis.Am J Physiol Renal Physical,2002,282(3):431-441.
[2]Myung SJ,Yoon JH,Gwak GY,et al.Wnt signaling enhances the activation and survival of human hepatic stellate cells. FEBS Lett,2007,581:2954-2958.
[3]Jiang F,Parsons CJ,Stefanovic B.Gene expression profile of quiescent and activated rat hepatic stellate cells implicates Wntsignalingpathwayinactivation.JHepatol,2006,45:401-409.
[4]Ban KC,Singh H,Krishnan R,et al.GSK-3β phosphorylation and alteration of β-catenin in hepatocellular carcinoma.Cancer Lett,2003,199:201-208.
[5]Taylor MD,Rutka JT.The SFRP family of WNT inhibitors function as noveltumorsuppressorgenes epigeneticallysilenced in medulloblastoma.Oncogene,2010,29:3017-3024.
[6]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[7]Muroyama Y,Fujihara M,Ikeya M,et al.Wnt signaling plays an essential role in neuronal specification of the dorsal spinal cord.Genes Dev,2002,16:548-553.
[8]Peterson CP,Reddien PW.Wnt signaling and the polarity of the primary body axis.Cell,2009,139:1056-1068.
[9]Gregory MA,Phang TL,Neviani P,et al.Wnt/Ca2+/NFAT signaling maintains survival of Ph+leukemia cells upon inhibition of Bcr-Abl.Cancer Cell,2010,18:74-87.
[10]Vijayakumar S,Liu G,Rus IA,et al.High-frequency canonical Wnt activation in multiple sarcoma subtypes drives proliferation through a TCF/β-catenin target gene,CDC25A.Cancer Cell,2011,19:601-612.
[11]Thompson MD,Monga SP.WNT/β-catenin signaling in liver health and disease.Hepatology,2007,45(5):1298-305.
[12]Kongkham PN,Northcott PA,Croul SE,et al.The SFRP family of WNT inhibitors function as novel tumor suppressor genes epigenetically silenced in medulloblastoma.Oncogene,2010,29:3017-3024.
[13]Shih YL,Hsieh CB,Lai HC,et al.SFRP1 suppressed hepatoma cells growth through Wnt canonical signaling pathway.Int J Cancer,2007,121(5):1028-1035.
[14]Lopez-Knowles E,Zardawi SJ.Cytoplasmic localization of βcatenin is a marker of poor outcome in breast cancer patients. Cancer Epi Bio Pre,2010,19(1):301-309.
[15]Sangkhathat S,Kusafuka T,Miao JY,et al.In vitro RNA interference against β-catenin inhibits the proliferation of pediatric hepatic tumors.Int J Oncol,2006,28(3):715-722.
[16]葛文松,吴建新,范建高,等.siRNA沉默β-Catenin对肝星状细胞增殖和凋亡的影响.实用肝脏病杂志,2011,14(2):91-94.
(收稿:2013-09-10)
(校对:陈从新)
Serum levels and clinical significance of sFRP-1 and β-catenin in patients with hepatocellular carcinoma and chronic hepatitis B
Li Lei,Xue Ruyi,Shen Xizhong.
Department of Gastroenterology,Zhongshan Hospital,Fudan University,Shanghai 200032,China
ObjectiveTo evaluate serum levels and clinical significance of secreted frizzled-related proteins(sFRP)-1 and β-catenin in patients with hepatocellular carcinoma(HCC)and chronic hepatitis B(CHB).Methods Serum levels of sFRP-1 and β-catenin in 36 patients with HCC,36 patients with CHB and 36 healthy persons were detected by ELISA;Spearman correlation analysis was used to estimate the relevance between sFRP-1,β-catenin and age,ALT,albumin,total bilirubin.ResultsThe serum levels of sFRP-1 in patients with HCC and CHB were(1136.28±332.43)pg/ml and(1194.53±156.84)pg/ml,respectively,both significantly higher than that in healthy persons[(1477.26±563.12)pg/ml,P<0.05];The serum level of β-catenin in patients with HCC was(527.2± 20.9)pg/ml,significantly higher than those in patients with CHB(374.0±8.3)pg/ml and normal persons(369.8± 21.5)pg/ml,P<0.05);No correlation was found between serum sFRP-1 or β-catenin levels with age,ALT,albumin,total bilirubin either in CHB or in HCC group.ConclusionThe serum sFRP-1 levels in patients with HCC and CHB decrease,while the serum β-catenin levels in patients with HCC increase.
Hepatocellular carcinoma;Hepatitis B;Secreted frizzled-related proteins-1;β-catenin
10.3969/j.issn.1672-5069.2014.01.019
国家临床重点专科建设项目经费资助
200032上海市复旦大学附属中山医院消化科
李蕾,女,42岁,医学博士,主治医师。主要从事肝纤维化及消化系统肿瘤的防治研究。E-mail:li.lei@zs-hospital.sh.cn
沈锡中,E-mail:shen.xizhong@zs-hospital.sh.cn

