脐血干细胞与骨髓干细胞联合移植治疗大鼠急性肝衰竭实验研究
王 波,唐晓鹏
·急性肝损伤·
脐血干细胞与骨髓干细胞联合移植治疗大鼠急性肝衰竭实验研究
王 波,唐晓鹏
目的观察脐血干细胞和自体骨髓干细胞共同移植治疗D-半乳糖苷所致急性肝衰竭大鼠的疗效。方法采集大鼠脐血和骨髓中单个核细胞,以促肝细胞生长因子和干细胞因子培养3w,采用免疫细胞化学法检测白蛋白和甲胎蛋白表达情况;以D-半乳糖苷腹腔注射法建立大鼠急性肝衰竭模型,24 h后每日经鼠尾静脉分别注入脐血干细胞,或骨髓干细胞,或混合的脐血干细胞和骨髓干细胞,对照组注射等量生理盐水,治疗7d,观察4组大鼠存活率、肝功能和肝组织病理学变化。结果在促肝细胞生长因子及干细胞因子的诱导下,脐血干细胞和骨髓干细胞可以在体外扩增并分化为肝细胞;脐血干细胞移植、骨髓干细胞移植和联合细胞移植组大鼠9d存活率分别为55.6%、50.0%和77.8%,均明显高于生理盐水对照组(16.7%,P<0.01);联合移植组存活率高于任何一种单纯干细胞移植(P<0.01)。结论脐血干细胞和骨髓干细胞移植对大鼠急性肝损伤有一定的保护作用,两者联合移植有协同作用。
急性肝衰竭;干细胞;细胞移植;脐血干细胞;骨髓干细胞
干细胞具有多向分化能力[1],在一定的条件下可以分化为心肌细胞、血细胞、神经元、肌肉细胞和肝细胞等[2]。脐血干细胞(Umbilical cord blood stem cell,UCBSC)和骨髓干细胞(Bone marrow stem cell,BMSC)在含重组人肝细胞生长因子等的培养基中可以表达白蛋白[3]。临床观察显示UCBSC移植治疗肝衰竭患者具有较好的疗效[4],但脐血中干细胞含量较少,不易种植,而成年BMSC增殖分化能力不如UCBSC强,且肝衰竭病人有严重的出血倾向,抵抗力减低,反复采集BMSC易导致出血和感染等并发症。在本实验,我们应用UCBSC与BMSC联合移植治疗肝衰竭大鼠,以增强其治疗效果,现报告如下。
1 材料与方法
1.1 动物与实验材料用于采集BMSC的健康雄性SD大鼠4只(体质量100~150 g,鼠龄3~4w)和用于采集UCBSC的出生1d内的新生SD大鼠10只,均由湖南省人民医院动物实验室提供。胎牛血清、DMEM高糖培养基为美国Gibco公司产品;干细胞因子(Stem cell factor,SCF)及促肝细胞生长因子(hepatocyte growth factor,HGF)均为美国Preprotech公司产品;PAS染色试剂盒为福州迈新生物技术开发有限公司产品;DAB显色试剂盒系北京中杉金桥产品;淋巴细胞分离液(Ficoll)系上海恒信化学试剂有限公司产品;鼠抗大鼠ALB多克隆抗体为北京中杉金桥产品,用前用抗体稀释液配成实验所需浓度(1∶200);鼠抗大鼠AFP多克隆抗体(即用型)系北京中杉金桥产品。
1.2 干细胞分离与培养将新生的大鼠断头,取血用于分离UCBSC;将成年大鼠处死,无菌条件下取出股骨,冲洗骨髓腔,先后用7号及4号针头过滤骨髓冲洗液,用于分离BMSC。在50 ml无菌离心管中加入淋巴细胞分离液(比重1.077)15 ml,沿管壁缓慢加入新生鼠血液或成年鼠骨髓细胞(用DMEM按1∶1稀释)30ml。离心收集离心管中白膜层细胞(单个核细胞)。将细胞稀释至1×106个/ml。置含15%胎牛血清、HGF10ng/ml、SCF20ng/ml、谷氨酰氨2 mmol/l、青霉素100 U/ml、链霉素100 μg/ml的DMEM高糖培养基,37℃、5%CO2培养箱内培养。原代细胞生长至30d左右,生长良好的细胞可见集落形成并开始融合,当融合达80%时,用新鲜配制的0.25%胰酶消化细胞进行传代。
1.3 细胞白蛋白及甲胎蛋白表达的检测在细胞培养至21d时,用0.25%胰蛋白酶消化,取UCBSC或BMSC,将其接种到用多聚赖氨酸包被的盖玻片上,行免疫组化检测。用4%多聚甲醛固定15~20 min,PBS冲洗1次/3min×3次。加过氧化物酶阻断液在室温下作用10 min,PBS冲洗1次/3min×3次。室温下加正常非免疫动物血清封闭10 min。甩弃多余的血清,加抗AFP(即用型)或抗ALB(1∶200),4℃过夜。PBS冲洗1次/3min×3次加生物素标记的抗鼠IgG抗体,室温下孵育15 min,DAB显色,显微镜下观察。自来水冲洗,终止显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.4 细胞糖原染色采用PAS染色,取培养至第21天的细胞进行细胞涂片,用95%酒精固定。1%高碘酸水溶液浸10~15 min,蒸馏水洗数次;放入Schiff氏液作用30 min,自来水充分冲洗约5 min,复染,用Harris氏苏木素复染1~3 min,或用2%甲绿复染15 min,使核着色,自来水冲洗,晾干。在显微镜下观察。
1.5 细胞移植治疗急性肝衰竭大鼠取D-gal,按1.4g· kg-1给80只雄性大鼠(体质量100~150 g,鼠龄3~4w)行一次性腹腔注射,建立大鼠急性肝衰竭模型。建模24h内大鼠死亡8只。将存活的72只大鼠随机分成4组,每组18只。取UCBSC、BMSC或混合后的UCBSC和BMSC(各50%)106细胞,加入NS 0.8 ml,尾静脉注射,1次/d,×7d。在建模后第1、3、6和9 d取血,检测肝功能,分批取肝组织行病理学检查。
1.6 统计学分析采用SPSS16.0统计软件包,各组生化数据用(±s)表示,组间均数比较采用ANOVA法,P<0.05被认为差异具有显著性。
2 结果
2.1 脐血单个核细胞培养情况原代培养的细胞生长缓慢,大约2w后开始形成集落,4w左右细胞生长达大约80%融合。消化传代后的细胞呈梭形、圆形、类圆形及多边形。
2.2 BMSC培养情况培养72h后,贴壁生长的BMSC数量稀少,散在,多呈细而小梭形。2w左右细胞达80%融合,呈均一的长梭形。传代培养的BMSC未见明显的形态改变。
2.3 培养细胞ALB、AFP表达和糖原颗粒情况UCBSC和成年BMSC在HGF和SCF的诱导下,细胞浆ALB和AFP阳性(图1~4),并且在细胞胞浆中出现了大小不等的红染糖原颗粒(图5、6),推测这些细胞极有可能就是肝细胞。
2.4 各组大鼠成活情况比较见表1。
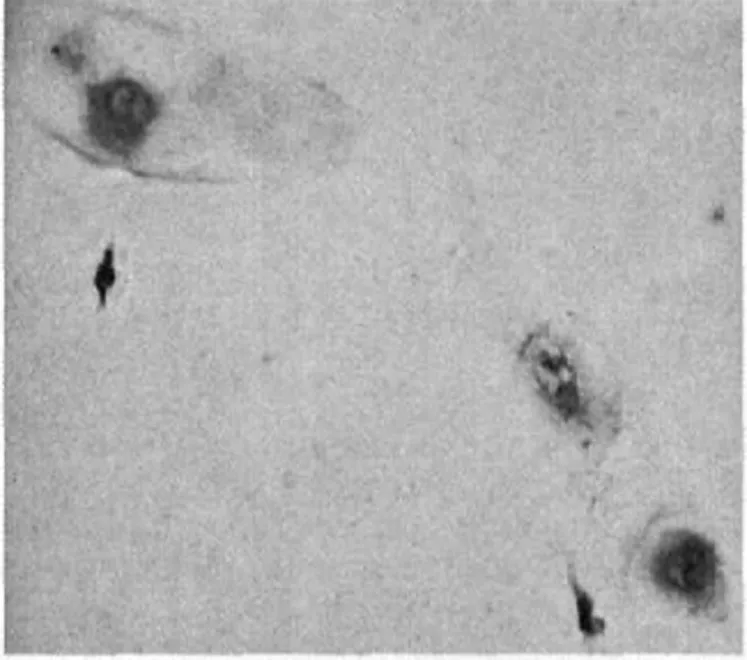
图1 UCBSC表达ALB在UCBSC中可见ALB表达(免疫组化染色,400×)

图2 BMSC表达ALB在BMSC中可见ALB表达(免疫组化染色,200×)

图3 UCBSC表达AFP在UCBSC中可见AFP表达(免疫组化染色,100×)
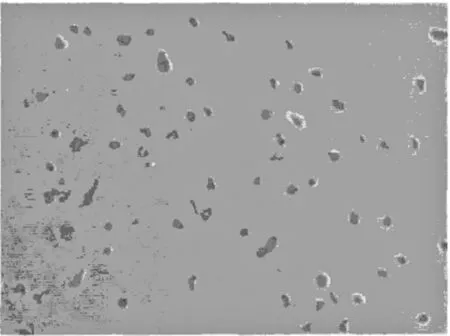
图4 BMSC表达AFP在BMSC中可见AFP表达(免疫组化染色,100×)
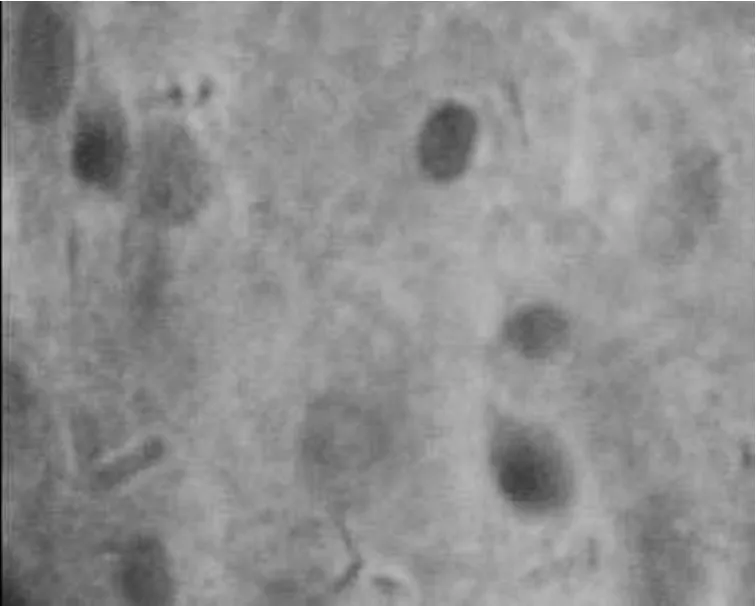
图5 UCBSC糖原颗粒阳性在培养第21 d,UCBSC中可见糖原颗粒(PAS染色,400×)

图6 BMSC糖原颗粒阳性在培养第21 d,BMSC中可见糖原颗粒(PAS染色,400×)

表1 各组大鼠成活率(%)的比较
2.5 大鼠肝功能变化的比较见表2。
表2 不同治疗对大鼠肝功能(±s)的影响

表2 不同治疗对大鼠肝功能(±s)的影响
与生理盐水组比,①P<0.05;与UCBSC或BMSC组比,②P<0.05
2.6 各组大鼠肝组织病理学改变比较见图7~9。
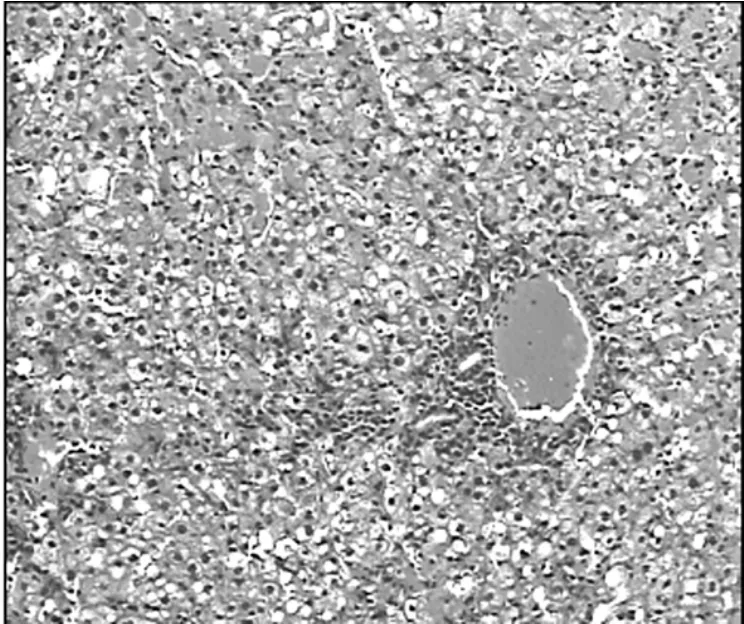
图7 BMSC治疗后7 d肝组织病理学表现(HE,100×)
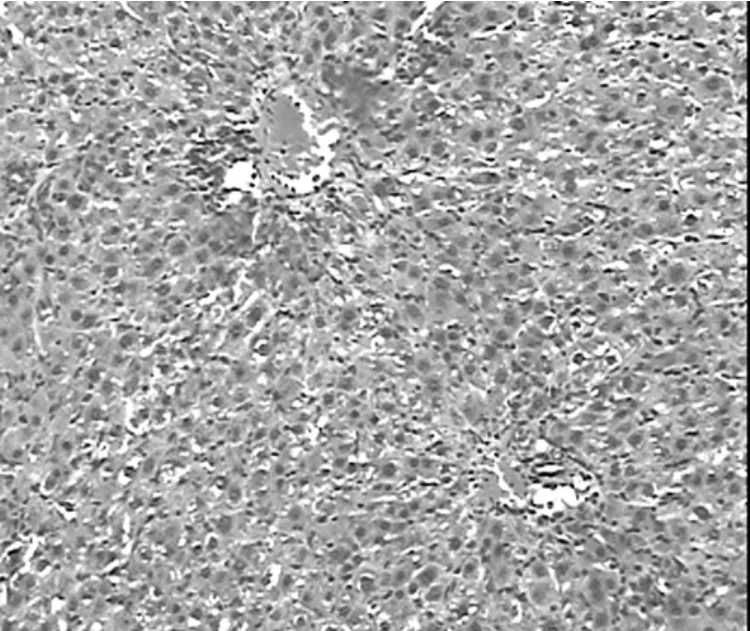
图8 UCBSC治疗后7 d肝组织病理学表现(HE,100×)

图9 UCBSC与BMSC联合移植治疗后7 d肝组织病理学表现(HE,100×)
3 讨论
脐带血具有某些生物学特性,其中UCBSC含有造血干细胞/祖细胞,且原始造血细胞的数量以及增殖分化能力、体外集落形成能力、被刺激后进入细胞周期的速度和自泌生长因子的能力等均强于骨髓及外周血干细胞。早在1974年就发现脐带血中含有造血干细胞。造血干细胞有两个基本特性:(1)高度的自我更新能力或自我复制能力,这样可以保持干细胞数量恒定;(2)进一步分化为各系祖细胞及成熟血细胞的能力,这是造血干细胞生命意义的体现。
脐血中T淋巴细胞比较原始,缺乏T淋巴细胞活化P生长因子,抗原表达弱而不充分,自然杀伤细胞(NK)活性也较弱。因此,淋巴细胞的细胞毒性较低,免疫系统很不成熟,发生排斥反应少,在一般情况下不会引起严重的抗宿主反应。脐血中含有间充质干细胞(mesenchymal stem cells,MSCs),具有多向分化的能力[5]。Kakinuma[3]等在体外用FGF-1、FGF-2、LIF、SCF等细胞因子诱导脐带血细胞向肝细胞分化,发现诱导21d后,50%细胞开始表达白蛋白,而且这种细胞在体外具有增殖能力。Aurich等[6]将UCBSC与生长因子共同培养至21d后证实了其糖原存储和尿素合成等体外功能标志,将培养的肝样细胞移植入免疫衰竭的小鼠肝内,发现细胞继续表达糖原存储、白蛋白和人肝细胞特殊抗原,提示UCBSC体外培养可分化为肝细胞;在体内移植后,继续保持肝细胞特性。Danet[7]等首次将从脐血中分离、纯化的500~1500 Lin-CD38-CD34+CiqRP+或7000~8000个Lin-CD38-CD34-CiqRP+细胞移植给亚致死剂量放射线照射的免疫缺陷鼠,在8~12 w后,可以在鼠肝脏中检测到人肝细胞存在,证实HUCBSC可以在免疫缺陷大鼠体内分化为肝细胞。
BMSC在特定条件下能分化成为各种血液及骨髓细胞,主要有造血干细胞、间充质干细胞和骨髓源肝干细胞。大量研究证明,这三类细胞都具有向肝细胞分化的潜能。多项研究相继证实在骨髓移植和肝脏移植病人的肝脏中有来源于骨髓的肝细胞[8,9]。体外培养和转化实验表明,骨髓间充质细胞在向肝细胞分化过程中,其形态发生渐进性变化,由成纤维样细胞逐渐转变为上皮样,越来越接近肝细胞的形态特征,说明在诱导条件下骨髓间质细胞已发生了本质的变化,已具有幼稚肝细胞的特征,已开始向肝细胞分化[10]。大量研究表明动物和人的骨髓中存在多向分化潜能的干细胞,这些干细胞在体内外均可诱导分化为功能完备的肝细胞,经人为诱导培养骨髓间充质干细胞在体外能定向分化为肝细胞样细胞,经诱导后的骨髓间充质干细胞上有了成熟肝细胞的糖原合成和分泌尿素的特征性功能,表明骨髓间充质干细胞可作为肝细胞移植的新型种子细胞[11,12]。Oh等[13]发现HGF通过c-Met受体诱导成体骨髓细胞表达ALB和AFP。Theise等报道[14]骨髓细胞在体内不但能分化为肝细胞,而且能分化为胆管细胞。季凤清[15]等报道人脐血非造血干细胞无论原代、传代细胞、分化细胞及IFN-γ处理的细胞,其免疫原性均较弱,不易产生排异反应。UCBSC分化及增殖能力均较强。
[1]Laurson J,Selden C,Hodgson HJ.Hepatocyte progenitors in man and in rodents—multiple path ways,multiple candidates. Int J Exp Pathol,2005,86(1):1-18.
[2]Navarro-MonteroO,Romero-MoyaD,MontesR,etal. Intrahepatic transplantation of cord blood CD34+cells into newborn NOD/SCID-IL2Rγ(null)mice allows efficient multiorganandmulti-lineagehematopoieticengraftmentwithout accessory cells.Clin Immunol,2012,145(2):89-91.
[3]Kakinuma S,Tanaka Y,Chinzei R,et al.Human umbilical cord blood as a source of transplantable hepatic progenitor cells. Stem Cells,2003,21:217-227.
[4]Tang XP,Yang X,Tan H,et al.Clinical and experimental study on therapeutic effect of umbilical cord blood transplantation on severe viral hepatitis.World J Gastroenterol,2003,9:1999-2003.
[5]LeeHJ,JungJ,ChoKJ,etal.Comparisonofinvitro hepatogenic differentiation potential between various placentaderived stem cells and other adult stem cells as an alternative source of functional hepatocytes.Differentiation,2012,84(3):223-231.
[6]Aurich I,Mueller LP,Aurich H,et al.Functional integration of hepatocytes derived from human mesenchymal stem cells into mouse livers.Gut,2007,56(3):405-415.
[7]Danet GH,Luongo JL,Bulter G,et al.CiqRp defines a new human stem cell population with hematopoitic and hepatic potential.Proc Natl Acad Sci USA,2002,99(16):10441-10445.
[8]AlisonMR,PoulsomR,JefferyR,etal.Hepatoeytesfrom nonhepatie adult stem cells.Nature,2000,406:257-261.
[9]Theise ND,Nimmakayalu M,Gardner R,et al.Liver from bone marrow in humans.Hepatology,2000,32(1):11-16.
[10]Theise ND,Badve S,Saxane R,et al.Derivation of hepatocytes frombonemarrowcellsinmiceafterradiationinduced myelablation.Hepatology,2000,31(1):235-240.
[11]Kang XQ.Fibroblast growth factor-4 and hepatocyte growth factor induce differentiation of human umbilical cord bloodderivedmesenchymalstemcellsintohepatocytes.WorldJ Gastroenterol,2005,11(47),7461-7465.
[12]李文晰,段芳龄.人骨髓单个核细胞向肝细胞诱导分化的体外研究.胃肠病学和肝脏病学杂志,2004,12(2):144-147.
[13]Oh SH,Miyazaki M,Kouchi H,et al.Hepatocyte growth factor induces differentiation of adult rat bone marrow cells into a hepatocytelineageinvitro.BiochemBiophysResCommun,2000,279:500-504.
[14]Theise ND,Badve S,Saxena R,et al.Derivation of hepatocytes frombonemorrowcellsinmiceafterradiation-induced myeloablation.Hepatology,2000,31:235-224.
[15]季凤清,王屹,孙海梅,等.人脐血非造血干细胞免疫原性的实验研究.解剖学报,2008,39(1):55-59.
(收稿:2013-05-08)
(校对:陈从新)
Experimental study of transplantations of umbilical cord blood stem cells combined with bone marrow stem cells for rats with acute liver failure
Wang Bo,Tang Xiaopeng.
Liver Diseases Center,Second Xiangya Hospital,Central South University,Changsha 410011,China
ObjectiveTo observe the therapeutic effects of co-transplanted umbilical cord blood stem cells and bone marrow stem cells for rats with acute liver failure induced by D-galactose.MethodsMononuclear cells isolated from umbilical cord blood and bone marrow of rats were cultured in medium containing hepatocyte growth factor(HGF)and stem cell factor(SCF)for 3 weeks,and the expression of hepatocyte markers,such as AFP and ALB,were detected by immunocytochemistry;A rat model of acute liver failure was established by D-galactose injection(1.4 g.kg-1,intraperitoneally)for 24 h.Rats with acute liver failure were subjected to transplantation of bone marrow stem cells,umbilical cord blood stem cells,and umbilical cord blood stem cell mixed with bone marrow stem cell,or an equal amount of saline per day for seven days.The survival rates,liver function and pathological changes in liver were studied.ResultsBone marrow stem cells and umbilical cord blood stem cells were successfully proliferated anddifferentiated into hepatocytes in vitro by stimulation of HGF and SCF.The 9-day survival rates of rats with acute liver failure in umbilical cord blood stem cell,bone marrow stem cell and mixed stem cell transplantation group were 55.6%,50.0%and 77.8%,respectively,all of which were markedly higher than that in rats treated with saline(16.7%,P<0.01);The 9-day survival rate of rats in mixed cell transplantation group was significantly higher than that of rats in umbilical cord blood stem cell or bone marrow stem cell alone(P<0.01). ConclusionsBone marrow stem cell and umbilical cord blood stem cell transplantation improve liver function of rats with acute liver failure,and combinational transplantation of these two cells is efficient.
Acute liver failure;Stem cell;Cell transplantation;Bone marrow stem cell;Umbilical cord blood stem cell;Rats
10.3969/j.issn.1672-5069.2014.01.017
410011长沙市中南大学湘雅二医院肝病中心/肝病研究所
王波,男,30岁,医学硕士,医师
唐晓鹏,E-mail:xiaopeng1959@163.com

