发形霞水母触手提取物的蛋白稳定性及其溶血活性
常银龙,肖良,郑杰民,王倩倩,张黎明(第二军医大学海医系海洋生物技术教研室,上海 200433)
·论著·
发形霞水母触手提取物的蛋白稳定性及其溶血活性
常银龙,肖良,郑杰民,王倩倩,张黎明(第二军医大学海医系海洋生物技术教研室,上海 200433)
目的 探讨不同环境因素和处理方法对发形霞水母(Cyanea capillata)触手提取物(tentacle extract,TE)蛋白稳定性及其溶血活性的影响。方法结合蛋白浓度测定、溶血活性检测和SDS-PAGE分析等方法研究不同环境因素和处理方法对TE蛋白稳定性及其溶血活性的影响。结果TE溶血活性呈明显的剂量依赖关系,其半数溶血分数HU50=226μg/ml; 40℃水浴1 h,能去除TE中大量杂蛋白,但仍保持显著溶血活性;TE在4℃放置28 d,其溶血活性保持稳定,25℃下3 d内其溶血活性变化不明显;pH值对TE溶血活性的影响呈钟形曲线,在pH 6.0~11.0之间活性相对稳定,pH 8.0是TE保持溶血活性的最优pH条件;不同缓冲液对TE稳定性及其溶血活性影响显著,浓度大于26%的硫酸铵溶液对TE溶血蛋白具有良好的盐析作用。结论40℃水浴1 h预处理可显著减少TE中非活性蛋白组分,并降低样品黏性;4℃和pH 8.0是TE保持蛋白稳定性和溶血活性的最适条件;浓度大于26%的硫酸铵盐析有利于溶血蛋白组分富集。
发形霞水母;触手提取物;稳定性;溶血活性
水母属刺胞动物门,是一类低等的海洋浮游动物,广泛分布于全球各海域。水母蜇伤是最常见的海洋生物伤,可以产生多种局部或全身症状,全世界每年被水母蜇伤的患者数以万计,致死者亦不在少数,给滨海旅游、近海渔业和水下作业带来了极大的困扰[1,2]。研究表明,水母毒素是结构新颖独特的肽类毒素,具有溶血活性、酶活性、神经毒性、皮肤坏死和肌肉毒性、肝脏毒性以及心脏毒性等多种生物学活性[1,3-5]。由于对热不稳定和易与分离介质黏附或自身聚集,水母毒素的分离纯化进展缓慢,明显落后于其他常见的生物毒素。
水母毒素粗毒样品主要有触手提取物(tentacle extract,TE)和刺丝囊毒素(crude nematocyst venom,cNV)两种,其中TE制备简便,可大量获取,且活性保持良好,这是其有利于毒素分离纯化的一面;但另一方面,TE含有大量非毒性的组织蛋白,大大增加了分离纯化的复杂程度。我们试图通过改变各种理化参数,去除粗毒样品TE中的非毒性组织蛋白,并降低其黏性,以利于后续分离纯化工作的开展。本研究以容易检测的溶血活性为追踪手段,结合蛋白浓度测定、SDS-PAGE分析等方法,改变样品所处的理化条件,以观察发形霞水母(Cyanea capillata)TE的蛋白稳定性,优化其保存和使用条件,为活性蛋白的分离纯化提供基础数据资料。
1 材料与方法
1.1 发形霞水母触手提取物的制备新鲜发形霞水母(由集美大学水产学院洪惠馨教授鉴定)样品于2011年6月采自浙江省三门湾。TE的制备方法见文献[6],Bradford法测定TE的蛋白浓度[7]。
1.2 溶血活性测定和SDS-PAGE分析SD大鼠(200~250 g),用25%乌拉坦腹腔注射麻醉(1.2 g/kg)。抽取大鼠尾静脉血,等体积50 U肝素生理盐水抗凝,用PBS洗涤数次,每次洗涤后1 000×g离心5 min,弃上清液,直至上清液清亮为止。红细胞与PBS按体积比1∶200(0.5%)稀释成红细胞悬液。反应总体积0.2 ml,红细胞悬液0.1 ml,加入0.1 ml TE(或处理后TE)样品,另设加0.1 ml PBS的阴性对照组与加0.1 ml 0.2 mg/ml SDS的阳性对照组。37℃水浴30min,1 000×g离心5min,吸取上清液150μl用酶标仪检测A415,计算溶血分数。溶血分数=(样品管A415-阴性对照A415)/(阳性对照A415-阴性对照A415)×100%。
将TE及其处理后的样品、蛋白标准Marker进行SDS-PAGE电泳,凝胶分别采用5%积层胶和12%分离胶,单孔上样20μl,积层胶和分离胶电压分别采用80 V和160 V,考马斯亮蓝快速染色法染色,0.25 mol/L KCl溶液脱色。
1.3 不同环境因素和处理方法对TE溶血活性的影响
1.3.1 TE溶血活性的剂量反应关系TE浓度梯度为0.043、0.086、0.172、0.257、0.343、0.515、0.687、0. 858、1.030、1.202、1.373、1.545和1.717 mg/ml,测定不同浓度TE样品的溶血活性。
1.3.2 温度对TE蛋白稳定性及其溶血活性的影响
将TE分别在4、25、40、60、80以及100℃条件下放置60min,然后10 000×g离心10min,收集上清液,检测上清液的蛋白浓度、溶血活性并进行SDSPAGE分析。
1.3.3 放置时间对TE蛋白稳定性及其溶血活性的影响在4℃和25℃条件下,将TE分别放置1、2、4、6、12、24 h及2、3、7、14、21和28 d,然后10 000×g离心10min,收集上清液,检测上清液的蛋白浓度、溶血活性并进行SDS-PAGE分析。
1.3.4 pH值对TE蛋白稳定性及其溶血活性的影响将等量的TE分别在不同pH值(2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0)的PBS中透析10 h,然后10 000×g离心10 min,收集上清液,检测上清液的蛋白浓度、溶血活性并进行SDSPAGE分析。
1.3.5 缓冲液对TE蛋白稳定性及其溶血活性的影响将等量的TE分别用20 mmol/L Tris-HCl(pH 8.0)、20mmol/L Na2HPO4(pH 8.0)、20 mmol/L HAc (pH 6.0)、20 mmol/L NH4Ac(pH 6.0)、50 mmol/L Na2HPO4+1.5 mol/L(NH4)2SO4(pH 7.0)、H2O等6种不同缓冲液透析24 h,然后10 000×g离心10min,收集上清液(上清液一)、沉淀,向沉淀加入等量PBS溶液,用移液器反复吹吸、混匀,所得样品用PBS再透
析24 h,10 000×g离心10 min,收集上清液(上清液二),沉淀再加入等量PBS重悬(沉淀复溶物),检测上清液一、上清液二和沉淀复溶物的蛋白浓度、溶血活性并进行SDS-PAGE分析。
1.3.6 硫酸铵溶液对TE蛋白稳定性及其溶血活性的影响将等量的TE分别用浓度为15%、20%、22%、24%、26%、28%、30%、35%的硫酸铵溶液透析24 h,10 000×g离心10 min,收集上清液,沉淀加入等量PBS重悬,再用PBS透析24 h后,检测上清液和沉淀复溶物的蛋白浓度、溶血活性并进行SDSPAGE分析。
1.4 数据分析所有数据均使用SPSS 18.0统计软件分析处理。计量资料以¯x±s表示,两组之间的比较采用t检验,多组之间在方差齐性的基础上采用单因素方差分析,不同时相点和组间差异的整体比较采用重复测量设计的方差分析。
2 结果
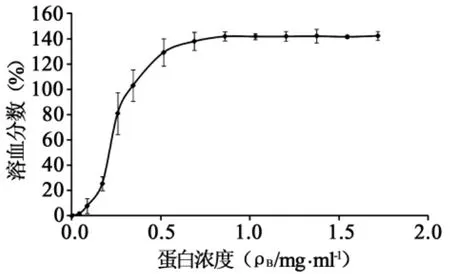
图1 TE溶血活性的剂量反应曲线
2.1 TE溶血活性的剂量反应关系发形霞水母TE对大鼠红细胞有明显溶血活性,且随着TE蛋白浓度增加而溶血分数逐渐增大,溶血活性剂量反应曲线呈“S”形(图1)。TE的半数溶血分数HU50为226μg/ml,TE蛋白浓度为515μg/ml时,溶血分数达到最大值。但由于检测样品溶血活性时,测定阳性对照SDS的吸光度值低于样品的吸光度值,因此,按溶血分数公式计算会得到溶血分数大于100%的数值。
2.2 温度对TE蛋白稳定性及其溶血活性的影响图2(A、B)是温度对TE蛋白稳定性及其溶血活性的影响。4、25℃条件下放置60 min对TE蛋白浓度和溶血活性无影响;40℃条件下放置60 min,TE蛋白浓度显著下降而溶血活性变化不大;60℃条件下放置60 min,TE蛋白浓度显著下降,其溶血活性也降低近一半;80、100℃条件下放置60 min,TE蛋白浓度下降幅度较40、60℃时小,但溶血活性显著降低甚至丧失。SDS-PAGE分析(图2C)表明,当温度高于40℃时,相对分子质量>72 000的蛋白条带较4、25℃时明显减少。

图2 温度对TE蛋白稳定性及其溶血活性的影响
2.3 放置时间对TE蛋白稳定性及其溶血活性的影响4℃条件下(图3A、B),随着放置时间的延长TE蛋白浓度逐渐降低,至28 d时,降低约20%,但TE溶血活性几乎保持不变,SDS-PAGE(图3C)显示其蛋白条带无明显变化。25℃条件下(图4A、B),随着放置时间的延长TE蛋白浓度逐渐降低,至28 d时,降低约69%,其溶血活性在3 d内保持不变,3 d后开始降低,至7 d时,TE基本无溶血活性,SDS-PAGE显示其蛋白条带的数量和密度7 d后都略有下降(基本同图3C)。
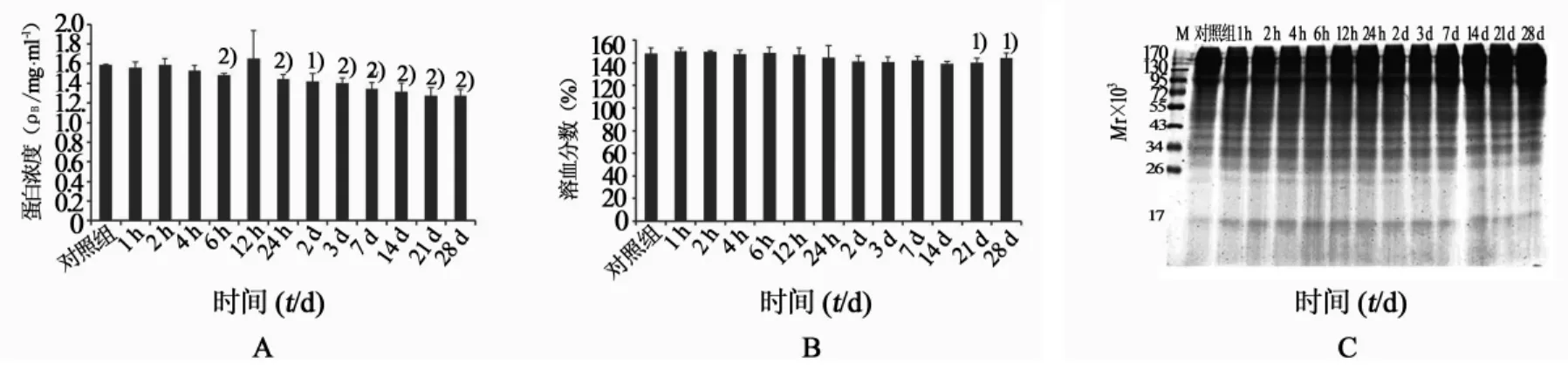
图3 4℃条件下放置不同时间对TE蛋白稳定性及其溶血活性的影响

图4 25℃条件下放置不同时间对TE蛋白稳定性及其溶血活性的影响
2.4 pH对TE蛋白稳定性及其溶血活性的影响
在不同pH值条件下(图5),TE的蛋白浓度与溶血活性均呈钟形曲线。pH 6.0~11.0范围内,TE的溶血活性变化不大,pH 2.0~5.0以及pH 12.0时溶血活性显著下降甚至完全丧失,pH 8.0是TE保持溶血活性的最优pH条件。强酸尤其是强碱性条件下,TE蛋白浓度显著下降。
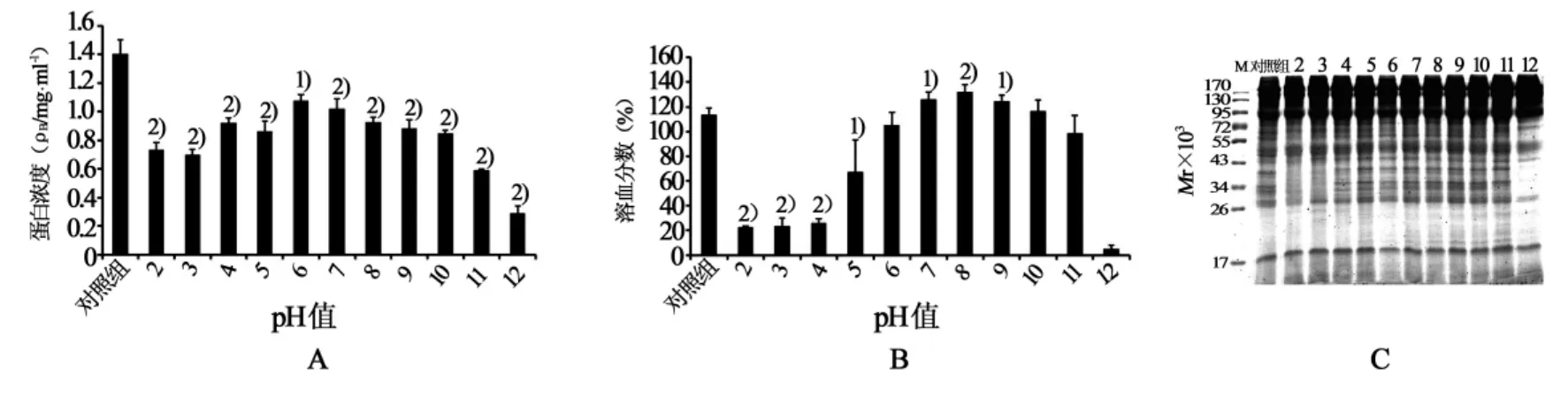
图5 pH值对TE蛋白稳定性及其溶血活性的影响
2.5 缓冲液对TE蛋白稳定性及其溶血活性的影响
图6(A、B)是缓冲液对TE上清液一蛋白稳定性及其溶血活性的影响。经6种缓冲液透析24 h后,TE蛋白浓度都明显下降,其中50 mmol/L Na2HPO4+1.5 mol/L(NH4)2SO4(pH 7.0)缓冲液透析后的TE浓度下降最为明显,蛋白浓度趋向于0(0.056 mg/ml)。各组缓冲液透析后的上清液一均无溶血活性。图6C为上清液一的SDS-PAGE图。

图6 不同缓冲液对TE蛋白稳定性及其溶血活性的影响
图6(D、E)是缓冲液对TE上清液二蛋白稳定性及其溶血活性的影响。经6种缓冲液透析、离心等处理获得的上清液二,它们的蛋白浓度范围为0.2~0.5mg/ml;溶血活性以20mmol/L Tris-HCl(pH 8.0)组最强,其次是50 mmol/L Na2HPO4+ 1.5mol/L(NH4)2SO4(pH 7.0)组,再次是20mmol/ L Na2HPO4(pH 8.0)组和20 mmol/L NH4Ac(pH 6. 0)组,但20 mmol/L HAc(pH 6.0)组几乎没有溶血活性。SDS-PAGE(图6F)显示,6组上清液二的高亮蛋白条带与TE基本一致。
图6(G、H)是缓冲液对TE沉淀复溶物蛋白稳定性及其溶血活性的影响。6组沉淀复溶物的蛋白浓度都<0.36 mg/m l;除50 mmol/L Na2HPO4+1. 5 mol/L(NH4)2SO4(pH 7.0)组外,其他沉淀复溶物都有很强的溶血活性;SDS-PAGE(图6I)显示,6组沉淀复溶物的高亮蛋白条带与TE分布一致,但条带总数明显减少。
2.6 硫酸铵溶液对TE蛋白稳定性及其溶血活性的影响图7(A、B)是硫酸铵溶液对TE上清液蛋白稳定性及其溶血活性的影响,硫酸铵浓度在15%~24%之间,上清液溶血活性随着硫酸铵浓度的增加而增强,当硫酸铵浓度达到26%时,上清液蛋白浓度突然显著下降,此时溶血活性也几乎消失。28%~35%硫酸铵溶液透析获得的上清液基本无蛋白条带。硫酸铵溶液对TE沉淀蛋白浓度和溶血活性的影响则正好与上清液相反(图7D、E、F)。综合分析可知,浓度>26%的硫酸铵溶液对TE中的溶血蛋白具有良好的盐析作用。
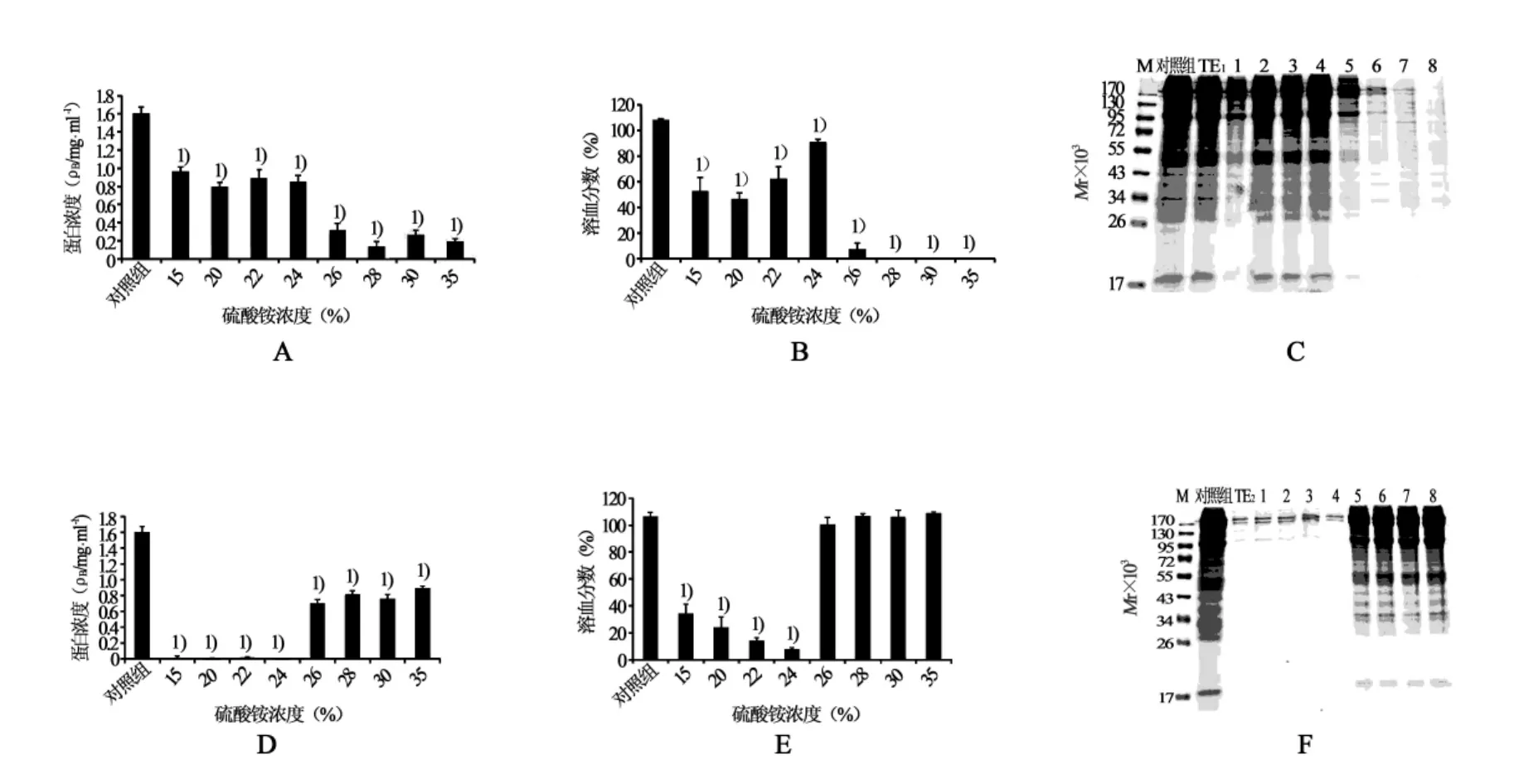
图7 15%~35%硫酸铵溶液对TE蛋白稳定性及其溶血活性的影响
3 讨论
水母粗毒样品主要有刺丝囊毒素和触手提取物两种。刺丝囊毒素是水母蜇伤中毒的直接毒性成分,常用于水母蜇伤中毒机制及其防治研究[8]。本课题组提出触手提取物可作为刺丝囊毒素替代品[6],用于水母蜇伤中毒、水母毒素纯化与鉴定等研究。通过改变所用处理条件,可以降低触手提取物杂蛋白浓度和黏性,使其样品量大、活性易于保持的特点突显出来,从而为水母毒素活性蛋白组分的分离纯化、水母蜇伤防治研究提供一条新的途径。
在0.52 mg/ml浓度以内,TE的溶血活性呈“S”形曲线,具有明显的剂量依赖性,与冯金华等[9]报道的剂量反应关系一致。温度对水母毒素的溶血活性影响显著,比如从箱形水母(Carybdea alata,也称海黄蜂)中提取的毒液,其溶血活性在45℃时急剧下降,煮沸后活性消失[10];37℃时,地中海水母Rhopilema nomadica的毒液没有溶血活性[11],因此,Nomura等[12]报道,箱水母(Carybdea alata)蜇伤中毒后最有效的现场处理方法是用热水浸泡蜇伤部位。温度对TE稳定性影响的观察结果耐人寻味,40℃水浴60 min时,TE溶血活性变化不大,但蛋白浓度降低显著,SDS-PAGE显示几条高亮的大分子蛋白条带密度明显下降,说明40℃水浴1 h预处理可以减少TE中非活性蛋白组分,并降低样品黏性。温度低于40℃时,溶血活性、蛋白浓度以及SDS-PAGE蛋白条带变化都不大;温度高于40℃时,溶血活性迅速下降,60℃水浴60 min溶血活性下降一半,至80、100℃时几乎消失,但此时蛋白浓度反而高于40℃时的浓度值。笔者推测,40℃时蛋白浓度下降最为明显的原因可能与触手组织中含有大量的蛋白酶有关,40℃可能是这些蛋白酶催化作用的适宜温度。4℃条件下放置28 d蛋白浓度略有下降,但溶血活性几乎没有下降,25℃条件下放置28 d时蛋白浓度较4℃放置下降明显,溶血活性在3 d内基本保持不变,提示水母溶血蛋白在一定时间内可在常温(25℃)进行纯化,不必担心温度条件所致的溶血蛋白活性消失。pH值对TE溶血活性的影响呈钟形曲线,pH 8.0是TE保持溶血活性的最优pH条件,pH 6.0~11.0范围内,TE的溶血活性变化不大。另外,强酸尤其是强碱性pH会导致TE大量的蛋白沉淀出现,SDS-PAGE显示,沉淀去除的主要部分是相对分子质量(Mr)为26 000~43 000的蛋白,而对溶血蛋白的影响并不明显。
改变TE所处的缓冲液环境会导致大量的蛋白沉淀出现,说明TE蛋白易受缓冲液的影响而不稳定,水母毒素蛋白的不稳定性是阻碍其分离纯化的主要难点之一[4]。本研究组采用的6种透析缓冲液全部都出现沉淀,并且溶血蛋白也一并沉淀下来,采用PBS复溶后部分沉淀重新溶解,遗憾的是大部分溶血蛋白不能够被重新溶解,仍存在沉淀中。尽管沉淀部分溶血活性非常强烈,且SDS-PAGE显示沉淀中的蛋白条带要比TE少很多,但如何在保持溶血活性的前提下有效重新溶解蛋白沉淀,进入下一步的色谱分离仍是个难题。李荣锋等[13]利用硫酸铵分级沉淀法对沙蜇(Stomolophusmeleagris)毒素粗提液进行初步分离纯化,从50%硫酸铵沉淀中纯化得到抗氧化活性蛋白SmP90。本研究中一个有趣的现象是缓冲液50 mmol/L Na2HPO4+1.5 mol/L(NH4)2SO4(pH 7.0)可以将溶血蛋白“沉淀”,但又可以被PBS很好地重新溶解,笔者利用硫酸铵分级沉淀和透析相结合的方法处理TE,通过“沉淀”作用实现大量富集溶血蛋白组分,发现浓度>26%的硫酸铵溶液对TE中的溶血蛋白具有良好的盐析作用。
总之,TE蛋白稳定性及其溶血活性受各种环境因素的影响显著,40℃水浴1 h预处理可以减少TE中非活性蛋白组分,并降低样品黏性;4℃和pH 8.0的理化环境是TE保持蛋白稳定性和溶血活性的最适条件;浓度>26%的硫酸铵溶液可大量富集溶血蛋白组分,纯化前的预处理和纯化过程中保持最适理化条件,有利于进一步分离纯化溶血蛋白。
[1]Tibballs J.Australian venomous jellyfish,envenomation syndromes,toxins and therapy[J].Toxicon,2006,48(7):830-859.
[2]Kang C,Munawir A,Cha M,et al.Cytotoxicity and hemolytic activity of jellyfish Nemopilema nomurai(Scyphozoa:Rhizostomeae)venom[J].Comp Biochem Physiol C Toxicol Pharmacol,2009,150(1):85-90.
[3]Helmholz H,Ruhnau C,Schutt C,et al.Comparative study on the cell toxicity and enzymatic activity of two northern scyphozoan species Cyanea capillata(L)and Cyanea lamarckii(Peron&Leslieur)[J].Toxicon,2007,50(1):53-64.
[4]Brinkman DL,Burnell JN.Biochemical andmolecular characterisation of cubozoan protein toxins[J].Toxicon,2009,54(8): 1162-1173.
[5]Suput D.In vivo effects of cnidarian toxins and venoms.Toxicon,2009,54(8):1190-1200.
[6]Xiao L,He Q,Guo YF,etal.Cyanea capillata tentacle-only extract as a potential alternative of nematocyst venom:its cardiovascular toxicity and tolerance to isolation and purification procedures[J].Toxicon,2009,53(1):146-152.
[7]Bradford MM.A rapid and sensitivemethod for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal Biochem,1976,72:248-254.
[8]Rocha J,Peixe L,Gomes NCM,etal.Cnidarians as a source of new marine bioactive compounds-an overview of the last decade and future steps for bioprospecting[J].Marine Drugs,2011,9 (10):1860-1886.
[9]Feng J,Yu H,Xing R,et al.Partial characterization of the hemolytic activity of the nematocyst venom from the jellyfish Cyanea nozakii kishinouye[J].Toxicol In Vitro,2010,24(6):1750-1756.
[10]Chung JJ,Ratnapala LA,Cooke IM,et al.Partial purification and characterization of a hemolysin(CAH1)from Hawaiian box jellyfish(Carybdea alata)venom[J].Toxicon,2001,39(7): 981-990.
[11]Gusmani L,Avian M,Galil B,etal.Biologically active polypeptides in the venom of the jellyfish Rhopilema nomadica[J].Toxicon,1997,35(5):637-648.
[12]Nomura JT,Sato RL,Ahern RM,etal.A randomized paired comparison trial of cutaneous treatments for acute jellyfish(Carybdea alata)stings[J].Am JEmerg Med,2002,20(7):624-626.
[13]Li R,Yu H,Xing R,et al.Isolation,identification and characterization of a novel antioxidant protein from the nematocyst of the jellyfish Stomolophusmeleagris[J].Int JBiol Macromol,2012,51(3):274-278.
Protein stability and hemolytic activity of tentacle extract from the jellyfish Cyanea capillata
CHANG Yinlong,XIAO liang,ZHENG Jiemin,WANG Qianqian,ZHANG Liming(Department of Marine Biotechnology,Faculty of Naval Medicine,Second Military Medical University,Shanghai200433,China)
Objective Toinvestigate the influencing factors of the protein stability and hemolytic activity of tentacle extract (TE)from the jellyfish Cyanea capillata.MethodsEffects of various factors and treatments on the protein stability and hemolytic activity of TE were explored by protein detection,hemolytic assay and SDS-PAGE analysis.ResultsTE caused a significant and dosedependent hemolytic effect,and the HU50of TE against0.5%erythrocyte suspensions from SD ratswas 226μg/ml.A 40℃water bath for 1 hour could effectively remove the contaminating proteins in TE.TE retained hemolytic activity at4℃for 28 days but itwas unstable when kept at25℃over 3 days.TE was active in the range from pH 6.0 to 11.0 and the optimum pH was 8.0.Various buffer solutions had significantly different effects on the stability and hemolytic activity of TE,and a good salting-out effect was observed on the hemolytic protein of TE while the concentration of ammonium sulfate solutions was greater than26%.Conclusion A 40℃water bath for 1 hour could effectively remove the contaminating proteins in TE and reduce its viscosity.The optimum conditions formaintaining stability and hemolytic activity of TEwere 4℃and pH 8.0.The salting-outeffect from 26%andmore ammonium sulfate solutionswould be conducive to the enrichment of hemolytic protein.
Cyanea capillata;tentacle extract;stability;hemolytic activity
Q5 [文献标志码]A [文章编号]1006-0111(2014)06-0434-06
10.3969/j.issn.1006-0111.2014.06.009
2013-11-25
2014-07-07[本文编辑]李睿旻
国家自然科学基金(41176126;81370833).
常银龙,硕士研究生.E-mail:donlone@yeah.net.
张黎明,教授,博士生导师.Tel:(021)81871128,E-mail:lmzhang1969@163.com.

